三氮螯合单功能三核铂(II)配合物的DNA结合及其抗肿瘤活性研究
2014-09-14黄晶洪鸣
黄晶,洪鸣
(1.武汉中心医院呼吸内科,湖北武汉430014;2.南京医科大学医学科学部,江苏南京210029)
三氮螯合单功能三核铂(II)配合物的DNA结合及其抗肿瘤活性研究
黄晶1,洪鸣2
(1.武汉中心医院呼吸内科,湖北武汉430014;2.南京医科大学医学科学部,江苏南京210029)
目的本论文以多核螯合Pt(II)抗肿瘤金属配合物为中心,重点开展了三氮螯合单功能三核铂(II)配合物的DNA结合及其抗肿瘤活性的研究工作。方法将30μM配合物[Pt3L1Cl3]Cl3(I)与0.09 mM的5′-GMP溶解在水中,37℃条件下孵化24 h,当反应进行到2 h和24 h时,取出反应液,利用电喷雾质谱方法检测反应产物;配制不同浓度比rb(drug-to-nucleotide ratio)的配合物[Pt3L2Cl3]Cl3(I)和配合物[Pt3L1Cl3]Cl3(II)与pUC19质粒DNA(200 ng)的反应液,37℃下避光孵化12 h,然后在1×TAE buffer(40mM Tris acetate,1mM EDTA)中,用1%琼脂糖凝胶电泳分析其在电泳中的迁移情况;配合物[Pt3L1Cl3]Cl3(I)和II的体外细胞毒活性用白血病细胞株(HL-60)、肺癌细胞株(A-549)和肝癌细胞株(BEL-7402)进行测试。结果电喷雾质谱方法检测反应产物时配合物[Pt3L1Cl3]Cl3(I)极易与5′-GMP快速反应,形成单加合物、双加合物以及三加合物,表明I与5′-GMP较强的结合能力;凝胶电泳实验中测定的配合物[Pt3L1Cl3]Cl3(I)、II的rb值分别为0.099和0.66,配合物[Pt3L1Cl3]Cl3(I)使DNA完全解旋所需浓度大大低于配合物[Pt3L2Cl3]Cl3(II);体外细胞毒活性测试,从测试结果来看,配合物[Pt3L2Cl3]Cl3(II)在浓度10-4M保持了较高的抗肿瘤活性,但是在10-5~10-8M范围内,I、II和顺铂对此细胞株几乎全无毒性,抑制率全部低于40%。结论三氮螯合单功能三核铂(II)配合物的DNA结合对提高药物在生物内的稳定性和降低不良反应有利。
抗癌药物;DNA;铂
随着铂类抗癌药物临床使用的推广,出现了许多难以克服的缺点,如肾毒性、神经毒性、肝毒性、耳毒性和骨髓毒性等,并且还存在抗药性问题[1-3],这些都严重影响患者的治疗效果和生活质量,成为目前亟待解决的问题。Pt3-L与谷胱甘肽(GSH)的反应研究表明,配合物与GSH形成单取代和双取代产物,反应过程中整个骨架保持完整,这对提高药物在生物内的稳定性和降低不良反应有利[4-7]。GSH与配合物作用的质谱动力学显示,Pt-S之间较强的结合能力导致柔性大的配合物[Pt3L1Cl3]Cl3(I)快速与GSH结合,并导致配合物发生分解;由于配体L2的空间位阻限制反应速度,配合物[Pt3L2Cl3]Cl3(II)与GSH形成加合物较慢,并且在形成加合物的过程中,铂配合物的结构骨架没有发生变化,这有利于提高其在生物体内的利用度和减少不良反应[8-10]。这些结果对进一步了解多核铂类抗癌药物的结构-活性关系非常重要,并且可为今后合理设计具有高生物活性的多核螯合铂类配合物提供指导作用。为此,本论文以多核螯合Pt(II)抗肿瘤金属配合物为中心,重点开展了三氮螯合单功能三核铂(II)配合物的DNA结合及其抗肿瘤活性的研究工作。
1 材料与方法
1.1 试剂与仪器 甲醇、氯仿、无水乙醚、丙酮、DMSO等常用溶剂均为国产分析纯,使用前未经纯化。对甲基苯腈购自TCI;K2[PtCl4]、2-氯甲基吡啶盐酸盐、三(2-氨基乙基)胺、2-氯甲基吡啶、2-氨甲基吡啶、2,4,6-三(4-溴甲基苯基)-1,3,5-三嗪和二异丙基乙基胺均购自阿拉丁;NBS、偶氮二异丁腈(AIBN)和三氟甲磺酸购自国药。pUC19质粒DNA购自大连宝生物有限公司,小牛胸腺DNA(CT-DNA)、三羟甲基氨基甲烷(Tris)、溴化3,8-二氨基-5-乙基-6-苯基菲啶鎓(EB)购自sigma。试验中使用的水milli-Q为超纯水。质谱使用了LCQ电喷雾质谱仪(ESMS,Thermo Scientific),用于拟合质谱峰同位素分布方式的软件为Isopro 3.0。
1.2 方法
1.2.1 配合物与5′-GMP的反应:将30μM配合物[Pt3L1Cl3]Cl3(I)与0.09mM的5′-GMP溶解在水中,37℃条件下孵化24 h,当反应进行到2 h和24 h时,取出反应液,利用电喷雾质谱方法检测反应产物(见图1)。
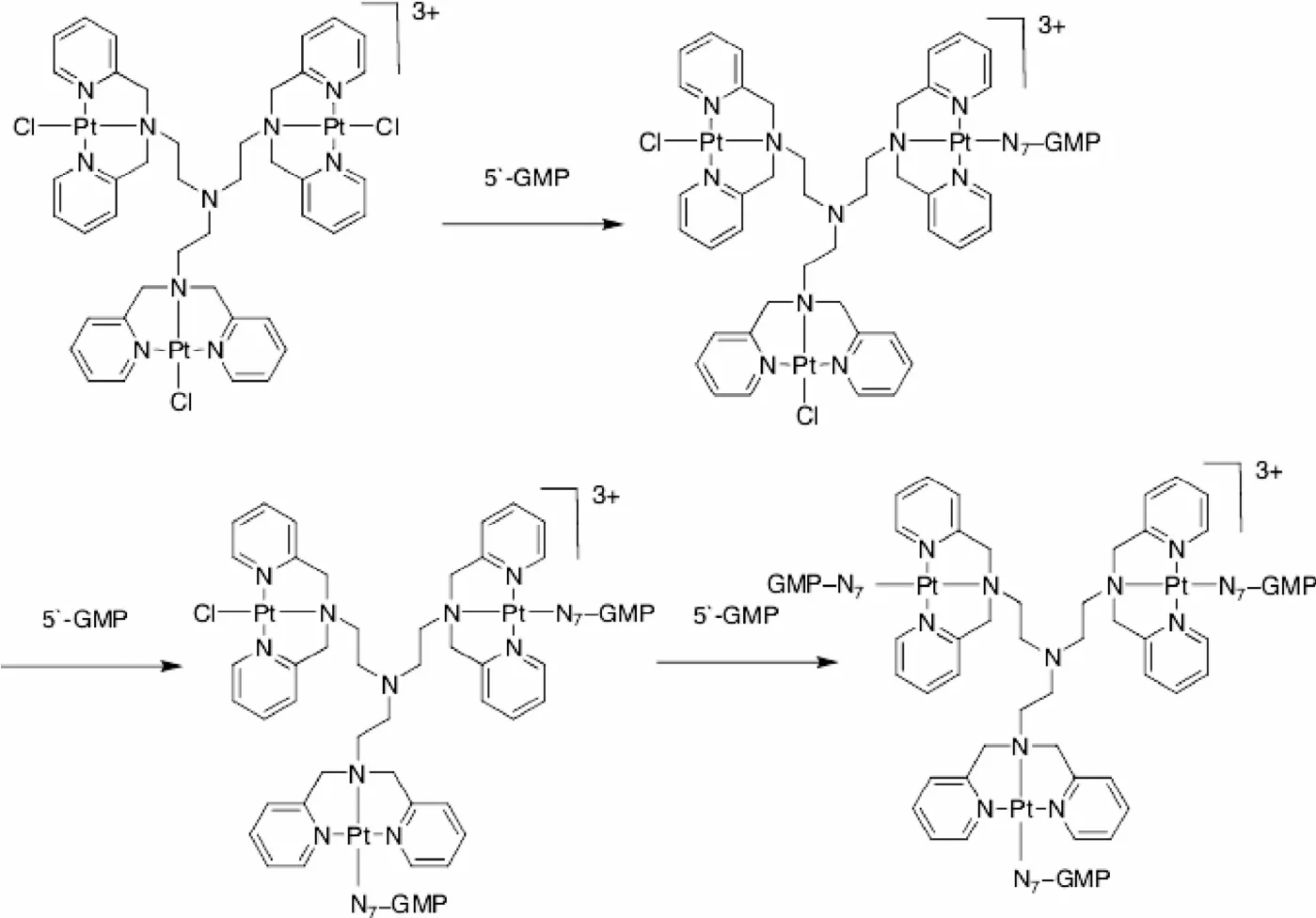
图1 配合物[Pt3 L1Cl3]Cl3(I)与5′-GMP的反应历程Fig.1 Reaction mechanism of complexes Iand 5′-GMP
1.2.2 配合物与质粒DNA的解旋作用:配制不同浓度比rb(drug-to-nucleotide ratio)的配合物[Pt3L1Cl3]Cl3(I)和II与pUC19质粒DNA(200 ng)的反应液,37℃下避光孵化12 h,然后在1×TAE buffer(40mM Tris acetate,1mM EDTA)中,用1%琼脂糖凝胶电泳分析其在电泳中的迁移情况。100 V电压下进行2 h后用0.5μg/mLEB染色,最后用UVP凝胶成像系统完成电泳图的成像。
1.2.3 配合物的体外细胞毒活性检测[11]:配合物[Pt3L1Cl3]Cl3(I)和配合物[Pt3L2Cl3]Cl3(II)的体外细胞毒活性用白血病细胞株(HL-60)、肺癌细胞株(A-549)和肝癌细胞株(BEL-7402)进行测试。肿瘤细胞在添加了10%(v/v)热失活的胎牛血清、2mM谷氨酰胺、100 U/mL青霉素和100μg/mL链霉素的培养基中培养,培养条件为310 K下高湿度的95%空气和5%CO2。配合物对A-549和BEL-7402细胞株的生长抑制活性用磺酰罗丹明B蛋白染色法(sulforhodamine B,SRB)测试。向96孔培养板的每个孔接种100μL粘附肿瘤细胞的培养基,在加入药物前使其粘附24 h。配合物对HL-60细胞株的生长抑制活性用MTT[3-(4,5-二甲基-2-噻唑基)-2,5-二苯基溴化四唑]测定。具体步骤:向96孔培养板的每个空井中接种100μL从指数生长期采集的细胞(含在培养基中),然后按浓度梯度加入待研究的化合物,使最终形成的浓度分别为1×10-4、1×10-5、1× 10-6、1×10-7、1×10-8M。培养板在310 K、含5%CO2的潮湿环境中孵化48 h,每个孔加入浓度为5mg/mL的MTT溶液40μL后再孵化4 h,然后加入100μL“3组份溶液”(10%SDS-5%异丁醇和12mM HCl)。培养板在37℃下温育过夜,在分光光度计上测定540 nm波长下溶液的吸光度。
2 结果
2.1 5′-GMP结合性能的电喷雾质谱研究 铂类抗癌药物在人体内的主要进攻靶点是细胞内的DNA,铂类药物与DNA结合后抑制DNA的复制而导致肿瘤细胞凋亡,达到治疗效果[12]。当配合物[Pt3L1Cl3]Cl3(I)与5′-GMP在37℃下混合反应2 h的时候,出现的2个正离子峰854.83和999.92,分别归属为[Pt3LL1Cl2+GMP]2+(Pt3C52H60N15O8CCl2P)和[Pt3L1+2GMP]2+(Pt3C62H72N20O16P2)。配合物与GMP形成单加合物与双加合物,以单加合物为主。558.33和667.00分别是单加合物与双加合物的三电荷峰,可归属[Pt3L1Cl+GMP]3+(Pt3C52H60N15O8ClP)和[Pt3L1+2GMPP+H]3+(Pt3C62H73N20O16P2)反应进行24 h后,配合物与2个GPM形成的双加合物的峰增强,单加合物的峰明显下降,同时出现的新峰517.33是双加合物的四电荷峰,1181.75为配合物与GMP的三加合物的双电荷峰,可分别归属为[Pt+3L1+2GMP+Na+2H+C2H3OH]4+(Pt3C64H73N20O17P2Na)和[Pt3L1+3GMP+2H]2+(Pt3C72H86N25O24P3)。这说明了反应进行24 h后,配合物与1个GMP形成的加合物少量存在,有一定量的配合物与GMP的三加合物出现,配合物与2个GMP形成的加合物成为主要产物存在于溶液中(见图2)。
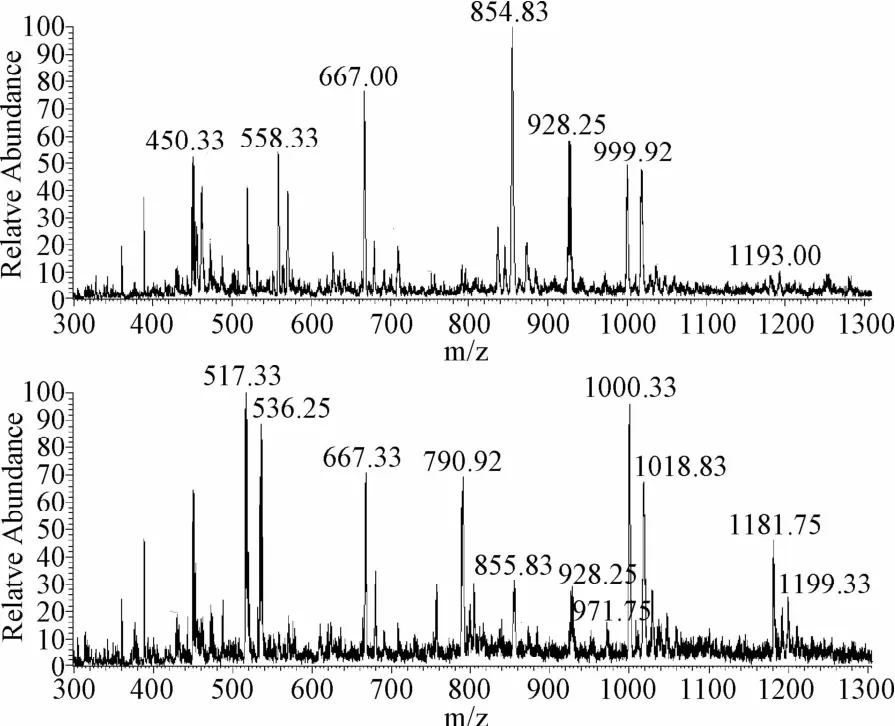
图2 配合物[Pt3 L1Cl3]Cl3(I)与5′-GMP 37℃下反应2、24 h的电喷雾质谱(ESI-MS)Fig.2 Electrospraymass spectrometry(ESI-MS)results of complexes I reactive with 5′-GMP for 2 h,24 h under 37℃
实验结果表明,配合物[Pt3L1Cl3]Cl3(I)极易与5′-GMP快速反应,形成单加合物、双加合物以及三加合物,表明了配合物[Pt3L1Cl3]Cl3(I)与5′-GMP较强的结合能力。
2.2 凝胶电泳研究配合物与DNA的结合 凝胶电泳方法是研究配合物对DNA解旋能力强弱最有效与直接的方法[13]。把这一配合物与核苷酸浓度比值定义为rb对应于完全解除DNA的超螺旋形式所需的铂配合物的量。如下图3所示,实验中测定的配合物[Pt3L1Cl3]Cl3(I)、II的rb值分别为0.099和0.66,配合物[Pt3L1Cl3]Cl3(I)使DNA完全解旋旋所需浓度远低于配合物[Pt3L2Cl3]Cl3(II)。在实验过程中,发现高浓度的配合物[Pt3L2Cl3]Cl3(II)会使部分DNA沉降,这可能是由于配合物[Pt3L2Cl3]Cl3(II)的刚性结构以及+3价电荷的阳离子与负电荷的的DNA骨架结合所导致。配合物[Pt3L2Cl3]Cl3(II)引起部分DNA沉降导致了配合物[Pt3L2Cl3]Cl3(II)的的解旋能力小于I。
配合物[Pt3L1Cl3]Cl3(I)(A)、配合物[Pt3L2Cl3]Cl3(II)(B)与pUC19质粒DNA在37℃温育12 h的凝胶电泳图见图3,其中Lane 1为DNA空白;Lane 2~10(a)的rb值分别为0.033,0.066,0.099,0.132,0.165,0.198,0.231,0.264,0.297;Lane 2~10(b)的rb值分别0.33,0.4125,0.495,0.5775,0.66,0.7425,00.825,0.90775,0.99。
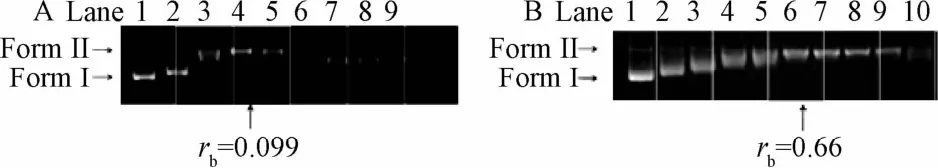
图3 2种配合物凝胶电泳图Fig.3 Gel electrophoresis analysis of two compounds
2.3 配合物与GSH结合的电喷雾质谱表征 本研究利用电喷雾质谱跟踪谷胱甘肽(GSH)与配合物[Pt3L1Cl3]Cl3(I)、配合物[Pt3L2Cl3]Cl3(II)反应产物及反应速度,从而判断配合物与GSH的作用活性[14]。
配合物[Pt3L1Cl3]Cl3(I)与GSH反应进行到2 h时,配合物本身的质谱峰全部消失,说明I与GSH反应较快。3个新峰372.58,577.17和1189.00分别归属为[Pt2+2BPA+GSH+Na-2H]3+(Pt2C34H43N9O6SNa),[Pt2+2BPA+GSH+Cl+Na-2H]2+(Pt2C34H43N9O6SClNa)和[Pt2+2BPA+GSH+2Cl+Na-2H]+(Pt2C34H43N9O6SCl2Na)。配合物[Pt3L1Cl3]Cl3(I)与GSH结合发生了分解,3个BPA铂(II)中心全部与桥连基团分离,而GSH上的S原子分别与2个独立的Pt(BPA)配位(见图4)。这种由于与GSH结合而引起配合物[Pt3L1Cl3]Cl3(I)的分解与Farrell小组报道的经典多核铂配合物BBR3464的分解类似,与铂原子配位的N和其相连的柔性链上的C原子间的共价键断裂,导致配合物分解。反应进行到24 h,主要的质谱峰没有发生改变;溶液中的主要物质还是GSH结合2个Pt(BPA)。
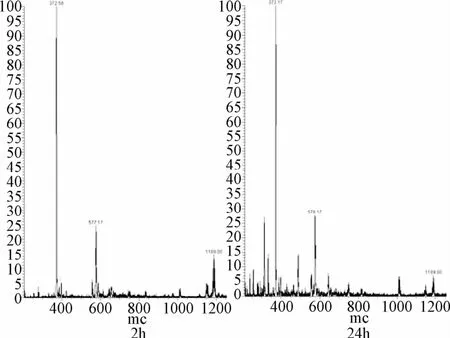
图4 配合物[Pt3 L1Cl3]Cl3(I)与5′-GMP 37℃下反应2、24 h的电喷雾质谱(ESI-MS)Fig.4 Reaction of[Pt3 L1Cl3]Cl3(I)and 5′-GMP for 2 h,24 h,37℃detected by ESI-MS
配合物[Pt3L2Cl3]Cl3(II)和GSH反应的结果与配合物[Pt3L1Cl3]Cl3(I)不同。当配合物[Pt3L2Cl3]Cl3(II)与GSH孵化2 h,检测溶液的正离子峰主要是配合物的离子峰,而出现的1个较弱的新的正离子峰952.33,是配合物与GSH形成的1个单加合物,可归属为[Pt3L2Cl2+GSH-2H]2+(Pt3C70H69N15O6Cl2S)。反应到24 h,虽然Ⅱ与GSH的单加合物峰继续增加,但是配合物本身峰的强度依然很大,说明反应消耗的反应物较少(见图5)。
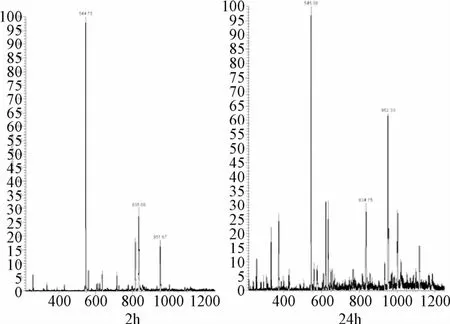
图5 配合物[Pt3 L2Cl3]Cl3(II)与GSH 37℃下反应2、24 h的电喷雾质谱(ESI-MS)Fig.5 Reaction of[Pt3 L2Cl3]Cl3(II)and 5′-GMP for 2 h,24 h,37℃detected by ESI-MS
实验结果表明,配合物[Pt3L1Cl3]Cl3(I)与GSH反应速度较快,并且由于与GSH结合导致配合物的分解,这与连接3个BPA铂中心的基团柔性太大有关系,当S与铂配位后而致使化学键断裂,配合物分解。虽然Pt-S之间有较强的结合能力,由于配体L2的空间位阻作用,配合物[Pt3L2Cl3]Cl3(II)与GSH反应速度较慢。因为配合物[Pt3L2Cl3]Cl3(II)骨架结构的刚性强于配合物[Pt3L1Cl3]Cl3(I),形成了加合物,配合物的骨架依然保持完整,没有因为S与铂配位而致使配合物分解。
2.4 体外细胞毒活性测试 配合物[Pt3L1Cl3]Cl3(I)和配合物[Pt3L2Cl3]Cl3(II)的体外细胞毒活性实验选用白血病细胞株(HL-60),肺癌细胞株(A-549)和肝癌细胞株(BEL-740)进行了测定[15]。对于肺癌细胞株,配合物在所检测的范围内对细胞的抑制率都高于顺铂(见图6)。
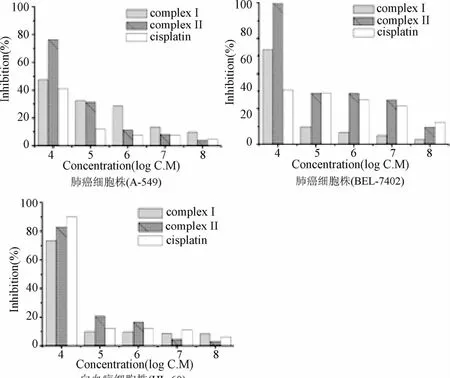
图6 12细胞毒活性图Fig.6 Cytotoxic activity diagrams
从测试结果来看,配合物[Pt3L2Cl3]Cl3(II)在浓度10-4M保持了较高的抗肿瘤活性,但是在10-5~10-8M范围内,配合物[Pt3L1Cl3]Cl3(I)、配合物[Pt3L2Cl3]Cl3(II)和顺铂对此细胞株几乎全无毒性,抑制率全部低于 40%。顺铂、配合物[Pt3L1Cl3]Cl3(I)、配合物[Pt3L2Cl3]Cl3(II)对肝癌细胞株的作用结果显示与肺癌细胞株类似的结果。配合物作用于白血病细胞株的实验中,在10-4M浓度,顺铂对细胞的抑制率高于配合物[Pt3L1Cl3]Cl3(I)和配合物[Pt3L2Cl3]Cl3(II),浓度降低后,配合物与顺铂对细胞的抑制率降幅较大,表现出较低的毒活性。总的来说,对于A-549和BEL-7402细胞株,配合物[Pt3L2Cl3]Cl3(II)表现出比I和顺铂更好的细胞毒活性。
3 讨论
本文选用柔性的三乙胺和刚性的2,4,6-三(4-甲基苯)-1,3,5-三嗪桥连3个Pt-BPA配位基团合成了2个三氮螯合单功能三核铂(II)配合物。凝胶电泳实验表明配合物[Pt3L1Cl3]Cl3(I)的解旋能力强于配合物[Pt3L2Cl3]Cl3(II),这是由于配合物[Pt3L2Cl3]Cl3(II)容易引起DNA沉降所致。此外,这些配合物的DNA结合能力又与其抗肿瘤活性有着内在联系。体外细胞毒活性研究表明,对于A-549和BEL-7402细胞株,配合物[Pt3L2Cl3]Cl3(II)表现出比配合物[Pt3L1Cl3]Cl3(I)和顺铂更好的细胞毒活性,但是总体抗肿瘤活性较低。GSH与配合物作用的质谱动力学显示,Pt-S之间较强的结合能力导致柔性大的配合物[Pt3L1Cl3]Cl3(I)快速与GSH结合,并导致配合物发生分解;由于配体L2的空间位阻限制反应速度,配合物[Pt3L2Cl3]Cl3(II)与GSH形成加合物较慢,并且在形成加合物的过程中,铂配合物的结构骨架没有发生变化,这有利于提高其在生物体内的利用度和减少不良反应。这些结果对进一步了解多核铂类抗癌药物的结构-活性关系非常重要,并且可为今后合理设计具有高生物活性的多核螯合铂类配合物提供指导作用。
[1]王联红,刘芸,袁阜平,等.2-甲氧基乙胺为配体的铂(Ⅱ)配合物的合成及其体外抗肿瘤活性[J].中国药科大学学报,2005,36(2):106-110.
[2]李瑞丹,余尧,谌喜珠,等.Cis-[Pt(NH3)2(H2O)2](NO3)2与1,1-环丁烷二羧酸钠形成的一种新的Pt(Ⅱ)配合物[J].贵金属,2009,30(2):33-36.
[3]朱泽兵,金全,怿红花,等.顺式-水杨酸-(反式-(-)-1,2-环己二胺)合铂(II)的合成、表征及抗肿瘤活性[J].贵金属,2014,(1):56-58,62.
[4]彭娟,胡劲,王庆琨,等.新型铂(Ⅱ)类配合物的合成、表征和抗肿瘤活性[J].贵金属,2013,(3):20-23.
[5]温志寿,朱泽兵,李学杰,等.顺式-没食子酸-二环己胺合铂(II)的合成、表征及抗肿瘤活性[J].中国医药指南,2013,(3):477-478.
[6]朱泽兵,王庆琨,徐红花,等.顺式-甲基丙二酸-二氨合铂(II)的合成、表征及抗癌活性[J].贵金属,2013,(4):40-42.
[7]李立,吕小军,迟绍明,等.三联吡啶铂(Ⅱ)配合物光谱性质的密度泛函研究[J].影像科学与光化学,2010,28(6):433-441.
[8]曹迁永,李志华,卢鑫,等.一种双核磷光环金属铂(Ⅱ)配合物的合成、结构及光谱性质[J].南昌大学学报(理科版),2010,34(3):255-258.
[9]PracharováJ,NovákováO,KarpárkováJ,etal.Toxicity in tumor cells,DNA binding mode,and resistance to decomposition by sulfur nucleophiles of new dinuclear bifunctional trans-Pt~(II)complexes containing long alkane linkers[J].Pure and Applied Chemistry,2013,85(2):343-354.
[10]Altintas I,Heukers R,Van Der Meel R,et al.Nanobody-albumin nanoparticles(NANAPs)for the delivery of a multikinase inhibitor 17864 to EGFR overexpressing tumor cells[J].Journal of Controlled Release,2013,165(2):110-118.
[11]Moker J,Salge-Bartels U,Thiem J,et al.Formation of Glyco-Functionalized Platinum Complexes by Cross-Metathesis and Evaluation of Their Efficacy in Inhibition of Lung Tumor Cell Lines[J].Journal of Carbohydrate Chemistry,2012,31(7/9):702-710.
[12]Olivova R,Stepankova J,Muchova T,et al.Mechanistic insights into toxic effects of a benzotriazolate-bridged dinuclear platinum(II)compound in tumor cells[J].Inorganica Chimica Acta,2012,393(4):204-211.
[13]Huynh VT,Quek JY,de Souza PL,etal.Block Copolymer Micelleswith Pendant Bifunctional Chelator for Platinum Drugs:Effect of Spacer Length on the Viability of Tumor Cells[J].Biomacromolecules,2012,13(4):1010-1023.
[14]Pracharova J,Zerzankova L,Stepankova J,et al.Interactions of DNA with a new platinum(IV)azide dipyridine complex activated by UVA and visible light:Relationship to toxicity in tumor cells[J].Chemical research in toxicology,2012,25(5):1099-1111.
[15]Zou Z,Wu L,Ding H,etal.MicroRNA-30a sensitizes tumor cells to cisplatinum via suppressing beclin 1-mediated autophagy[J].The Journal of Biological Chemistry,2012,287(6):4148-4156.
(编校:吴茜,王俨俨)
Study on three single-function of three nuclear nitrogen chelating p latinum(II)com p lex DNA conjugates and its anti-tumor activity
HUANG Jing1,HONGMing2
(1.Department of Respiratory Medicine,Wuhan Central Hospital,Wuhan 430014,China;2.Department of Medical Sciences,Nanjing Medical University,Nanjing 210029,China)
ObjectiveTo study the conjugate ofmulticore chelating Pt(II)anti-tumormetal complexes and focus on the following research work.Methods30μM complexes Iand 0.09 mM 5′-GMPwere dissolved in water,and incubated for 24 h under the condition of 37℃.When the reaction was carried out for2 h and 24 h,the reaction solution was removed and reaction productswere detected by electrospray ionizationmass spectrometry;the reaction liquids of Iand IIand pUC19 plasmid DNA(200 ng)were prepared at different concentrations(drug-to-nucleotide ratio)and were incubated for 12 h in dark,37℃,and then themigration in capillary electrophoresiswas analyzed by 1%agarose gelelectrophoresis in 1×TAE buffer(40mM Tris acetate,1mM EDTA);cytotoxicity of complexes Iand II in vitrowas tested by human leukemia cell line(HL-60),lung cancer cell line(A-549)and hepatocellular carcinoma cell line(BEL-7402).ResultsElectrospray ionization mass spectrometry method for the detection of reaction product showed that complexes of Iand 5′-GMP responsed quickly and adduct of single,double adduct and three adducts formated,which showed I and 5′-GMP had strong binding ability;Rb values of I,IIwere 0.099 and 0.66 determinated by gel electrophoresis,and complexes I concentration of DNA unwinding was considerably less than complex II;the in vitro cytotoxicity test results showed,the complex II maintained higher antitumor activity in the concentration of10-4M,but I,IIand cisplatin were almost all non-toxic for this cell line in the 10-5~10-8M range,and inhibition rateswere lower than 40%.Conclusion Three single function of three nuclear nitrogen chelating platinum(II)complex DNA conjugates could improve stability of drugs in vivo and reduce the adverse reactions.
anti-tumor drugs;DNA;platinum
R96
A
1005-1678(2014)08-0065-05
国家自然科学基金(81100352)
黄晶,女,本科,主治医师,研究方向:肺部感染,肺部肿瘤,E-mail:qch1821460038@163.com。
