4HPR对人膀胱移行上皮癌细胞T24表面分子E-Cad表达的影响
2014-09-14严璞吕强
严璞,吕强
(1.北京天坛医院泌尿外科,北京100050;2.江苏省人民医院,江苏南京210029)
4HPR对人膀胱移行上皮癌细胞T24表面分子E-Cad表达的影响
严璞1,吕强2
(1.北京天坛医院泌尿外科,北京100050;2.江苏省人民医院,江苏南京210029)
目的检测4HPR对膀胱上皮细胞T24细胞表面分子E-Cad表达的影响,研究其是否能通过调节该分子表达从而降低肿瘤细胞的浸润性。方法培养膀胱上皮细胞T24细胞,利用MTT方法确定合理的药物处理浓度,提取细胞全蛋白、mRNA,分别采用Western blot和RT-PCR检测E-Cad表达。采用免疫荧光试验检测药物处理前后E-Cad表达量的变化及β-Cat表达位置变化。结果采用10μM的4HPR处理T24细胞48 h后,E-Cad基因mRNA和蛋白较对照组均明显增加;同时β-Cat表达位置也由细胞核转向细胞质,位于细胞膜内侧。结论4HPR可使T24细胞E-Cad基因表达增加,其可能通过调节E-Cad的表达,实现其降低肿瘤细胞的浸润性,而起到预防、治疗癌症的目的。
4HPR;E-Cad;T24细胞;浸润性
N-4-羟苯维甲酰胺(N-4-hydroxyphenylretinamide,4HPR)是一种人工合成的维生素A的类似物,与大多数类维A物质一样,在体内外对包括乳腺癌、前列腺癌、膀胱癌在内的多种癌细胞具有生长抑制、诱导凋亡、降低浸润等作用[1-2]。此外,由于其具低肝毒的特点,使其比其它类维A物质更具应用前景,也更受研究者的关注[3-5]。研究显示,4HPR可以通过神经酰胺、活性氧(ROS)以及caspase-3等途径诱导细胞凋亡,但对于其降低癌细胞的浸润力的研究较少[6]。E-钙粘素(epithelial cadherin,ECad)是一种跨膜糖蛋白,几乎表达于所有的正常上皮细胞,它的主要作用是在Ca2+存在的条件下胞外结构域与相邻同型细胞胞外结构域形成同源二聚体结构,胞内部分通过连环素与肌动蛋白骨架结合,维持同型细胞间黏附。肿瘤细胞浸润有一个从原发位置脱落,转移至新的位置的过程,这个过程与E-Cad表达量减少以及血管形成有关[7-9]。临床病理标本研究也显示,许多肿瘤包括尿路上皮癌患者的肿瘤组织都表现出E-Cad与β-连环素的表达异常及其复合物的破坏[10-11]。据此,我们推测4HPR可能是通过增加E-Cad的表达来降低癌细胞浸润力的,增加同型细胞间的相互粘连,从而降低其浸润性,起到预防、治疗癌症的目的。本实验中,本研究以膀胱上皮癌细胞T24为对象,检测4HPR处理前后E-Cad表达水平及β-Cat表达位置的变化。
1 材料与方法
1.1 材料
1.1.1 实验仪器:Steri-Cycle细胞培养箱,Jouan;bkf离心机,湘仪;6f74冷冻离心机,effendorf;1499电泳槽,北京六一;BIO-RAD转膜仪,北京六一;WD-9408C电泳仪,Tanon;IX73倒置显微镜,Olympus;共聚焦荧光显微镜DMLA(CW4000,Leica Germany);凝胶成像系统,Bio-RAD;ECL显色检测系统法国Vilber公司。
1.1.2 细胞实验所用细胞:实验所用T24细胞购自中国典型培养物保藏中心(CCTCC,中国武汉)。
1.1.3 试剂RIPA裂解液(强)、彩色蛋白预染Marker、ECL显色试剂盒均购自北京碧云天公司;β-Cat兔抗人多克隆抗体、β-actin鼠抗人抗体购自SANTA CRUZ公司;E-Cad鼠抗人单克隆抗体购自美国ABcam公司;Alexa Fluor 488标记羊抗鼠、AlexaFluor 594标记鹿抗兔购自antGene公司;4HPR购自Sigma公司;琼脂糖购自BIOWEST公司;cDNA合成试剂盒、PCR试剂盒购自Fermentas公司;RNA(Trizol)提取试剂购自Invitrogen公司;PCR DNA Ladder购自GenScript公司。
1.2 方法
1.2.1 实验试剂及配制:1640培养基:购自杭州吉诺液体1640培养基(由Gibco原粉配制),胎牛血清购自Hyclone,临用时加入胎牛血清至终浓度10%和抗生素至终浓度1%,4℃保存。
pH 7.2的PBS溶液(0.01 mol/L):NaCl 8.0 g,KC1 0.2 g,Na2HP041.42 g,KH2P040.24 g,加双蒸水溶解,定容至1000mL,15磅高压灭菌后,4℃保存。
5×蛋白电泳缓冲液:称取Tris-base 15.1 g,SDS 5 g、甘氨酸94 g溶于800mL双蒸水中,最后定容至1 L,室温保存。
5×loading buffer:称取1M Tris-HC1(pH 6.8)1.25mL,SDS 0.5 g,溟酚蓝25 mg和甘油2.5 m L,最后定容至5 mL,小份(500μL/份)分装,于室温保存,在用之前,每500μL需加入25μLβ-巯基乙醇。
0.25 %胰酶C(0.02%EDTA):用10M HCl调pH至7.7,过滤除菌分装,然后-20℃保存备用。
10%AP(过硫酸按):1 g AP溶于10mL ddH2O中,-20℃保存1周。
10%SDS:1 g SDS溶于10mL ddH2O中,室温保存。
5%封闭缓冲液:2.5 g脱脂奶粉溶于50mL PBS中,4℃保存备用。
1M Tris-HCl(pH 6.8):在烧杯中加入1 L ddH2O,加入Tris 121.1 g,在量筒中定容至1 L,用浓盐酸调PH至6.8,高压后室温保存。
1.5 M Tris-HC1(pH 8.8):在烧杯中加入1 L ddH2O,加入Tris 181.7 g,在量筒中定容至1 L,用浓盐酸调PH值至8.8,高压后室温保存。
30%丙烯酞胺:在烧杯中加入1 L ddH2O,丙烯酞胺290 g,BIS(亚甲基甲叉双丙烯酞胺)10 g,定容至1 L,用滤器滤去杂质,于棕色瓶中4℃保存。
考马斯亮蓝8250:8250 0.25 g,甲醇50mL,冰乙酸40mL,加水到100mL。
脱色液:乙酸50mL,甲醇225mL,ddH20 500mL。
10×转膜缓冲液:Tris 29 g,甘氨酸14.5 g,SDS 1.85 g,加水到500mL。用时取10mL,加20mL甲醇,加70mL双蒸水。
洗膜液:10×PBS 50mL,450mL ddH2O,0.5mL Tween-20。
1.2.2 T24细胞的培养:准备1支10mL离心管,并加入4mL完全1640培养基。从液氮取出冻存的T24细胞,立即38℃水浴使其快速解冻,然后转移到准备好的10mL离心管中,1000 r/min离心5min,弃上清,向离心管中加4mL完全1640培养基,重悬后转移到25 cm2培养瓶中,在37℃,5%CO2的培养箱中培养。
1.2.3 MTT实验测量各孔的吸光值:胰酶消化对数期细胞,终止后离心收集,制成细胞悬液,细胞计数调整其浓度至(5~10)×104个/mL;将接种好的细胞培养板放入培养箱中培养,至细胞单层铺满孔底(96孔平底板),加入1.25、2.5、5、10、20、40μM 4HPR,每孔100μL,设5个复孔。5%CO237℃孵育48 h,倒置显微镜下观察药物的作用效果。每孔加入10μLMTT溶液(5mg/mL,即0.5%MTT),继续培养4 h;终止培养,准备溶解结晶。将上清去掉,每孔加入150μL二甲基亚飒,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪波长570 nm处测量各孔的吸光值。
1.2.4 Western blot检测E-Cad表达量的变化:配制聚丙烯酞胺凝胶(10%分离胶和5%浓缩胶);浓缩胶完全凝固后,拔掉梳子,倒入电泳液至长短玻璃之间1/2处(约125 mL,注意外漏),外槽倒入约250mL电泳缓冲液。每孔上样20μL样本,每面胶取左边第一孔加入3μL蛋白Marker;电泳浓缩胶恒压90 V,分离胶恒压130 V,电泳至溟酚兰刚跑出即可终止电泳。根据Maker条带把膜剪开,分别用PBST配制的一抗4℃孵育过夜(大于10 h),抗体浓度抗说明书推荐浓度配制,并根据结果适当调整。去掉一抗,PBST洗3次,每次10min。加入PBST配制的二抗,室温孵育2 h。去二抗,PBST洗4次,每次10 min。ECL孵育:取A,B液各500μL,混合后均匀涂在膜上,等1min后进行曝光显色。
1.2.5 RT-PCR:引物设计如下:E-Cad:正义链:5′-TCCATTTCTTGGTCTACGCC-3′,反义链:5′-CACCTTCAGCCAACCTGTTT-3′。试剂盒中GAPDH引物序列如下:正义链:5′-CAAGGTCATCCATGACAACTTTG-3′,反义链:5′-GTCCACCACCCTGTTGCTGTAG-3′。
cDNA第一条链合成:准备无RNase的PCR管(200μL)置于冰上:按下列顺序和剂量加入试剂:模板RNA 5μL;Oligo(dT)18 1μL;无RNase水6μL;5×Reaction Buffer 4μL;RiboLockTMRNase Inhabitor 1μL;10mM dNTP Mix 2μL;M-MuLV Reverse Transcriptase 1μL摇匀、离心;42℃,60min孵育;70℃,5min终止反应;-70℃长期保存。PCR:按如下剂量加入试剂(于冰上):10×Taq buffer 5.0μL;2mM dNTP mix 5.0μL;Primer I 0.5μL;Primer II 0.5μL;Taq DNA Polymersae 1.0μL;25 mM MgCl24.0μL;Template cDNA 2.0μL;ddH2O 32μL;混匀,离心按以下程序进行PCR 95℃起始变性3 min 1次;95℃变性30 s 30次;56℃退火30 s30次;72℃延伸30 s30次;72℃终止7min 1次;GAPDH退火温度为58℃。
1.2.6 细胞免疫荧光:取对数生长细胞,用0.25%胰蛋白酶消化,制成单细胞悬液。将细胞接种到预先放置有6mm×22 mm盖玻片(用多聚赖氨酸处理过,使细胞贴壁更牢固,以防脱片)的培养瓶或培养皿中,37℃5%CO2培养1~3 d,待细胞接近长成单层,取出盖玻片,用PBS洗3次,然后4%的多聚甲醛室温固定20min。固定后可开始免疫荧光步骤;用枪吸掉封闭液,立即滴加稀释好的一抗(E-Cad单克隆抗体1∶50和β-Cat多克隆抗体,1∶50),4℃孵育过夜,注意保持样品的湿润;回收一抗,用PBS洗涤3次,每次5min;滴加稀释好的荧光二抗(1∶200),室温孵育1~2 h,此操作需要避光,孵育过程中也要在避光条件下进行;回收二抗,用PBS洗涤3次,每次5min;50%甘油封片,立即在荧光显微镜和共聚焦显微镜(Leica)下观察染色情况,以免荧光淬灭。
2 结果
2.1 不同浓度4HPR对T24细胞的影响 采用MTT法确定合适的药物剂量(作用时间为48 h),选择使药物即可以有效作用于细胞,又不至于诱导其发生凋亡的浓度用于下游实验。利用GraphPad Prism 5.0软件进行直方绘制及统计学分析。故而选用10μM 4HPR来进行下面的实验。
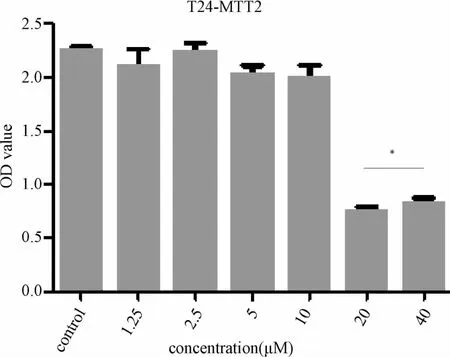
图1 MTT结果直方图Fig.1 The results of MTT histogram
2.2 Western blot检测E-Cad表达量的变化 如图2,结果显示:对照组E-Cad不表达,4HPR处理组表达量明显增加,说明4HPR对E-Cad的表达具有正向调节作用。
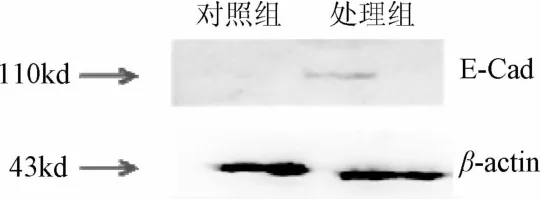
图2 Western blot实验结果Fig.2 Western blot results
2.3 4HPR对E-Cad基因表达影响 从图中可以看出,用10μM的4HPR处理T24细胞48 h之后,与DMSO对照组相比,E-Cad基因在mRNA水平上表达量也有明显增加。说明4HPR对T24细胞E-C ad基因表达水平的调节是多层次。本实验选择GAPDH为内参。
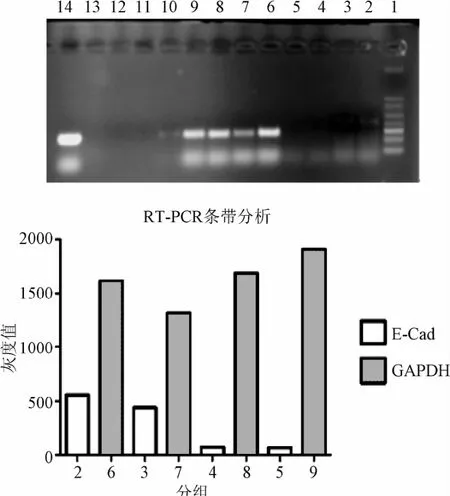
图3 RT-PCR实验结果Fig.3 The experimental results of RT-PCR1:Marker;2,3:处理组;4,5:DMSO对照组;6~9:内参,分别对应组2~5;10~13:阴性对照;14:阳性对照1:Marker;2,3:treatment group;4,5:DMSO control group;6~9:as a control respectively corresponding to group 2~5;10~13:a negative control group;14:a positive control
2.4 细胞免疫荧光 通过免疫荧光技术检测E-Cad表达量的变化及β-Cat表达位置的变化来判断4HPR对细胞的调控效果。选用发绿色荧光的二抗标记E-Cad和红色荧光二抗标记β-Cat。由结果看出,对照组E-Cad几乎不表达,此时β-Cat主要位于细胞核内;与此对应的,经4HPR处理后,E-Cad表达量明显增加,β-Cat的表达位置也由细胞核转移至细胞膜,这与理论相符。
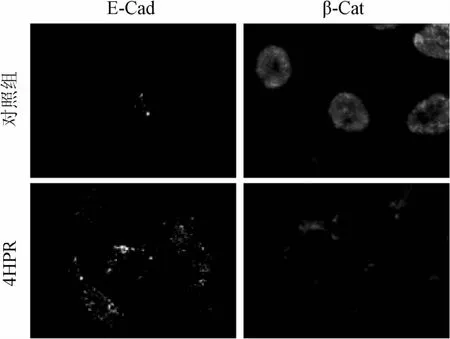
图4 共聚焦图片Fig.4 Confocal images
3 讨论
本课题研究了4HPR对人膀肌移行上皮癌细胞T24 E-Cad基因表达的影响。研究结果显示:用10μM的4HPR处理T24细胞48 h,可以在蛋白质及mRNA水平上观察到E-Cad基因表达增加;另外还观察到β-Cat表达位置发生明显的变化,随着E-Cad蛋白表达量的增加,其由细胞核转移至细胞质中。β连环素(β-Cat)是一个92KD的蛋白,最初是被作为与E-Cad细胞质末端相连接的蛋白被分离出来[11]。它主要的作用是介导E-Cad与β-Cat相连接,进而与细胞骨架相连,维持同型细胞间的相互粘连。细胞中正常表达的E-Cad都是以与β-Cat形成复合体的形式存在。在比较处理前后细胞形态变化时,发现4HPR处理后,细胞形态明显的改变,与正常膀肌上皮癌细胞形态接近,这很可能与细胞的浸润性降低有直接关联。
4HPR是类维生素A家族的一个很具代表性的成员,由于其相对的低毒、组织损伤以及生物活性,阐述其作用机制具有重要的意义[12-14]。本实验结果有力地证实了先前的推测,即4HPR至少部分是通过调节E-Cad基因的表达,促进其与β-Cat复合体形成而起到降低肿瘤细胞浸润性的作用。但是,4HPR可以调节细胞信号通路中多种细胞因子的表达,调节部位多样,而E-Cad基因受调控的方式也包含多种情况[15],所以尚不能确定4HPR是通过具体的什么方式,在何种水平调节E-Cad基因表达的,有待进一步的实验研究。
[1]Parkin DM.International variation[J].Oncogene,2004,23(38):6329-6340.
[2]Sabichi AL,Decensi A.Retinoids in the chemoprevention of bladder cancer[J].Curr Opin Oncol,1998,10(5):479-484.
[3]Rosenberg JE,Carroll PR,Small EJ.Update on chemotherapy for advanced bladder cancer[J].JUrol,2005,174(1):14-20.
[4]Millan-Rodriguez F,Chechile-Toniolo G,Salvador-Bayarri J,et al. Multivariate analysis of the prognostic factors of primary superficial bladder cancer[J].JUrol,2000,163(1):73-78.
[5]杨凯,陆建荣,刘英.维甲酸预防和治疗肿瘤的作用机制的研究进展[J].甘肃医药,2010,29(5):4.
[6]Houle B,Rochette-Egly C,Bradley WE.Tumor-suppressive effect of the retinoic acid receptor beta in human epidermoid lung cancer cells[J].Proc Natl Acad Sci USA,1993,90(3):985-989.
[7]Zhang XK,Liu Y,Lee MO.Retinoid receptors in human lung cancer and breast cancer[J].Mutat Res,1996,350(1):267-277.
[8]Xu XC,Ro JS,Shin DM,etal.Differential expression of nuclear retinoid receptors in normal,premalignant,andmalignanthead and neck tissues[J].Cancer Res,1994,54(13):3580-3587.
[9]Swisshelm K,Ryan X,Lee H,et al.Down-regulation of retinoic acid receptor beta in mammary carcinoma cell lines and its up-regulation in senescing normal mammary epithelial cells[J].Cell Growth Differ,1994,5(2):133-141.
[10]Ferrari N,Morini M,Pfeffer U,et al.Inhibition of Kaposi's sarcoma in vivo by fenretinide[J].Clin Cancer Res,2003(16 Pt1):6020-6029.
[11]Zou C,Ramakumar S,Qian L,et al.Identification of effective retinoids for inhibiting growth and inducing apoptosis in bladder cancer cells[J]. JUrol,2001,165(3):986-992.
[12]Clifford JL,Sabich I,Zou C,et al.Effects of novel phenylretinamides on cell growth and apoptosis in bladder cancer[J].Cancer Epidemiol Biomarkers Prev,2001,10(4):391-395.
[13]Wu JM,Di Pietrantonio AM,Hsieh TC.Mechanism of fenretinide(4-HPR)-induced cell death[J].Apoptosis,2001,6(5):377-388.
[14]Frixen UH,Behren J,Sachs M,et al.E-cadherin-mediated cell-cell adhesion prevents invasiveness of humancarcinoma cells[J].J Cell Biol,1991,113(1):173-185.
[15]Bringuier PP,Umbas R,Schaafsma HE,et al.Decreased E-cadherin immunoreactivity correlates with poor survival inpatients with bladder tumors[J].Cancer Res,1993,53(14):3241-3245.
(编校:吴茜)
Effect of 4HPR on E-Cad expression of human bladder cancer T24 cell line
YAN Pu1,LV Qiang2
(1.Department of Urology,Beijing Tian Tan Hospital,Beijing 100050,China;2.People's Hospital of Jiangsu Province,Nanjing 210029,China)
ObjectiveTo determine the effect of4HPR on E-Cad expression in bladder epithelial cell T24 and study whether E-Cad can be used as a indicator for reference in determining levels of cancer.MethodsT24 cellwere cultured and the reasonable concentration of4HPR were used to treat with the cells,results were determined by MTT method.The expression of E-Cad protein and mRNA were detected by Western blot and RT-PCR,separately,and the location ofβ-Cat were determined.ResultsCompared with control group,the expression of E-Cad protein and mRNA were both increased significantly in 4HPR treated groups.And the location site ofβ-Catwas changed from nucleus to the cytoplasm,next to the cellmembrane. Conclusion 4HPR could up-regulate the expression of E-Cad in T24 cells,as to reduce invasive tumor cells,and prevent cancer.
4HPR;E-Cad;T24 cell;invation
R730.2
A
1005-1678(2014)08-0006-04
国家自然科学基金(BK2011848)
严璞,男,学士,主治医师,研究方向:下尿路肿瘤治疗,E-mail:qch1821460071@163.com。
