坎地沙坦对糖尿病大鼠肾小球Smad1表达的影响
2014-09-13马博清李文丛高琳辉霍丽梅
马博清 李文丛 高琳辉 李 萍 霍丽梅
(河北省人民医院内分泌科,河北 石家庄 050051)
肾小球系膜基质积聚是糖尿病肾病(DN)发病早期重要的病理改变,能够预测糖尿病肾病患者的临床表现,其与肾小球滤过率的降低密切相关〔1〕;近年发现Smad1在糖尿病大鼠肾小球中的表达增加〔2〕,Smad1可以转录调节Ⅳ型胶原的产生〔3〕,从而促进肾小球系膜基质的积聚。在DN中阻断肾素-血管紧张素系统可以延缓肾脏病变的进展,坎地沙坦作为较强的血管紧张素Ⅱ受体阻滞剂,对于能否影响糖尿病大鼠肾小球Smad1的表达,减轻肾脏结构及功能损伤,国内尚无报道。本研究观察坎地沙坦对糖尿病大鼠肾小球Smad1的表达和系膜基质积聚的影响。
1 材料与方法
1.1动物模型制备和分组 清洁级雄性Wistar大鼠(200±20)g 36只,购自河北医科大学实验动物中心。随机选取24只大鼠,一次性腹腔注射链脲佐菌素(STZ)55 mg/kg,72 h后尾静脉取血测随机血糖≥16.7 mmol/L为糖尿病大鼠。造模成功的大鼠随机平分为糖尿病组和坎地沙坦组、正常对照组各12只。坎地沙坦组大鼠给予5 mg·kg-1·d-1坎地沙坦灌胃,另两组给予等量生理盐水灌胃。实验期间自由进食、饮水,不使用胰岛素及其他降糖药物。
1.2标本收集和指标测定 干预12 w末测定全部大鼠尾动脉收缩压(SBP),然后置于代谢笼中收集24 h尿,记尿量,用于24 h尿白蛋白定量(24 h-UAE)、尿肌酐(Ucr)测定;全部大鼠称重,用0.3%戊巴比妥钠腹腔注射麻醉后,颈动脉取血,分离血清,测定空腹血糖(FBG)、血肌酐(Scr);切取左肾,去掉被膜称重,然后分别置于4%多聚甲醛固定留作PAS染色及4%戊二醛中待电镜观察;迅速切取右肾,采用过筛网法微分离肾小球后置于-70℃液氮中冻存〔1〕,用于Western印迹检测。肌酐清除率(Ccr)=:Ucr×每分钟尿量(ml)/Scr,并以体重(kg)校正。肾重指数(KI)=左侧肾脏重量(mg)/体重(g)。
1.3肾脏病理检查 肾组织切片4 μm,行PAS染色;应用Image-Pro Plus图像分析系统对PAS染色切片(400倍)进行图像分析。每张切片随机选取10个正切的肾小球,测定肾小球平均截面积(MGA)及肾小球内PAS阳性染色面积,计算系膜基质分数(MMF)即PAS阳性染色面积/肾小球平均截面积,并根据MGV= β/K×(MGA)3/2计算肾小球平均体积(MGV)〔2〕。使用透射电镜观察肾小球基底膜的厚度、系膜基质及足突变化情况。
1.4Western 印迹检测肾小球Smad1的表达 应用RIPA裂解液,提取肾小球总蛋白,蛋白含量测定采用BCA法。取蛋白样品50 μg,10%SDS-PAGE电泳,转印至PVDF膜上,5%脱脂奶粉封闭2 h,一抗(小鼠抗大鼠Smad1抗体1∶200)4℃过夜。洗膜后包被二抗,DAB显色,以β-actin作为内参照。用凝胶成像仪照相,Quantity One软件分析系统分析蛋白条带的灰度值。
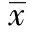
2 结 果
2.1大鼠各项指标变化及比较 干预12 w后,与正常对照组相比,糖尿病组FBG、24 h-UAE、KI、Ccr均显著升高(P<0.01);与糖尿病组相比,坎地沙坦组除FBG外,均明显降低(P<0.05);3组间大鼠SBP无统计学差别(P>0.05)。见表1。
2.2肾小球形态病理变化 PAS染色显示正常对照组大鼠肾小球无明显病理改变;糖尿病组大鼠肾小球内PAS阳性染色物质增多,系膜区增宽,系膜细胞增生,肾小球基底膜增厚;坎地沙坦组上述肾小球病理改变程度均有减轻(图1)。与正常对照组比较,糖尿病组大鼠MGA和MGV均显著增大(P<0.01),MMF明显增高(P<0.01);坎地沙坦组较糖尿病组MGA、MGV及MMF均明显减小(P<0.05)(表2)。透射电镜显示:正常对照组大鼠肾小球毛细血管基底膜均匀一致,足突排列整齐;糖尿病组肾小球毛细血管基底膜不均匀增厚,系膜基质增多,足突增粗、融合破坏;经坎地沙坦干预12 w后,大鼠肾小球基底膜增厚程度、系膜基质增多程度均有所减轻,仅有少量足突融合、破坏(图2)。
2.3肾小球Smad1蛋白的表达 正常对照组大鼠肾小球有少量Smad1的表达,糖尿病组大鼠肾小球Smad1的表达明显增加,差异有统计学意义(P<0.01);坎地沙坦组较糖尿病组大鼠肾小球Smad1表达减弱(P<0.05)(表2)。
2.4相关分析 大鼠肾小球Smad1的表达与MMF(r=0.891,P<0.01)呈明显正相关;24 h-UAE与MMF(r=0.345,P>0.05)无明显相关性。
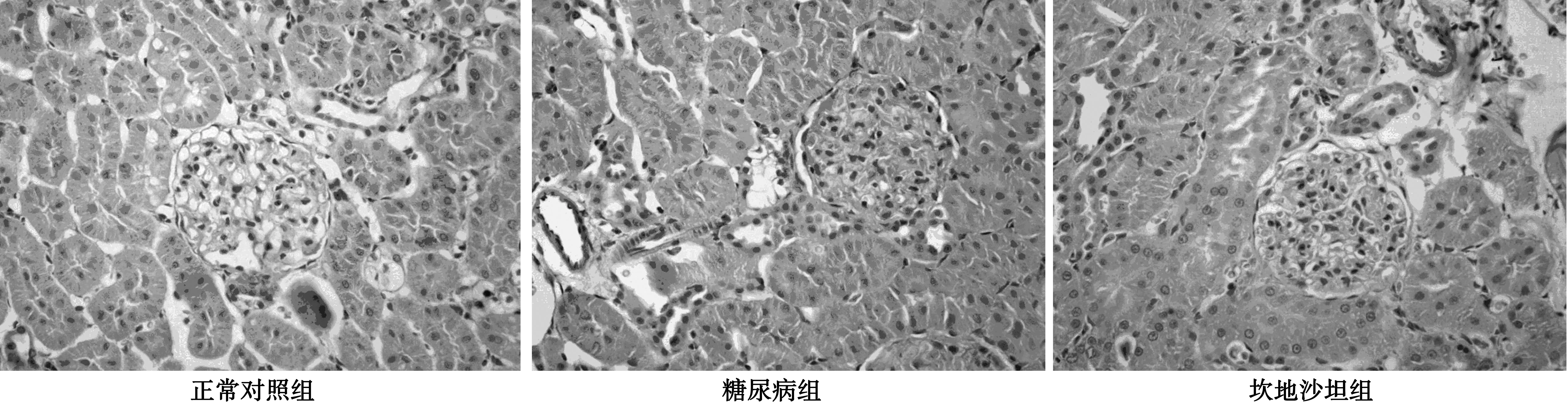
图1 各组大鼠肾小球形态学变化(PAS,×400)
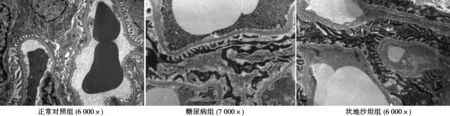
图2 各组大鼠肾小球形态学变化(PAS)

表1 各组大鼠FBG、24 h-UAE、KI、Ccr及SBP的比较±s)

表2 各组大鼠MGA、MGV、MMF及肾小球Smad1表达的比较±s)
3 讨 论
肾小球系膜基质积聚是早期DN重要的病理改变,能够预测DN患者的临床表现,其与肾小球滤过率的降低密切相关。
本研究提示Smad1与糖尿病肾小球系膜基质的积聚有关。与Matsubara等〔3〕的研究结果一致。
本研究还显示糖尿病大鼠在使用坎地沙坦干预之后,肾小球Smad1的表达明显减少,病理改变的程度减轻,推断血管紧张素Ⅱ(AngⅡ)可能是诱导肾小球Smad1产生的因素之一。国外已有研究〔4〕发现,AngⅡ是经由Src活化了Smad1的表达,因为在使用了Src酪氨酸激酶抑制剂后Smad1的活化也同时受到了抑制。
目前微量白蛋白尿被认为是糖尿病肾脏早期损伤的重要标志,然而微量白蛋白尿的预测价值并不如原来所想的那样精确。研究表明,有或没有微量白蛋白尿的糖尿病病人在血压正常、肌酐清除率未降低时,他们的肾小球结构的改变没有明显的不同〔5,6〕。本研究也发现,糖尿病大鼠24 h-UAE排泄量与肾小球系膜基质的积聚无明显的相关性,即不能准确地反映肾小球结构损伤的程度,而肾小球Smad1的表达与这种病理改变密切相关。Mima等〔7〕最新研究发现, STZ大鼠发病早期尿中Smad1排泄的增加与晚期肾小球硬化的发展密切相关。他们还对db/db小鼠做了这方面的研究,也得到了相似的结果,认为尿中Smad1的排泄水平可以成为预测后期肾脏病变进展的新的标志物。
给伴有肾脏疾病的2型糖尿病患者使用AngⅡ受体阻滞剂可以获得比安慰剂和其他抗高血压药物更好的肾脏保护作用,说明了这类药物的肾脏保护作用不只归因于对血压的控制。本实验也得到了一致的结果,说明肾小球的高滤过状态得到改善。本研究还提示坎地沙坦的抗肾小球硬化作用可能部分是通过抑制肾小球Smad1的产生及活化来实现的。
4 参考文献
1Regoli M,Bendayan M.Alterations in the expression of the alpha3 betal integrin in certain membrane domains of the glomerular epithelial cells(podocytes) in diabetes mellitus〔J〕.Diabetologia,1997;40:15-22.
2Ota T,Takamura T,Ando H,etal.Preventive effect of cerivastatin on diabetic nephropathy through suppression of glomerular macrophage recruitment in a rat model〔J〕.Diabetologia,2003;46:843-51.
3Matsubara T,Abe H,Mima A,etal.Expression of Smad1 is directly associated with glomerulosclerosis in diabetic nephropathy〔J〕.Lab Invest,2006;86:357-68.
4Mima A,Matsubara T,Abe H,etal.Angiotensin Ⅱ-dependent Src and Smad1 signaling pathway is crucial for the development of diabetic nephropathy〔J〕.Lab Invest,2006;86:927-39.
5Chavers BM,Bilous RW,Ellis EN,etal.Glomerular lesions and urinary albumin excretion in type I diabetes without overt proteinuria〔J〕.N Engl J Med,1989;320:966-70.
6Fioretto P,Steffes MW,Mauer M.Glomerular structure in nonproteinuric IDDM patients with various levels of albuminuria〔J〕.Diabetes,1994;43:1358-64.
7Mima A,Arai H,Abe H,etal.Urinary Smad1 is a novel marker to predict later onset of mesangial matrix expansion in diabetic nephropathy〔J〕. Diabetes,2008;57:1712-22.
