帕金森病模型大鼠背内侧前额叶皮层锥体神经元电活动及5-羟色胺1A受体敏感性变化
2014-09-13苏兴利郭玉芳
王 爽 高 捷 苏兴利 郭玉芳 霍 健 王 湘
(西安医学院病理生理学教研室,陕西 西安 710021)
帕金森病(PD)非运动系统症状已经被证实与内侧前额叶皮层(mPFC)以及脑内5-羟色胺(5-HT)递质系统相关联〔1〕。神经解剖学证实腹侧背盖区(VTA)发出的多巴胺(DA)能神经纤维可以支配mPFC,尤其是背内侧前额叶皮层中锥体神经元的活动〔2〕。VTA通过对锥体神经元的神经支配,完成对工作记忆和认知等大脑高级功能的调控。另外,背内侧前额叶皮层还接受来源于中脑缝核(RN)的5-HT神经纤维支配,并对背内侧前额叶皮层中锥体神经元的活动起重要的调节作用〔3〕。实验证实,在用6-OHDA损毁SNc方法制作的中晚期PD模型大鼠中,除SNc中的DA能神经元98%以上的损毁外,VTA中的DA能神经元也有40%左右的丢失或损毁〔4〕。而且,黑质纹状体通路的变性能够导致5-HT受体表达的异常,并能够使纹状体、海马和缝核中5-HT的含量显著降低〔5〕。本研究探讨PD状态下,大鼠背内侧前额叶皮层中锥体神经元的电活动,以及5-HT1A受体敏感性的改变情况。
1 材料与方法
1.1动物和药品 雄性SD大鼠23只,体重240~330 g,由西安交通大学医学院实验动物中心提供。大鼠在标准环境饲养,室温20~25 ℃,24 h昼夜循环光照,自由摄食饮水。大鼠随机分为2组:假手术组(n=17)和PD组(n=29)。6-OHDA,8-OH-DPAT,WAY100635和地昔帕明均购自Sigma公司。
1.2PD模型大鼠的行为学检测 采用6-OHDA化学性毁损单侧SNc中的DA能神经元,建立PD大鼠模型。术后第2周给大鼠颈部皮下注射阿扑吗啡(0.05 mg/kg),观察大鼠的旋转行为。若大鼠在药物注射后1~15 min出现向健侧旋转,旋转速度每1 min大于6圈,并且5 min内超过20圈者,表明PD模型成功。不出现旋转、向患侧旋转或旋转总圈数不足者则视为模型不成功,予以淘汰。
1.3电生理学记录和放电形式的分析 电生理学记录在SNc损毁后第3周进行。采用玻璃微电极细胞外记录法记录锥体神经元的放电,电极尖端直径1~2 μm,阻抗10 - 20 MΩ,充灌液为0.5 mol/L醋酸钠含2%滂胺天蓝。细胞放电经MEZ-8301微电极放大器,显示于VC-11记忆示波器,以观察电位波形、频率和细胞放电的形式,同时信号输入监听器监听。将信噪比大于3∶1的、稳定的单细胞放电经生物电信号采集与分析系统(CED1401 Spike2)输入计算机后,作实时观察、储存和进行频率及放电形式的分析。采样时间10~20 min。整个实验过程中监测大鼠的心电,直肠温度维持在(37± 0.5)℃。
1.4局部给药 用双管玻璃微电极(记录电极和给药电极)记录mPFC中锥体神经元的电活动,当记录到锥体神经元自发放电后,稳定10 min,通过给药电极给予8-OH-DPAT溶液100 μl,含8-OH-DPAT 5 μg。一般情况下,微量注射会引起神经元动作电位幅度的轻微降低,这种作用持续约1 min。在统计数据时,微量注射后1 min内的放电活动不予计算。每只大鼠只观察1个神经元对药物的反应。
1.5锥体神经元确认 mPFC中锥体神经元通常表现为缓慢的自发放电,频率0.1~5 Hz;动作电位的波宽> 1 ms;呈现不规则或爆发式的放电形式〔6〕。
1.6统计学方法 采用SPSS13.0软件进行配对t和χ2检验。
2 结 果
2.1各组大鼠电生理学记录 假手术组大鼠锥体神经元放电频率为(0.52±0.10) Hz(n=22),放电范围:0.12~1.62 Hz,平均ISI为(4 184.79±741.53),变异系数为(0.78±0.05)。PD组大鼠锥体神经元放电频率为(1.25±0.20) Hz(n=38),放电范围:0.1~2.52 Hz,与假手术组相比显著升高(P<0.001),平均ISI为(1 645.70±519.91),与假手术组相比显著降低(P<0.001),变异系数为(1.10±0.06),与假手术组相比显著增高(P< 0.001)。
2.2各组大鼠放电形式 假手术组大鼠锥体神经元呈现两种不同的放电形式,不规则放电为81.82%,爆发式放电为18.18%。PD组大鼠放电形式明显趋向爆发式活动,与假手术组大鼠相比,PD组大鼠不规则放电为44.44%,爆发式放电为55.56%,爆发式放电显著增多(P<0.001)。
2.3各组神经元电活动比较 在假手术组大鼠,局部给予8-OH-DPAT(5 μg/100 ml生理盐水)显著抑制锥体神经元的电活动,使锥体神经元的放电频率下降为给药前的(25±4)%;且这种抑制作用可以背WAY100635(50 μg/kg,i.v.)完全反转,放电频率恢复为给药前的(108±6)%,证明抑制作用是通过5-HT1A受体实现的。在PD组大鼠,相同剂量的8-OH-DPAT使锥体神经元的放电频率轻微升高至给药前的(99±11)%。见表1。
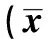
表1 背内侧前额叶皮层中局部给予8-OH-DPAT对各组锥体神经元放电频率的影响±s)
3 讨 论
6-OHDA损毁SNc后,背内侧前额叶皮层中锥体神经元频率升高、爆发式放电活动增强可能和以下原因有关:第一,背内侧前额叶皮层主要接受VTA的DA能神经纤维传入,并且表达D1和D2受体。电或化学刺激VTA以及微电泳DA时,可以使得PFC锥体神经元的自发电活动受到抑制〔6〕。这种抑制作用可能是通过直接作用于突触后D2受体或者间接作用于GABA能中间神经元从而实现的。另外,Wang等〔7〕发现损毁大鼠的SNc后,VTA中的DA能神经元平均丢失32%。而且,6-OHDA单侧损毁内侧前脑束也会导致大鼠PFC中D1和D2受体表达减少。从这些研究可以推断,6-OHDA损毁SNc导致VTA中 DA能神经元的变性,使背内侧前额叶皮层锥体神经元上DA受体表达减少,从而导致了锥体神经元的去抑制。第二,背内侧前额叶皮层也接受来自DRN和MRN的5-HT神经投射。而且,最近资料显示,PFC中50%~60%的锥体神经元和20%~30%的中间神经元上有5-HT1A受体的表达〔8〕。刺激DRN和MRN可以通过激活5-HT1A受体而抑制mPFC中锥体神经元的电活动。在mPFC中,微电泳5-HT和5-HT受体激动剂也可以通过5-HT1A受体产生抑制作用。研究发现在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的猴子PD模型中,PFC中5-HT1A受体密度显著降低〔9〕。解剖学和电生理学研究都强有力的说明黑质-纹状体通路变性导致mPFC中5-HT1A受体表达下降,以及DRN和MRN中5-HT能神经元过度兴奋都可能导致锥体神经元的电活动增强〔10〕。
综上所述,mPFC中锥体神经元的电活动受复杂的内源性和外源性调节。因此,我们推测VTA中DA能神经元的丧失、mPFC中DA含量降低和5-HT1A受体表达的减少,以及缝核5-HT能神经元的过度兴奋都对锥体神经元电活动的增强和呈现爆发式放电神经元的比例增多起重要作用。另外,锥体神经元具有非常广泛的分支,爆发式放电活动对锥体神经元具有非常重要的意义,因为这可以增加动作电位到达神经末梢区域的可能性。因此,爆发式放电增多可能是一种代偿作用。
6-OHDA损毁SNc后,背内侧前额叶皮层中局部应用5-HT1A受体激动剂8-OH-DPAT并不能改变锥体神经元的放电频率可能和以下原因有关:在假手术组大鼠,局部应用8-OH-DPAT显著抑制锥体神经元的电活动,并且可以被选择性5-HT1A受体拮抗剂WAY100635反转,表明5-HT1A受体参与了这一过程。这些结果与以往的文献报道一致〔11〕。另外,5-HT1A受体广泛存在于大鼠脑内锥体细胞的胞体和(或)轴丘上,也表达于mPFC的GABA能中间神经元上。在损毁大鼠局部应用8-OH-DPAT并不能改变锥体神经元的放电频率。因此,DA能神经元的损毁,降低了皮层内5-HT1A受体影响锥体神经元活动的能力。局部应用8-OH-DPAT不能改变锥体神经元的电活动,说明5-HT1A受体功能失调和(或)在此区域内密度降低。
4 参考文献
1Tolosa E,Compta Y,Gaig C.The premotor phase of Parkinson′s disease〔J〕.Parkinsonism Relat Disord,2007;13:S2-7.
2Millan MJ.Serotonin 5-HT2C receptors as a target for the treatment of depressive and anxious states:focus on novel therapeutic strategies〔C〕. Therapie(Paris),2005;60(5):441-60.
3Doder M,Rabiner EA,Turjanski N,etal.Tremor in Parkinson′s disease and serotonergic dysfunction:an 11C-WAY100635 PET study〔J〕. Neurology,2003;60(4):601-5.
4Wang S,Zhang QJ,Liu J,etal.The firing activity of pyramidal neurons in medial prefrontal cortex and their response to 5-HT1A receptor stimulation in a rat model of parkinson′s disease〔J〕.Neuroscience,2009;159(4):850-61.
5Ishihara L,Brayne C.A systematic review of depression and mental illness preceding Parkinson′s disease〔J〕.Acta Neurol Scand,2006;113(4):211-20.
6Tseng KY,O′Donnell P.Dopamine-glutamate interactions controlling prefrontal cortical pyramidal cell excitability involve multiple signaling mechanisms〔J〕.J Neurosci,2004;24(22):5131-9.
7Wang Q,Wang PH,McLachlan C.Simvastatin reverses the downregulation of dopamine D1 and D2 receptor expression in the prefrontal cortex of 6-hydroxydopamine-induced Parkinsonian rats〔J〕.Brain Res,2005;1045(1-2):229-33.
8Santana N,Bortolozzi A,Serrats J,etal.Expression of serotonin1A and serotonin2A receptors in pyramidal and GABAergic neurons of the rat prefrontal cortex〔J〕.Cereb Cortex,2004;14(10):1100-9.
9Hajos M,Gartside SE,Varga V,etal.In vivo inhibition of neuronal activity in the rat ventromedial prefrontal cortex by midbrain-raphe nuclei:role of 5-HT1A receptors〔J〕.Neuropharmacology,2003;45(1):72-81.
10Zhang X,Andren PE,Svenningsson P.Changes on 5-HT2 receptor mRNAs in striatum and subthalamic nucleus in Parkinson′s disease model〔J〕.Physiol Behav,2007;92(1-2):29-33.
11Tierney PL,Degenetais E,Thierry AM,etal.Influence of the hippocampus on interneurons of the rat prefrontal cortex〔J〕.Eur J Neurosci,2004;20(2):514-24.
