恶性血液病化疗后合并真菌性败血症的临床分析
2014-09-12梁晓麓
梁晓麓 郭 智
真菌性败血症是指真菌病原菌侵入血液循环或组织内生长繁殖,产生毒素引起高热或寒战等症状,并导致组织损伤及炎症反应的疾病。化疗是治疗恶性血液病最有效的方法[1],一些剂量偏大的化疗会导致患者粒细胞重度缺乏,出现免疫功能低下,恶性血液病患者本身也容易合并各种感染[2],加上广谱抗生素的应用等宿主因素会导致一部分患者合并真菌性败血症[3],真菌性败血症治疗难度极大,极易导致早期死亡,本研究回顾分析北京军区总医院2011年1月以来收治的恶性血液病化疗后并发真菌性败血症的情况,现报告如下。
1 资料与方法
1.1 一般资料
北京军区总医院血液科于2011年1月至2013年1月共收治180例恶性血液病患者,其中男性102例,女性78例,年龄7~78岁,中位年龄33.8岁。恶性血液病按照FIB分型分为:急性髓系白血病(AML)95例,其中M1型15例,M2型38例,M3型8例,M4型11例,M5型17例,M6型5例,M7型1例;急性淋巴细胞白血病(ALL)21例,其中B细胞型14例,T细胞型7例;淋巴瘤(ML)40例,其中霍奇金淋巴瘤(HL) 6例,非霍奇金淋巴瘤(NHL)34例;多发性骨髓瘤(MM)14例;巨球蛋白血症(WM)4例;噬血细胞综合征4例(HPS);恶性组织细胞病(MH)2例。
1.2 易感因素
全部患者均具有1种或多种易感因素,恶性肿瘤患者180例(100%),化疗后出现粒细胞缺乏150例(83%),有深静脉置管120例(67%),有使用广谱抗菌药物史102例(57%),有使用皮质类固醇激素史91例(51%)。统计全部患者超过一半具备上述所有5种易感因素。
1.3 微生物证据
全部患者化疗中或化疗后出现发热经验性给予抗生素抗感染治疗,同时积极查找感染灶及微生物证据,尤其超过39℃以上的高热或出现寒战时应积极抽血培养,如发热持续3天不退热可加用糖肽类抗生素,仍未能控制可经验性行抗真菌治疗,并统计所有血培养真菌感染阳性的情况,根据药敏试验选用敏感抗真菌药物。真菌培养按全国临床检验操作规程推荐的程序进行,真菌性败血症确诊至少有1次真菌血培养阳性,且符合我国卫生部2001年《医院感染诊断标准(试行)》真菌败血症的诊断标准[4]。
1.4 疗效标准及随访
明确真菌感染后根据药敏试验选用抗生素,用药3天后每天评定疗效,临床疗效评定标准分为痊愈、显效、进步和无效4级,其中痊愈与显效可统称为有效,进步和无效统称为无效。总有效率=(痊愈+显效)/总例数×100%。临床疗效按痊愈、显效、进步和无效进行评价。明确为真菌败血症即开始随访,统计全组发生真菌性败血症患者的治疗效果。
2 结果
2.1 真菌性败血症发生情况
所有患者在出现高热或寒战时多次行血培养,统计全部血培养真菌感染阳性的结果,分析显示,共10例患者血培养真菌阳性,发生率为5.5%,其中男性7例,女性3例,中位年龄40.3岁(16~78岁),原发疾病分别为急性急性淋巴细胞白血病4例,急性髓系白血病3例,多发性骨髓瘤、非霍奇金淋巴瘤及噬血细胞综合征各1例。患者从化疗至出现真菌败血症的时间为7~32天,平均为17.9天,基本都为骨髓抑制期(粒细胞计数﹤0.5×109/L),处于粒细胞缺乏状态,统计全部患者的真菌性败血症的病原菌,剔除同一患者的重复菌株,10例患者的血培养标本中共培养出真菌10例,其中白色念珠菌5例,光滑念珠菌和热带念珠菌各2例,近平滑念珠菌1例,药敏试验显示对氟康唑、伏立康唑、伊曲康唑、两性霉素B和卡泊芬净等常用广谱抗真菌药均敏感(表1)。
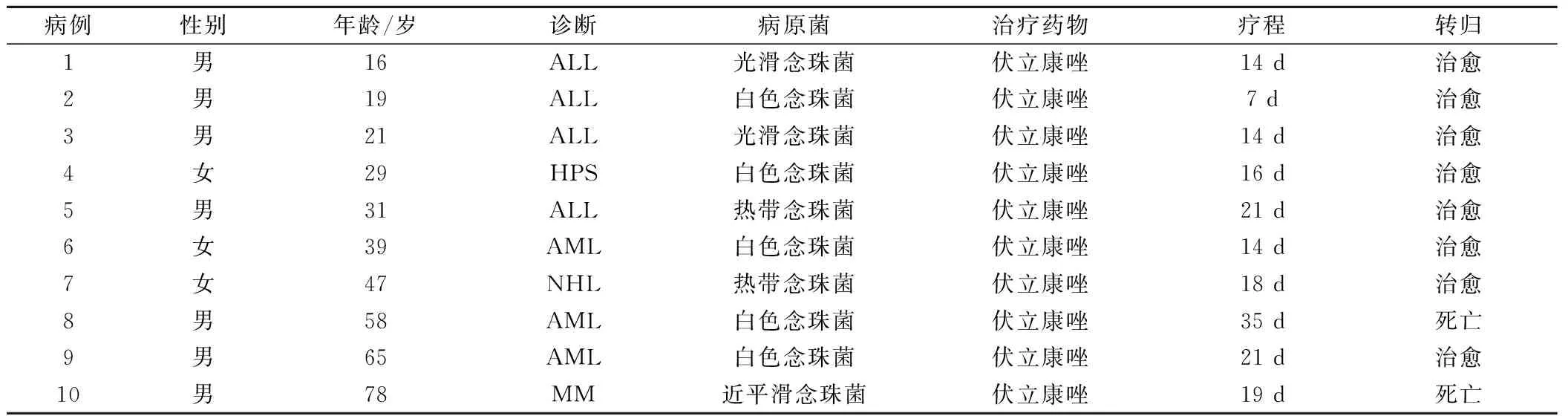
表1 全组患者一般资料
2.2 临床表现
在全组真菌败血症患者中,发热和畏寒是最常见的症状,患者均有不同程度发热,体温在38.5℃~41.2℃,大部分患者为不规则发热,少数呈稽留热型。合并腹胀、腹泻等胃肠道反应3例,合并头痛、头晕、骨痛等症状,可能与基础疾病和本病所处阶段有关。10例患者中同时伴有肺部炎症改变者4例,占40%,均有不同程度咳嗽、咳痰、呼吸困难等症状,2例患者最终因肺部感染加重出现低氧血症至急性呼吸功能衰竭死亡。
2.3 治疗情况
一旦发生真菌性败血症应积极抗真菌治疗,根据药敏选用抗真菌药物,抗真菌药物应用1周以上如体温或症状改善不明显可换用其它抗真菌药物,在明确为真菌性败血症后选用伏立康唑抗真菌治疗(伏立康唑注射液,每次4 mg/kg,每天2次静脉注射)。全组患者治疗时间为7~35 d,平均16.5 d,治疗后有8例治愈,患者体温控制,症状消失;2例因合并肺部感染加重,同时联合抗细菌药物治疗仍无效,最后因急性呼吸功能衰竭死亡,血培养结果显示光滑念珠菌和近平滑念珠菌感染致死各1例,全组总有效率为80%。
3 讨论
真菌性败血症发生率呈逐年增多的趋势,是导致恶性血液病患者化疗死亡的原因之一,这类患者是合并真菌感染的高发人群,随着抗菌药物、免疫抑制剂及皮质类固醇激素的广泛应用有关[5],尤其化疗后造成重度的中性粒细胞缺乏更会出现各种感染,一旦合并上真菌性败血症的死亡率极高[6-7],我们的死亡率仅为20%,死亡的2例患者也是因为同时合并了肺部感染,加重了病情控制无效死亡,全组真菌性败血症的死亡率低可能与总体的病例数较少有关。真菌性败血症一旦发生,若不及时治疗病情会迅速恶化[8],但真菌性败血症的培养检出率很低,且出现培养阳性时一般需要近1周时间,会造成治疗时机的延误,因此早期认识及诊断、合理选择抗真菌药物是治疗的关键[9]。相关文献报道引起真菌败血症的病原菌主要为念珠菌,少数为曲霉菌和隐球菌等[10],念珠菌中的非白色念珠菌感染呈上升趋势,我们本组资料中,病原菌全部为念珠菌,包括白色念珠菌5例、光滑念珠菌和热带念珠菌各2例、近平滑念珠菌1例,白色念珠菌和非白色念珠菌各占50%,与临床报道大致相近。念珠菌的药敏试验均对常用抗真菌药物敏感,我们选用的伏立康唑注射液取得了较好的效果,总结经验为化疗期间应用集落刺激因子缩短粒细胞缺乏时间,对化疗后患者进行全环境保护是减少和控制真菌性败血症的重要环节[11]。对于有真菌性败血症感染的高危患者早期预防性抗真菌治疗亦至关重要,经验性抗真菌治疗已经被推荐用于中性粒细胞缺乏伴有发热并且广谱抗生素治疗无效的患者[12]。
临床上最常用的抗真菌药物是伊曲康唑、两性霉素B、伏立康唑等。伊曲康唑的生物利用度较低,两性霉素B的不良反应较多,伏立康唑是三唑类的抗真菌药,属第2代合成的氟康唑衍生物,作用机制是特异性抑制真菌中由细胞色素P450介导的14-β-固醇去甲基化,从而抑制麦角甾醇的生物合成,具有广谱抗真菌作用[13],具有强大的组织穿透,最小抑菌浓度较稳定,也具有良好的安全性和耐受性[14],我们应用伏立康唑治疗真菌性败血症,临床总有效率达到80%,患者的发热控制,症状得到缓解,血培养转阴,取得了较好的效果,监测患者的不良反应,仅有轻微的皮疹、恶心等不良反应,无需药物干预后好转。真菌性败血症的发生与患者的危险因素有一定相关性,识别出危险因素有助于早期诊断真菌性败血症[15],本组患者中,全部患者均具有一种或多种易感因素,有超过一半患者具备5种易感因素,分别为恶性肿瘤、粒细胞缺乏、深静脉插管、广谱抗菌药物及使用皮质类固醇激素。真菌性败血症病死率高,少部分患者无特异性临床表现,仅表现为寒战、高热等毒血症的症状,临床上与细菌性菌血症不易区分,因此早期未经验性使用抗真菌治疗,一味应用广谱抗细菌抗生素可能会导致病情加重。因此,目前多主张有高危因素患者出现发热常规抗生素控制不佳时经验性抗真菌治疗,需要加强对高危因素患者的真菌感染监测,应及时进行真菌血培养,因血真菌培养所需时间较长,只要临床高度怀疑就应经验性使用抗真菌药物治疗,合理预防抗真菌治疗也能明显降低真菌性败血症的发生率[16]。总之,要改善真菌性败血症的预后,在积极抗真菌治疗的前提下,还要治疗基础疾病及避免或改善易感因素,早期经验性治疗是减少真菌性败血症死亡率的重要方法,不必等待血培养结果再进行治疗。
综上所述,本研究总结了恶性血液病化疗后合并真菌性败血症的临床特点,我们应该在临床工作中综合考虑病原菌的敏感性、感染部位及严重程度、患者情况和抗菌药物的特点等等一系列因素,才能更有效提高真菌性败血症的治疗效果。临床医师尽早进行病原学检查,合理使用抗生素,早期诊断、早期治疗是减少感染死亡率的关键,早期足量用药才能迅速控制感染。总之,真菌性败血症虽是恶性血液病患者化疗后的严重合并症,但通过全环境保护、药物预防和积极正确的经验性治疗等措施,真菌性败血症仍可得到有效预防,从而显著改善患者的预后。
[1] 郭 智,陈惠仁,刘晓东,等.伊马替尼联合Hyper-CVAD方案治疗Ph染色体阳性急性淋巴白血病的临床观察〔J〕.中华医学杂志,2011,91(20):1384-1387.
[2] 李 琳,黄惠民,蔡 敏,等.肿瘤患者医院感染现患率调查分析〔J〕.实用癌症杂志,2009, 24(6):654-655.
[3] 李云霞,邓明佳,沈丽达,等.恶性肿瘤患者院内感染相关因素分析〔J〕.实用癌症杂志,2007,22(3):311-312.
[4] 中华人民共和国卫生部.医院感染诊断标准(试行)〔J〕.中华医学杂志,2001,81(5):314-320.
[5] 于 钟,姜 俊,廖日房,等.真菌性败血症的死亡危险因素及预后分析〔J〕.南方医科大学学报,2008,28(11):2018-2021.
[6] Lehrnbecher T,Frank C,Engels K,et al.Trends in the postmortem epidemiology of invasive fungal infections at a university hospital〔J〕.J Infect JT,2010,61(3):259-265.
[7] 郭 智,何学鹏,刘晓东,等.异基因造血干细胞移植后发生真菌性败血症的临床分析〔J〕.中华医院感染学杂志,2012,22(4):709-711.
[8] Manzoni P,Rizzollo S,Mostert M,et al.Preeclampsia,neutropenia,and risk of fungal sepsis in preterm very low birth weight infants〔J〕.J Pediatr,2011,158(1):173-174.
[9] Sarkar S,Bhagat I,Hieber S,et al.Can neutrophil responses in very low birth weight infants predict the organisms responsible for late-onset bacterial or fungal sepsis〔J〕.J Perinatol,2006,26(8):501-505.
[10] Lepak A,Andes D.Fungal sepsis:optimizing antifungal th-erapy in the critical care setting〔J〕.Crit Care Clin,2011,27(1):123-147.
[11] 程伏林,胡名柏,林从尧,等.化疗所致粒细胞缺乏症患者的院内感染〔J〕.实用癌症杂志,2001,16(6):612-614.
[12] 郭 智,何学鹏,刘晓东,等.伏立康唑对造血干细胞移植所致真菌感染二级预防的作用〔J〕.中华实验和临床感染病杂志(电子版),2011,5(2):36-39.
[13] Rosenberg AD,Wambold D,Kraemer L,et al.Ensuring appropriate timing of antimicrobial prophylaxis〔J〕.J Bone Joint Surg Am,2008,90(2):226-232.
[14] Celik IH,Demirel G,Oguz SS,et al.TCompassionate use of voriconazole in newborn infants diagnosed with severe invasive fungal sepsis〔J〕.Eur Rev Med Pharmacol Sci,2013,17(6):729-734.
[15] Unsinger J,Burnham CA,McDonough J,et al.Interleukin-7 ameliorates immune dysfunction and improves survival in a 2-hit model of fungal sepsis〔J〕.J Infect Dis,2012,206(4):606-616.
[16] Verma S,Bharti B,Inusha P.Association of fungal sepsis and galactosemia〔J〕.Indian J Pediatr,2010,77(6):695-696.
