DCE-MRI灌注指标与MR DWI ADC值在前列腺癌患者中的关系分析
2014-11-15庄伟雄文海忠
崔 凌 庄伟雄 文海忠
目前,前列腺癌(prostate cancer,PCa)在我国老年男性中的发病率逐年上升。有研究表明[1],联合应用动态对比增强 MRI(dynamic contrast-enhanced MRI,DCE-MRI)和扩散加权成像(diffusion weighted imaging,DWI)更有利于提高前列腺癌早期诊断的特异性和敏感性。在此次研究中,我们探讨DCE-MRI灌注指标与DWI ADC值的相关关系,从而研究前列腺癌组织恶性增殖同微循环灌注水平之间的关系。
1 材料与方法
1.1 一般资料
选取本院2007年3月至2013年6月收治入院的前列腺癌患者53例,且均经病理组织切片活检确诊。其中年龄为46~87岁,平均为(73.6±9.3)岁。患者血清前列腺特异性抗原(PSA)升高在0.63~97 ng/ml,平均为(43.17 ±35.35)ng/ml。患者入院后均行DWI和肝脏快速容积采集序列(liver acquisition with volume acceleration,LAVA)动态增强扫描;临床分期:B期13例,C期18例,D期22例。
1.2 仪器与方法
采用Siemens Avanto 1.5 T磁共振扫描仪,心脏相控线圈。整个前列腺、精囊腺部位的轴位T1WI、和冠状位脂肪抑制快速自旋回波(FSE)T2WI扫描以及全盆腔扫描(从而判断是否发生盆腔淋巴结转移)均属于常规扫描序列。动态增强扫描时通过手背浅表静脉按照0.2 ml/kg体质量和 2.5 ml/s的流率团注 1.0 mmol/ml的Gd-DTPA和0.9%的生理盐水20 ml后行轴位 LAVA 增强扫描。TE 1.2 ms,TR 2.7 ms,矩阵272 ×160,视野40 cm ×36 cm,层厚 4.0 mm,层数 660层,单期扫描时间约3.338 s,总共扫描时间在183 s左右,连续扫描55期,范围包括整个前列腺和精囊腺。DWI检查中则特别针对前列腺的薄层进行扫描,使用单次激发EPI序列采集图像。扩散敏感系数(b值)采用0 和750 s/mm,TR 3 300 ms,TE 69 ms,矩阵 128 ×128,视野261 ×380,层间隔1 mm,层厚4 mm,平均次数4,扫描时间为1 min 4 s。
1.3 影像学分析
根据病理活检结果在DWI和DCE-MRI图像上两侧外周带癌区和非癌区感兴趣区(ROI),且尽量避免周围的脂肪、血管和钙化组织结构,呈椭圆形位于外周带内[2]。对DCE-MRI绘制出ROI内的信号强度-时间(signal intensity-time,SI-T)曲线,并计算最快强化率(Rmax)、达峰时间(Tmax)和最大强化程度(SImax)。其中Tmax表示曲线由初始强化至峰值所需时间。SImax=(曲线峰值信号强度-初始信号强度)/初始信号强度×100%;Rmax=(曲线峰值信号强度-初始信号强度)/Tmax×100%。而对 DWI则测量不同 ROI内的 ADC值,患者随机进行3次测量后取其均值。
1.4 统计学分析
将所得数据用SPSS 16.0统计处理软件进行统计学分析,统计结果统一以(s)的形式表示。对于前列腺癌两侧外周带癌区和非癌区DCE-MRI灌注指标和ADC值比较采用t检验,而两者的相关性则进行Person相关分析,P<0.05为差异具有统计学意义。
2 结果
2.1 非癌区同癌区的DCE-MRI灌注指标和ADC值上的比较
在DCE-MRI的表现中,大部分癌灶的影像学表现为在早期即有快速和明显的强化,在Tmax、SImax和Rmax等指标上同非癌区相比,差异显著,具有统计学意义(P<0.05)。DWI上除了部分癌区影像学表现为比正常前列腺外周带略高的信号,其余均表现为明显的高信号,而反映在ADC图像上则为明显的低信号。前列腺非癌区和癌区ADC值分别为(1.59±0.11)×10-3mm2/s和(0.88 ±0.16)×10-3mm2/s,两者差异显著具有统计学意义。见表1。
表1 非癌区同癌区的DCE-MRI灌注指标和ADC对比(s)
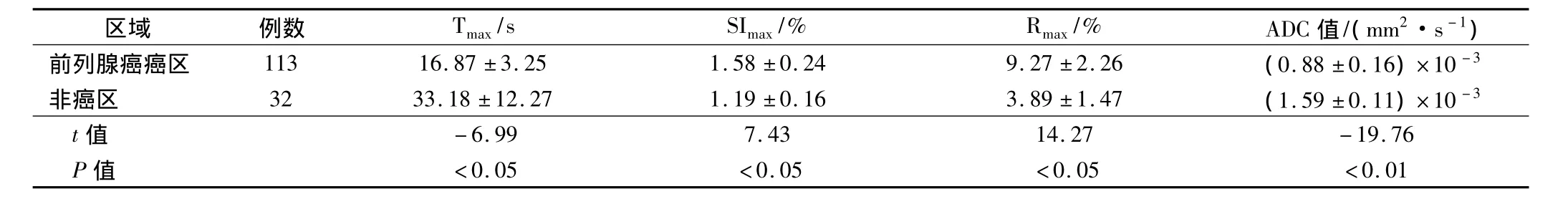
表1 非癌区同癌区的DCE-MRI灌注指标和ADC对比(s)
区域 例数 Tmax/s SImax/% Rmax/% ADC值/(mm2·s-1)前列腺癌癌区 113 16.87 ±3.25 1.58 ±0.24 9.27 ±2.26 (0.88 ±0.16)×10-3非癌区 32 33.18 ±12.27 1.19 ±0.16 3.89 ±1.47 (1.59 ±0.11)×10 -3 t值 -6.99 7.43 14.27 -19.76 P值 <0.05 <0.05 <0.05 <0.01
2.2 不同Gleason评分间DCE-MRI灌注指标比较
不同Gleason评分癌区之间的Tmax、SImax和Rmax之间的差异显著具有统计学意义。表明前列腺癌区组织异型性越高,癌组织中所生成的血管越多,血液供应也就越多。见表2。
2.3 癌区DCE-MRI灌注指标与ADC值的相关性比较
SImax同 ADC 值呈负相关(γ = -0.28,P <0.01);Tmax同 ADC 值呈正相关(γ =0.49,P <0.01);Rmax同ADC 值呈负相关(γ= -0.41,P <0.01)。
表2 不同Gleason评分间DCE-MRI灌注指标比较(s)
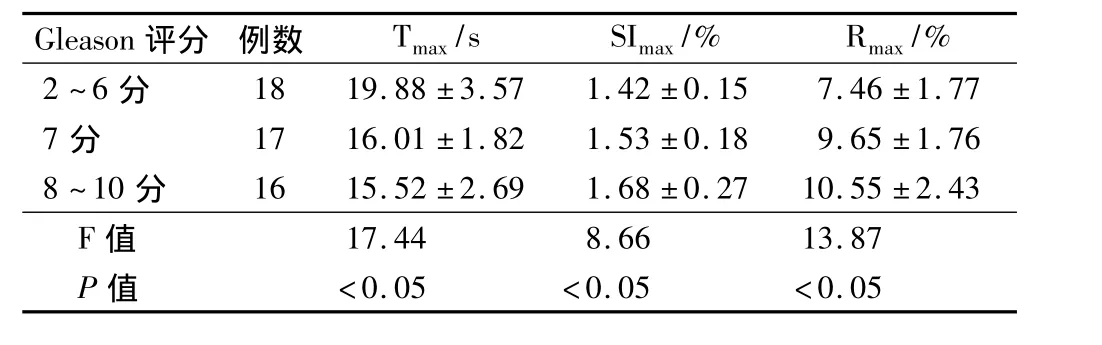
表2 不同Gleason评分间DCE-MRI灌注指标比较(s)
Gleason评分 例数 Tmax/s SImax/% Rmax /%2~6分18 19.88 ±3.57 1.42 ±0.15 7.46 ±1.77 7 分 17 16.01 ±1.82 1.53 ±0.18 9.65 ±1.76 8 ~10 分 16 15.52 ±2.69 1.68 ±0.27 10.55 ±2.43 F值17.44 8.66 13.87 P值 <0.05 <0.05 <0.05
3 讨论
DCE-MRI的原理为使用Gd-DTPA等钆类对比剂通过前臂静脉团注后,从血管达到组织内,使得其信号强化达到峰值。当对比剂在组织中逐渐吸收、排泄,先形成稳定的平衡阶段,随后信号强度便逐渐下降[3-4]。癌灶信号强度大小基本由血管数量和通透性所决定。增强MRI的强化过程往往可以通过SI-T曲线来表示,其反应信号强度变化同时间变化之间的关系,从而在一定程度上反映癌灶血管生成功能和血流动力学变化,是评估肿瘤微循环病理状况的方式[5]。
DWI通过检测组织细胞中的水分子扩散运动特征进行成像,从而反映体内水分子的运动状况[6]。扩散运动越剧烈,扩散系数就越大,相应地DWI信号则越弱,但扩散系数极易受到被检测者血液涡流等因素的干扰并不稳定[7]。因此,往往使用ADC值取代扩散系数用以表示DWI上所测得的生物组织扩散系数。ADC值的数值越大,表示水分子在组织内扩散越快,表现在ADC图上的信号越强,呈白色。
正常前列腺组织在外周带中主要以腺体成分为主,而间质则相对较少并且分布并不紧密,故此在动态增强扫描的初期强化较弱,并且信号增强速度缓慢,而中央区组织因排列紧密故此初期强化明显,信号上升速度快,峰值强度远高于外周带。有研究表明[8],正常前列腺组织与癌灶以及不同Gleason评分癌区之间的Tmax、SImax和 Rmax之间的差异显著,具有统计学意义。表明前列腺癌区组织异型性越高,癌组织中所生成的血管越多,血液供应也就越多。在此次研究中,非癌区与癌区、不同Gleason评分癌区之间的Tmax、SImax和Rmax等指标之间差异显著,均具有统计学意义(P<0.05),同上述观点一致。
正常前列腺外周带中有非常丰富的腺体结构和组织,排列规则,水分子扩散运动范围广,不会受到任何制约;而癌变病灶中由于肿瘤细胞快速增殖,肿瘤细胞排列非常紧密,导致细胞外间隙减少,核浆比高于正常细胞,且间质成分较少,故此含水量较少且扩散运动受到限制,ADC值低于正常组织。在此次研究中,前列腺非癌区 ADC 值为(1.59 ±0.11)×10-3mm2/s,显著低于癌区 ADC 值(0.88 ±0.16)×10-3mm2/s。
有实验研究表明[9],前列腺组织中血管内皮生长因子(VEGF)的表达水平同Tmax呈负相关,而同DCEMRI的强化速率和程度则呈正相关。揭示肿瘤细胞的增殖水平与癌组织中的血液循环丰富程度联系紧密。当肿瘤细胞快速增殖侵润时,其合成的VEGF就越多,从而诱导病灶中微血管大量生成,微循环组织灌注和渗透水平越高。而相应地,微循环的血流量越丰富,所带来的营养也越丰富,有助于肿瘤细胞快速增殖、浸润以及远处转移,Gleason评分也就越高。两者相互作用和影响,形成一种恶性循环[10]。
综上所述,前列腺癌的ADC值和DCE-MRI的灌注指标具有相关关系,能够从影像学的角度上评估肿瘤微循环的病理状况,反映出肿瘤细胞增殖能力同肿瘤微循环之间的关系。此外,DCE-MRI和DWI两种影像学技术联合应用在前列腺癌的早期诊断和分期中具有重要价值,为制定临床治疗方案提供参考依据。
[1]李 鹏,杨文君,陈志强,等.前列腺癌动态对比增强MRi与扩散加权成像的相关性〔J〕.中国医学影像技术,2013,29(2):264-268.
[2]Kim CK,Park BK,Kim B.Diffusion-weighted MRI at 3 T for the evaluation of prostate cancer〔J〕.AJR AmJ Roentgenol,2010,194(6):1461-1469.
[3]彭文通.超声引导对前列腺血流信号异常区的穿刺活检对前列腺癌筛选的价值〔J〕.实用癌症杂志,2013,28(1):89-90.
[4]潘云雷,张 辉,李祖银,等.3.0TDCE-MRI与DWI对前列腺癌的诊断价值及与前列腺特异性抗原的相关性〔J〕.安徽医科大学学报,2012,47(10):1201-1205.
[5]朱海滨,刘 婧,蔡文超,等.前列腺癌MRI动态增强定量参数Ktrans值与Gleason评分的相关性研究〔J〕.中国医学影像学杂志,2012,20(7):481-484.
[6]林志咸,王晔静,陈 超,等.影响慢性前列腺炎电针治疗效应的情志因素分析〔J〕.世界中医药,2013,8(4):437-439.
[7]王朝阳,王维虎,李晔雄,等.CT-MRI图像融合对前列腺癌调强放疗靶区及正常组织剂量影响〔J〕.中华放射肿瘤学杂志,2010,(5):452-455.
[8]靳 冰,王珍光,马 骢.前列腺癌实验室诊断指标的ROC曲线分析〔J〕.实用癌症杂志,2010,25(6):601-602,606.
[9]Kitajima K,Kaji Y,FukaboriY,et al.Prostate cancer detection with 3T MRI:Comparison of diffusion-weighted imaging and dynamic contrast-enhanced MRI in combination with T2-weighted imaging〔J〕.J Magn Reson Imaging,2010,31(3):625-631.
[10]呙林杰,钟光俊,田 罗,等.清利活化法联合心理疏导治疗慢性前列腺炎的临床观察〔J〕.世界中医药,2013,8(2):171-173.
