54例甲状腺炎合并甲状腺恶性肿瘤的临床病理特点分析
2014-09-12张家衡
杨 泳 张家衡
桥本甲状腺炎(hashimoto thyroiditis,HT)是1种甲状腺自身免疫性疾病。HT易并发甲状腺癌或甲状腺恶性淋巴瘤,为分析HT合并甲状腺恶性肿瘤与单纯HT或甲状腺恶性肿瘤的特点及差异,我们对我院2009年7月-2011年7月收治的HT合并甲状腺恶性肿瘤、单纯HT、单纯甲状腺恶性肿瘤患者进行了分组分析,现报告如下。
1 资料与方法
1.1 临床资料
选取我院2009年7月-2011年7月收治的54例HT合并甲状腺恶性肿瘤患者,均经术中检查和病理检查确诊[1],纳入观察组。其中男性5例,女性49例,年龄22~69岁,平均(43.3±9.6)岁,病程15天~16年,平均(17.9±5.2)个月,肿瘤类型:甲状腺癌37例,甲状腺恶性淋巴瘤17例。并选取同期20例单纯HT患者,纳入HT组,其中男性2例,女性18例,年龄21~73岁,平均(42.9±10.4)岁,病程17天~15年,平均(15.9±6.4)个月;20例单纯甲状腺恶性肿瘤患者,纳入恶性肿瘤组,其中男性3例,女性17例,年龄22~70岁,平均(43.0±9.8)岁,病程13天~10年,平均(13.8±5.2)个月,肿瘤类型:甲状腺癌15例,甲状腺恶性淋巴瘤5例。三组患者年龄、性别及病程等指标比较无统计学差异(P>0.05),具有可比性。
1.2 治疗方法
三组患者均根据其临床症状及病情确定治疗方案[2],观察组均接受手术治疗,其中甲状腺全切术5例,甲状腺全切伴颈部淋巴结廓清扫6例,甲状腺全切伴颈中央区清扫3例,患侧甲状腺腺叶全切加峡部和对侧甲状腺次全切除17例,患侧甲状腺腺叶全切与峡部切除19例,肿物姑息切除术4例。
1.3 免疫组化分析
取三组患者甲状腺病理组织标本,石蜡包埋,将蜡块制成4 μm连续切片,脱蜡、脱苯、水化后,使用SP法进行免疫组化染色,分析增殖细胞核抗原(PCNA)及p53蛋白增殖和染色情况[3]:胞核呈现棕色颗粒状即为PCNA阳性,胞核或胞质与胞核同时呈现棕色颗粒状即为p53蛋白阳性,选取10个视野,对每个视野中500个细胞进行计数,计算PCNA增殖指数;p53阳性细胞数≤5%为(-),阳性细胞数>5%为(+)。同时,对CK19、CD45(LCA)、CD20、CD3及Ki-67进行检测。上述检测试剂均购自北京中山公司。
1.4 甲状腺指标检测
采用RIA法[4],对三组患者血清总三碘甲状腺素原氨酸(T3)、血清总甲状腺素(T4)、游离T3(FT3)、游离T4(FT4)、促甲状腺激素(TSH)进行检测。
1.5 随访
对3组患者进行2年的随访,随访日期自2009年7月至2013年7月,观察其生存情况。
1.6 统计学分析
数据应用SPSS 13.0软件进行分析,对计数资料采用卡方检验,对计量资料采用t检验,检验水准设定为α=0.05,当P<0.05时,认为其有统计学差异性。
2 结果
2.1 大体标本检查
肉眼观察可见,观察组标本出现明显甲状腺组织弥漫性增大,边界可见模糊灰白色结节或灰红鱼肉样切面,而HT组切面较为清晰,恶性肿瘤组未见明显甲状腺组织增大;镜检可见,观察组标本出现甲状腺滤泡萎缩、小叶或周边出现明显淋巴滤泡,部分标本可见淋巴上皮损害,而HT组未见小叶周边淋巴滤泡,恶性肿瘤组未见滤泡萎缩。
2.2 免疫组化检查结果
观察组、HT组及恶性肿瘤组PCNA增殖指数分别为(58.2±11.9)%、(1.9±0.7)%及(2.4±1.1)%,观察组PCNA增殖指数显著高于其他两组(P<0.05)。同时观察组p53、CK19、CD45(LCA)、CD20及CD3阳性率均显著高于其他两组(P<0.05),三组患者Ki-67阳性率比较无明显统计学差异(P>0.05),见表1。
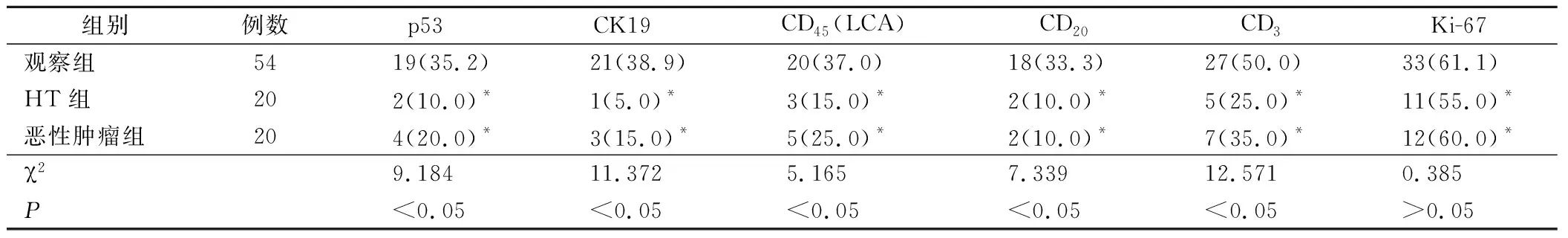
表1 三组患者免疫组化检查结果(例,%)
注:*为与观察组比较,P<0.05。
2.3 甲状腺指标检测结果
观察组T3、T4、FT3、FT4及TSH水平均显著高于其他两组(P<0.05),见表2。
2.4 随访结果
3组患者均获得有效随访,平均随访时间为(19.2±6.6)个月,均正常存活。
3 讨论
HT作为1种常见的甲状腺自身免疫性疾病,其发病率约为3%~4%,其合并甲状腺恶性肿瘤的发病率约为0.38%,虽发病率较低,但由于HT合并甲状腺恶性肿瘤无明显特异性症状,易使恶性肿瘤被误诊,漏诊[5]。王新华等[6]指出,HT合并甲状腺恶性肿瘤的术前漏诊率可达52%以上,多被误诊为单纯HT、结节性甲状腺肿或甲状腺腺瘤,使得在治疗方式的选择上受到影响,贻误治疗时机,影响患者预后。
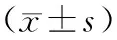
表2 三组患者甲状腺指标水平比较
注:△为与观察组比较,P<0.05。
本组研究发现,肉眼、镜检下,合并甲状腺恶性肿瘤的HT虽存在甲状腺组织切面模糊、小叶或周边出现淋巴滤泡等特征,但其特征不明显,易在快速病理切片检查中被忽视,因此,对甲状腺组织的穿刺活检和各项指标检测显得尤为重要。在免疫组化检查中,可以发现,HT合并甲状腺恶性肿瘤患者的PCNA增殖指数、p53、CK19、CD45(LCA)、CD20及CD3阳性率均显著高于单纯HT和单纯甲状腺恶性肿瘤患者,其主要原因为:p53基因的突变导致了肿瘤的发生,而随着患者HT的发生、发展,其p53基因突变阳性率不断提高,导致肿瘤的侵袭力和转移能力上升,诱发了肿瘤的进一步恶化,导致细胞增殖特性高表达,且各淋巴细胞、免疫因子出现强阳性表达[7]。同时,在甲状腺指标的检测中,可以发现,观察组T3、T4、FT3、FT4及TSH水平均显著高于其他两组(P<0.05),而单纯HT患者多表现为T3、T4、FT3、FT4水平降低,TSH水平升高,HT合并甲状腺恶性肿瘤出现上述特征的原因包括:①HT导致甲状腺结构遭到破坏,从而使甲状腺激素分泌减少,对TSH的分泌带来了负反馈效用,使TSH分泌增加,而长期高水平TSH会使甲状腺不断肿大,促使了该部位恶性肿瘤的发生、发展;②部分HT患者存在器官特异性、抑制性T细胞功能障碍,从而抑制了局部免疫监视、免疫防御功能,使得癌细胞的复制、生长不受控制,加剧了肿瘤的恶化。崔文丽等[8]研究发现,HT合并甲状腺恶性肿瘤的患者往往具有较好的预后,这可能与HT导致的淋巴细胞浸润、渗出,从而抑制了癌细胞的增殖有关,本研究3组患者均获得有效随访,平均随访时间(19.2±6.6)个月,均正常存活,亦印证了上述结论。但临床在治疗HT时一般选取保守治疗,对于甲状腺恶性肿瘤则必须采取手术切除,若出现误诊、漏诊,易导致患者甲状腺恶性肿瘤进一步发展,导致出现远处转移,严重影响患者的远期生存率,因此,对HT合并甲状腺恶性肿瘤患者的早期确诊和干预,是保证其预后和远期生存质量的关键所在。
综上所述,HT合并甲状腺恶性肿瘤在肉眼、镜检时无明显特异性表现,应进一步行免疫组化和甲状腺指标检测,按照其PCNA、p53、T3、T4、FT3、FT4及TSH水平的变化确定病变类型,以指导早期治疗方案,改善其预后。
[1] Chui MH,Cassol CA,Asa SL,et al.Follicular epithelial dysplasia of the thyroid:morphological and immunohistochemical characterization of a putative preneoplastic lesion to papillary thyroid carcinoma in chronic lymphocytic thyroiditis〔J〕.Virchows Arch,2013,462(5):557-563.
[2] 龚 婷,王家东.钙化对甲状腺肿瘤良恶性判断的意义及其分子生物学机制〔J〕.临床耳鼻咽喉头颈外科杂志,2012,26(16):763-766.
[3] Olson MT,Boonyaarunnate T,Aragon Han P,et al.A tertiary center's experience with second review of 3885 thyroid cytopathology specimens〔J〕.J Clin Endocrinol Metab,2013,98(4):1450-1457.
[4] 王 璐,王娟红,王 頔,等.巢蛋白nestin在人甲状腺常见肿瘤组织的表达〔J〕.实用肿瘤杂志,2010,25(5):515-518.
[5] Yoshida N,Nishikori M,Izumi T,et al.Primary peripheral T-cell lymphoma,not otherwise specified of the thyroid with autoimmune thyroiditis〔J〕.Br J Haematol,2013,161(2):214-223.
[6] 王新华,张国昌,刘延玲,等.甲状腺肿瘤患者Ras相关区域家族1A基因启动子异常甲基化的检测〔J〕.陕西医学杂志,2009,38(7):790-792.
[7] Smith JJ,Chen X,Schneider DF,et al.Cancer after thyroidectomy:a multi-institutional experience with 1,523 patients〔J〕.J Am Coll Surg,2013,216(4):571-577.
[8] 崔文丽,陈 晓,刘 存,等.Gal-3、PTTG和Ki-67在甲状腺良恶性肿瘤中的表达及其鉴别诊断意义〔J〕.陕西医学杂志,2009,38(6):670-672.
