新疆乳腺癌患者外周血中p16基因甲基化的检测意义
2014-09-12李莉鲁英杨晓燕欧江华齐新
李莉,鲁英,杨晓燕,欧江华,齐新
(1.新疆医科大学公共卫生学院 劳动卫生与环境卫生学教研室,新疆 乌鲁木齐 830011;2.新疆医科大学附属肿瘤医院 乳腺外科,新疆 乌鲁木齐 830011)
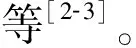
p16基因是近年新发现的一种抑癌基因,是人类肿瘤中最常见的抑癌基因,位于人类第9号染色体短臂21区(p21),编码相对分子质量为16 000的蛋白质,可抑制细胞周期蛋白依赖性激酶4和6的活性,防止细胞增殖,使Rb蛋白的磷酸化程度降低,阻止细胞进入S期,从而起到负性调节作用。早期正常情况下,P16蛋白与cyclin D竞争与CDK4结合,当p16基因发生突变或功能缺失时,一方面不能产生蛋白竞争结合CDK4阻止细胞进入S期,另一方面又促进了cyclin D1与CDK4结合形成复合物,导致细胞过度增生,向肿瘤方向发展[4]。
p16基因启动子区CpG岛甲基化,会导致基因转录终止,引起基因失活,与肿瘤的发生、发展密切相关[5]。研究[6]证实,p16基因启动子区CpG岛甲基化与脑部肿瘤、乳腺癌、结肠癌、头颈部肿瘤、肺癌、白血病等多种肿瘤的发病相关。本研究检测了p16基因各位点的甲基化率,希望通过对p16甲基化的了解,获得日后针对乳腺癌患者的个性化治疗或早期检测措施。
1 材料与方法
1.1 标本收集
2011年5月至2012年7月入住新疆医科大学附属肿瘤医院的新疆常住各族女性已确诊为原发性乳腺癌的患者54例,且术前均未进行放、化疗,以健康体检中心无乳腺疾病史及肿瘤史的自愿接受配对的女性54例按年龄相差±2岁、同民族的原则1∶1配对进行病例对照研究。
1.2 样本处理
血液样本各3 ml,于EDTA抗凝管中当天取回并放置-80 ℃冰箱保存。
1.3 实验步骤
1.3.1 研究选取p16基因片段 见图1。

图1P16基因甲基化区域图本课题研究所选取片段:PM00139972
Fig1ThechartofP16genemethylationregion
1.3.2 DNA的提取 从抗凝血中提取DNA:根据BioTeke DP2202大量全血基因组DNA提取试剂盒说明提取。在波长260 nm和280 nm处测光密度值(OD值),并计算DNA浓度和纯度。
1.3.3 亚硫酸氢盐转化 按照EpiTect Plus DNA Bisulfite试剂盒(QIAGEN公司)说明进行亚硫酸氢盐转化,终体积为140 μl,即DNA模版,-20 ℃保存。
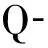
1.3.5 PCR扩增产物测定 用全自动核酸分析仪,无需备胶,放入卡夹,插入芯片,在WP、WI槽中放入8 ml 洗涤缓冲液和2 ml矿物油,缓冲槽里放入18 ml分离缓冲液和4 ml矿物油,在96孔架中放入样品,做好标记,每管2 μl PCR扩增产物和18μl的稀释缓冲液,放入标记,进行全自动分析。
1.3.6 焦磷酸测序反应前单链DNA制备 Beeds 3 μl,结合缓冲液40 μl,模版20 μl,水17 μl配置为80 μl的微珠预混液,同时配置40 μl预混液:测序引物4 μl,退火缓冲液 36 μl。探头吸附微珠预混液后依次经体积分数70%乙醇、变性液和洗液,利用真空预处理器使标有生物素的DNA单链与未标记生物素的DNA单链解链:探头竖起直至水抽干,对准测序反应板,关闭真空,停留3 s,吸附预混液,将测序反应板置80 ℃ 2 min,取出放置室温。
1.4 统计学处理
对数据进行正态性检验,发现数据不符合正态分布,所以应用SPSS 17.0统计软件进行配对秩和检验分析,检验水准α=0.05。
2 结 果
2.1 PCR产物的鉴定结果
见图2。图中A3是15~600 bp的标记,A1、A2是某对样本p16区域PM00139972基因甲基化PCR扩增结果,这与QIAGEN公司提供的参考长度175 bp基本一致,PCR扩增的是目标片段而且没有引物二聚体。

图2p16基因片段PM00139972的PCR鉴定结果
Fig2ThePCRidentificationresultsofp16genePM00139972
2.2 p16基因启动子区域焦磷酸测序图
见图3、4。片段PM00139972有4个甲基位点。
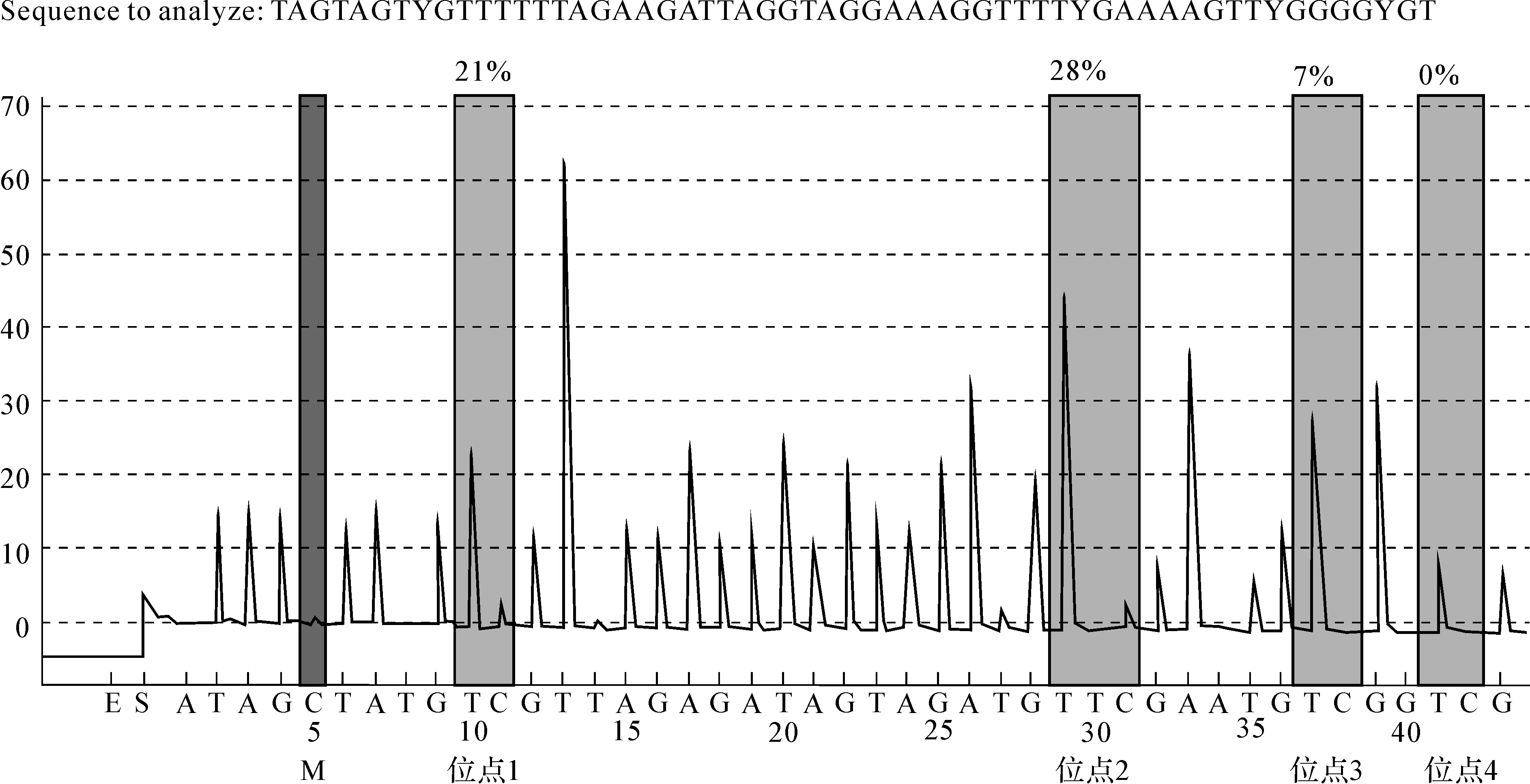
图3病例组某样本p16基因CpG岛甲基化程度位点1为21%,2为28%,3为7%,4为0%
Fig3CpGislandmethylationofp16geneinapatientgroupsample
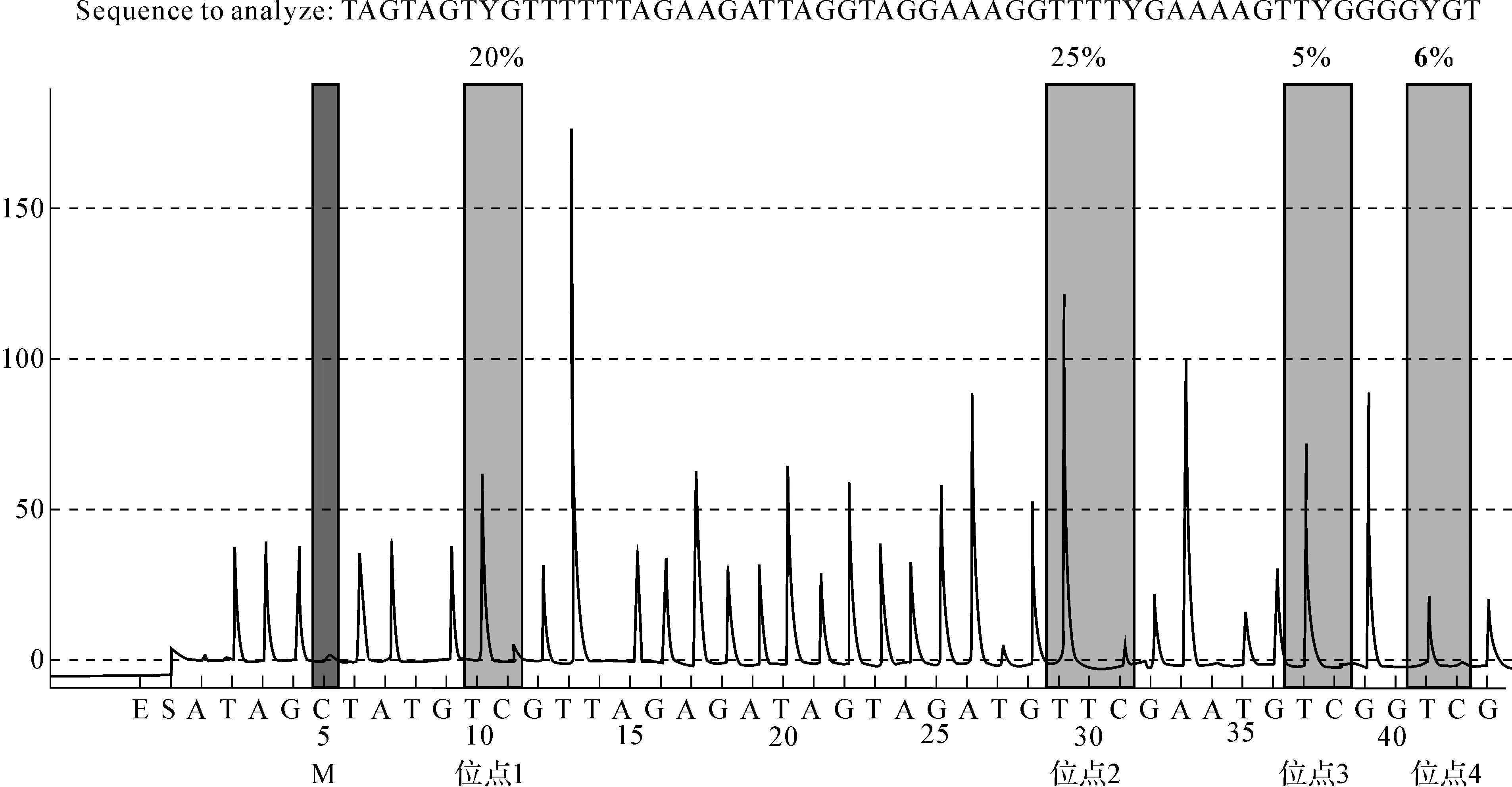
图4对照组某样本p16基因CpG岛甲基化程度位点1为20%,2为25%,3为5%,4为6%;M.亚硫酸氢盐转化内质控
Fig4CpGislandmethylationofp16geneinacontrolgroupsample
2.3 p16基因各位点甲基化与雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受 2(HE 2)、年龄分组及临床病理分级的关系
表1p16基因各位点甲基化与年龄及病理等指标关系的分析
Tab1Analysisoftherelationshipbetweenp16genemethylationandpathologicalindicatorsandage
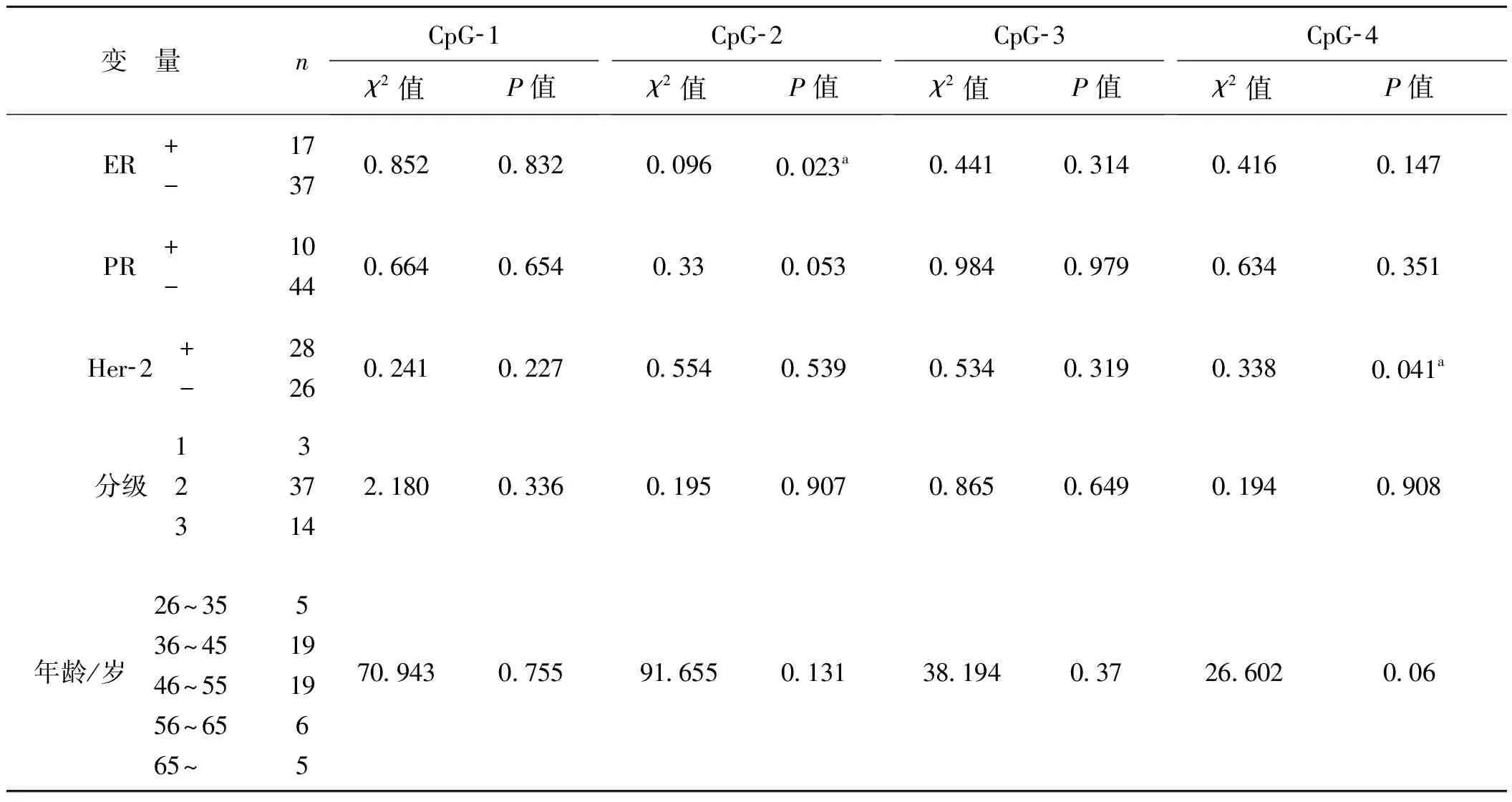
变 量nCpG-1χ2值P值CpG-2χ2值P值CpG-3χ2值P值CpG-4χ2值P值ER +-17370.8520.8320.0960.023a0.4410.3140.4160.147PR +-10440.6640.6540.330.0530.9840.9790.6340.351Her-2 +-28260.2410.2270.5540.5390.5340.3190.3380.041a分级 123337142.1800.3360.1950.9070.8650.6490.1940.908 年龄/岁 26~35 36~45 46~55 56~65 65~519196570.9430.75591.6550.13138.1940.3726.6020.06
aP<0.05
2.4 p16基因各位点在病例组与对照组的甲基化
p16基因各位点甲基化率在病例组和对照组中差异无统计学意义(表2)。
表2p16基因各位点在病例组与对照组的甲基化关系的比较
Tab2Methylationcomparisonbetweencasegroupandcontrolgroupsofeachgenelocusinp16gene
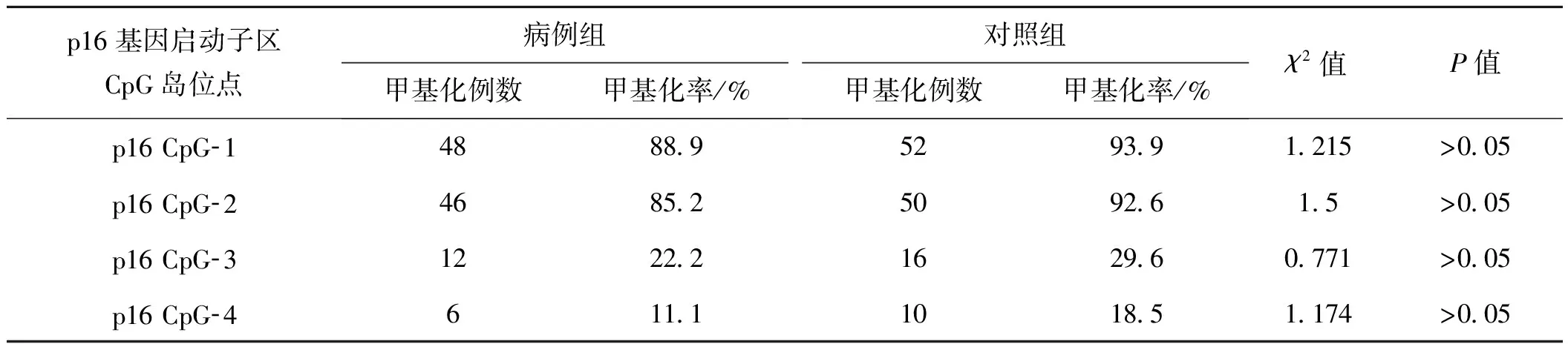
p16基因启动子区CpG岛位点病例组甲基化例数甲基化率/%对照组甲基化例数甲基化率/%χ2值P值p16 CpG-14888.95293.91.215>0.05p16 CpG-24685.25092.61.5>0.05p16 CpG-31222.21629.60.771>0.05p16 CpG-4611.11018.51.174>0.05
3 讨 论
p16基因的异常表达可能导致肿瘤细胞增殖活性增加,促进肿瘤的发生,而且是导致乳腺癌淋巴结转移的重要原因[13]。淋巴结转移是乳腺癌的独立预后因子,也是决定化疗与否及方案选择的重要指标[14]。乳腺癌切除术后,临床实验参考点只有复发或者死亡,这一不良结果通常需要很长的时间随访[15],若能通过对p16基因和ER、PR等的联合检测来预测患者预后,那么就可以提前采取治疗方法进行预防。本课题组将进一步加大样本量进行检测,同时对患者进行随访,结合环境等因素,探讨乳腺癌患者治疗前后甲基化的变化及总生存时间等预后情况,为临床治疗和预后提供更多依据。
[12] SHEN S X,DAHUI Q.Pyrosequencing data analysis software:a useful tool for EGFR,KRAS,and BRAF mutation analysis[J].Diagn Pathol,2012,7:56.