组织蛋白酶D对CD11b+髓系来源细胞体外增殖、迁徙和侵袭的影响及侵袭机制
2014-09-12孙万里周家华
孙万里,周家华
(东南大学附属中大医院 肝胆外科,江苏 南京 210009)
肿瘤患者的预后与肿瘤的侵袭和转移密切相关[1],远处转移已经成为提高患者生存率的主要障碍。有一种新的假说,在肿瘤细胞到达靶器官之前,预转移小生境(the pre- metastatic niche)会释放出一些肿瘤相关的可溶性因子,激活一些骨髓来源的细胞(bone marrow- derived cells,BMDCs),这些细胞先于肿瘤细胞而到达靶器官,在那里营造一个适宜肿瘤细胞生存的微环境来迎接肿瘤细胞的到来[2]。Erler等[3]研究认为,原发乳腺肿瘤释放的、缺氧诱导的赖氨酸氧化酶(lysyl oxidase,LOX)可能是乳腺癌肺转移中关键的可溶性因子。结肠癌释放的环氧合酶2(cyclooxygenase- 2,COX- 2)在结肠癌定向肝预转移中可以招募肿瘤相关的巨噬细胞进入预转移位点,形成预转移小生境[4]。
胰腺癌是常见的消化道肿瘤,患者死亡的主要原因是胰腺癌引起的转移性疾病,最常见的转移部位是肝脏[5],但是,关于在肝转移过程中胰腺癌通过分泌何种可溶性因子诱导BMDCs至预转移小生境的研究甚少。我们在前期的研究中证明了组织蛋白酶D前体(组织蛋白酶D precursor,pCath- D)组织蛋白酶D(cathepsin D)是人胰腺癌分泌的促进定向肝转移的可溶性因子[6]。本单位实验观察了胰腺癌分泌的组织蛋白酶D对于CD11b+髓系来源细胞生物学行为的影响,并初步探讨其作用机制。
1 材料和方法
1.1 材料
胰腺癌细胞株L3.6pl、L3.6pl- s以及Colo357由本单位实验室保存。L3.6pl- s细胞是由组织蛋白酶D特异性sh- RNA重组慢病毒感染L3.6pl细胞后,组织蛋白酶D表达明显下降的细胞株。Transwell小室(8 μm)购自美国Corning公司,基质蛋白胶购自美国BD公司,超滤离心管(截留相对分子质量10 000)购自德国Millipore公司。抗鼠组织蛋白酶D抗体、FITC- anti- CD11b购自美国Biolegend公司。
1.2 方法
1.2.1 细胞培养、条件培养基的收集(conditioned media,CM)及细胞分泌蛋白质的提取 L3.6pl、L3.6pl- s以及Colo357在含有10%胎牛血清的RPMI 1640培养基中培养。当细胞融合至80%~90%时弃去培养中基,用PBS轻柔冲洗4~5次后加入无血清、无酚红的RPMI 1640培养基置于培养箱中培养24 h后收集。细胞分泌蛋白质的提取采取之前[6]的方法。
1.2.2 裸鼠胰腺癌原位瘤建立 具体实验方法见文献[7]。
1.2.3 流式细胞术检测 种植原位瘤后第3、7天收集肝脏和骨髓的全血细胞,用红细胞裂解液裂解红细胞,离心获得细胞,按照1×106个·μg-1的浓度加入FITC- anti- CD11b避光冰上孵育30 min。PBS洗涤细胞2次,重悬于500 ml PBS中,上机检测。
1.2.4 组织蛋白酶D表达的测定 蛋白质印迹法检测胰腺癌细胞系L3.6pl、L3.6pl- s以及Colo357细胞培养上清中组织蛋白酶D的表达。取3组细胞浓缩的分泌蛋白样品,进行聚丙烯酰胺(SDS- PAGE)凝胶电泳,将蛋白质电转移至聚偏二氟乙烯膜(PVDF膜)并将膜封闭(封闭液为含5%脱脂奶粉的TBST),封闭结束后,加入适量的一抗组织蛋白酶D抗体(一抗用封闭液1∶1 000稀释),4 ℃过夜。将膜与辣根过氧化物(HRP)结合的二抗(二抗用封闭液1∶3 000稀释),室温下摇荡孵育1.5 h,然后用TBST充分洗膜,漂洗3次,每次5~10 min。将配置好的显影液加到PVDF膜上,避光室温放置1~2 min,稍沥干显影液,将膜置于保鲜膜上并将膜包好(尽量避免气泡)。GAPDH作内参。最后用Image J软件分析其蛋白相对表达量。
1.2.5 CD11b+髓系来源细胞的分离培养 取3只健康的4~6周龄清洁级BALB/C小鼠,常规获得骨髓的全血细胞后裂解红细胞,离心获得骨髓细胞, PBS离心洗涤细胞2次(800 r·min-1,5 min)。弃上清,以含有青链双抗的少量PBS重悬,并与适量的荧光标记的FITC- anti- CD11b抗体结合。避光冰上孵育30 min后,用流式细胞仪分选,以含15%胎牛血清的RPMI 1640接种至25 cm2的塑料培养瓶中,加入GM- CSF 50 ng·ml-1,置于37 ℃、5%CO2培养箱中培养。
1.2.6 MTT比色法检测细胞增殖水平 将CD11b+髓系来源细胞分别用含有L3.6pl- CM、Colo357- CM、L3.6pl- CM+抗组织蛋白酶 D、鼠组织蛋白酶D(10 ng·ml-1)、L3.6pl- s- CM的15%胎牛血清RPMI 1640重悬,对照组以单独含有15%胎牛血清RPMI 1640重悬。调整细胞密度为10 000个·孔-1接种于96孔板中,每组设5个复孔。分别培养48 h后,每孔加入20 μl的MTT后继续置入培养箱4 h,去上清后加入150 μl二甲基亚砜(DMSO)低速振荡10 min使用酶标仪检测,以570 nm波长处的光吸收值代表细胞活力,每组实验重复3次。
1.2.7 Transwell小室实验 (1) CD11b+髓系来源细胞迁徙实验:每个小室上室面(直径8 μm)加入50 μl含10 ng·ml-1BSA的无血清RPMI 1640,37 ℃放置30 min,然后加入无血清CD11b+髓系来源细胞悬液100 μl(5×105个·ml-1),将小室的上室面置入含有不同肿瘤上清的下室中,在37 ℃、5%CO2条件下孵育24 h。棉球擦尽上室表面细胞后用乙醇固定和0.2%结晶紫染色10 min,显微镜下观察穿入膜内细胞。(2) CD11b+的髓系来源细胞侵袭实验:预先将基质蛋白胶在4 ℃过夜,变成液态后加入无血清培养液配成基质蛋白胶混合液(基质蛋白胶∶培养基=1∶8)。在加入细胞悬液前,中间微孔膜表铺被200 μl 基质蛋白胶混合液,置于细胞培养箱4 h后吸尽成胶表面的液体,其余操作同细胞迁徙实验。
1.2.8 基质金属蛋白酶(MMP- 2)蛋白表达的测定 蛋白质印迹法检测分别经过L3.6pl- CM、Colo357- CM、L3.6pl- CM+抗组织蛋白酶D、鼠组织蛋白酶D(10 ng·ml-1)、L3.6pl- s- CM处理的CD11b+髓系来源细胞中MMP- 2的表达。按照常规方法,分组加入蛋白裂解液提取总蛋白,制备样品进行SDS- PAGE凝胶电泳,余具体方法同前。一抗MMP- 2抗体用封闭液稀释(1∶400)。
1.3 统计学处理
2 结 果
2.1 流式细胞术检测CD11b+髓系来源细胞比例
L3.6pl荷瘤鼠第3天、第7天肝脏中CD11b+细胞比例(33.44%±0.029%、38.15%±0.017%)明显高于Colo357荷瘤鼠肝脏中的细胞比例(5.19%±0.009 %,6.76%±0.013%),差异均有统计学意义(均P<0.05)。
2.2 蛋白质印迹法检测胰腺癌细胞培养上清中组织蛋白酶D的表达
蛋白质印迹法检测结果显示,L3.6pl- CM中组织蛋白酶D的表达明显高于L3.6pl- s- CM和 Colo357- CM中的表达,见图1。

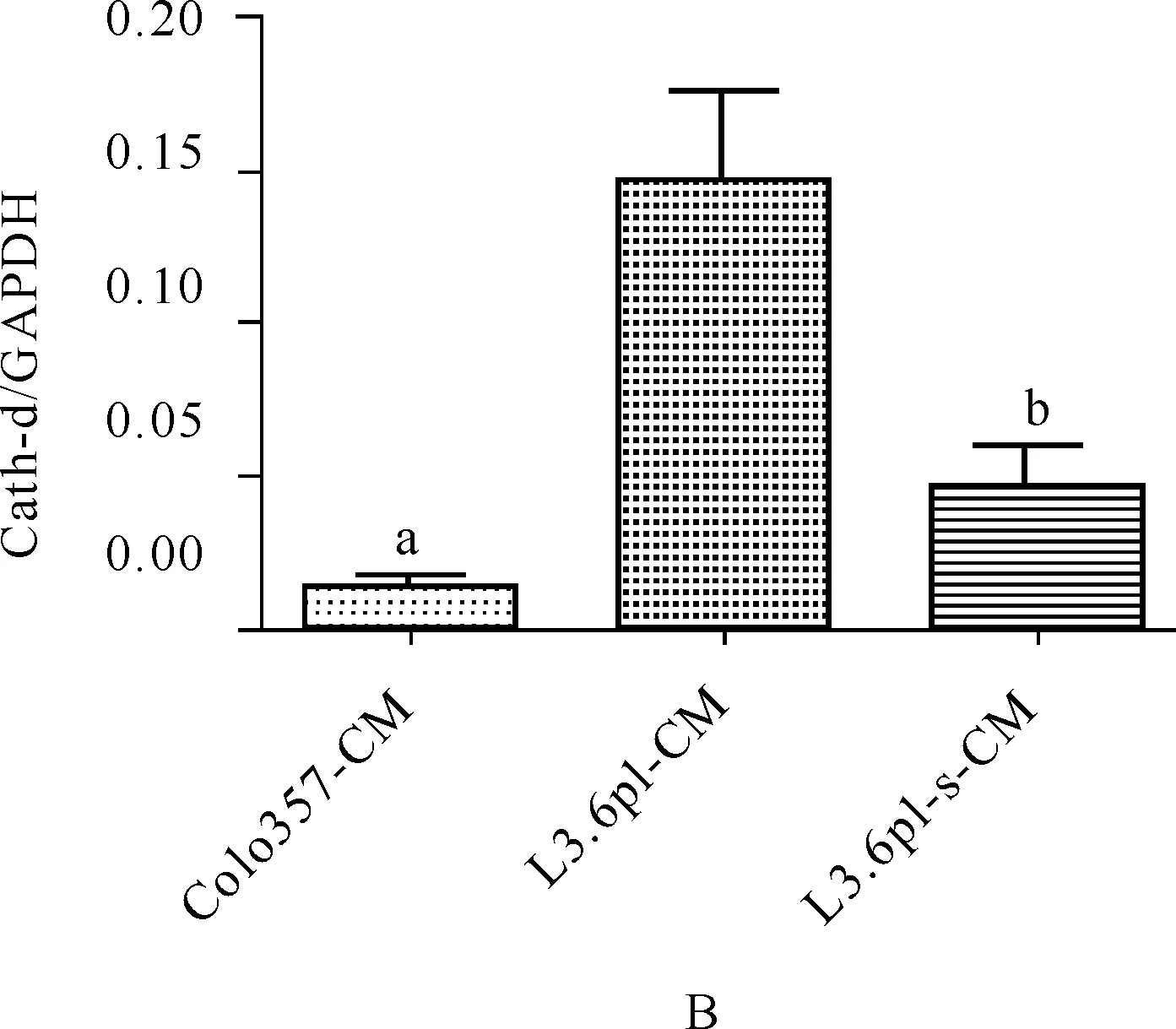
与L3.6pl- CM和L3.6pl- s- CM比较,aP<0.05;与L3.6pl- s- CM比较,bP<0.05
图1肿瘤细胞上清液组织蛋白酶D的表达A.肿瘤细胞上清液组织蛋白酶D电泳图;B.肿瘤细胞上清液组织蛋白酶D半定量统计图
Fig1TheexpressionofCathepsinDoftumorconditionedmedia
2.3 MTT检测组织蛋白酶D对CD11b+髓系来源细胞增殖的影响
CathepsinD促进CD11b+髓系细胞的增殖,含有重组鼠组织蛋白酶D(0.267±0.034)对细胞的增殖相比于在含有L3.6pl- s- CM组(0.158±0.012)、Colo357- CM组(0.153±0.005)明显增加(P<0.05),而添加了阻断剂之后,则增殖明显受到抑制(0.166±0.008)(P<0.05)。
2.4 Transwell小室实验
Anti- 组织蛋白酶D抑制CD11b+髓系细胞的迁徙和侵袭。在迁徙实验中,培养24 h后,含有重组鼠 组织蛋白酶D组迁徙到膜内的细胞数量(36.666±4.932)明显高于L3.6pl- s- CM组(19.333±1.527)及Colo357- CM组(13.778±3.065)(P<0.05),而在CathepsinD被阻断后迁徙细胞数量明显减少(26.333±3.511,P<0.05)。
在侵袭实验中,培养24 h之后,含有重组鼠组织蛋白酶D组细胞侵袭进入微孔膜的数量(19.333±4.725)明显多于含有L3.6pl- s- CM组(9.778±3.055)和Colo357- CM组(4.333±1.154)(P<0.05),而在组织蛋白酶D被阻断后细胞侵袭数量(14.66±2.561)明显减少(P<0.05)。
2.5 CD11b+髓系细胞中MMP- 2蛋白变化的表达
见图2。

图2CD11b+髓系细胞MMP- 2蛋白表达
Fig2TheexpressionofMMP- 2proteininCD11bpositivebonemarrowderivedcells
3 讨 论
目前的研究表明,表达血管内皮生长因子受体- 1、CD11、CD34的造血祖细胞以及CD11b+的髓系来源细胞在肿瘤细胞到达前就预先到在转移位点形成了预转移小生境[2]。在肿瘤目标性转移器官中,CD11b+细胞被大量招募[8]。CD11b+细胞可以通过多种方式、途径促进肿瘤的增长和转移。研究者认为,CD11b+髓系来源细胞的招募在预转移小生境的形成中起到了主要的作用[9]。在本实验中观察到预转移期内L3.6pl原位移植瘤模型骨髓和肝脏中CD11b+髓系来源细胞的比例明显增加,且明显高于Colo357原位移植瘤模型骨髓和肝脏中此细胞的比例。这个结果表明,在胰腺癌肝转移中大量的CD11b+髓系来源细胞被动员并招募到预转移的器官,构成预转移小生境。
在体内预转移小生境的形成过程中,肿瘤分泌特殊的可溶性因子发挥着重要的作用。在先期研究中发现,p 组织蛋白酶D / 组织蛋白酶D是人胰腺癌分泌的促进定向肝转移的可溶性因子。本实验也证明了人胰腺癌细胞株L3.6pl所分泌的组织蛋白酶D明显高于人胰腺癌细胞株Colo357所分泌的组织蛋白酶D(见图1)。组织蛋白酶D是一种广泛存在于各种组织细胞中的一种溶酶体蛋白酶,其在许多肿瘤中表达增高,它不但可以促进肿瘤细胞的增生,而且可以促进肿瘤的浸润和转移[10]。本研究探讨胰腺癌分泌的可溶性因子组织蛋白酶D是否对CD11b+髓系来源细胞的体外生物学行为有影响。用流式细胞仪分选出小鼠骨髓中的CD11b+细胞用于体外培养并进行下一步的研究。在MTT增殖实验中看到,组织蛋白酶D对CD11b+髓系细胞的增殖具有很明显的促进作用,阻断组织蛋白酶D后则促增殖的作用明显受到抑制。通过流式分析仪可以观察到,在裸鼠自身肝脏中含有着很少量的CD11b+的细胞,而荷瘤裸鼠肝脏中CD11b+的细胞明显增多,预转移小生境中的髓系细胞是由骨髓、外周血以及原发肿瘤中迁移而来的,而从后面的细胞增殖实验的结果我们发现,组织蛋白酶D对于CD11b+髓系来源细胞有一定的促增殖作用,我们猜想预转移小生境的髓系细胞的组成一部分是迁徙而来的,另一部分则是由迁徙来的骨髓细胞增殖而成的。这是我们后续关注的一个方面。骨髓细胞的迁徙是预转移小生境形成的一个关键性环节。本实验以Transwell小室为模型,观察组织蛋白酶D在CD11b+髓系来源细胞的迁徙实验中发挥的作用,发现组织蛋白酶D能够显著地提高CD11b+髓系来源细胞的迁徙能力,阻断它后迁徙的细胞数量明显下降,同样也发现L3.6pl- CM对迁徙的影响大于单纯含有组织蛋白酶D的影响。骨髓细胞是通过扩增、迁徙和侵袭一步步地定植到预转移器官。我们观察到组织蛋白酶D对CD11b+髓系来源细胞侵袭能力是有影响的,同样通过Transwell小室模型,我们观察到组织蛋白酶D对CD11b+髓系来源细胞侵袭力有一定的促进作用。Coussens等[11]认为,BMDCs的侵袭力的增加与MMPs激活相关。通过蛋白质印迹法观察到,组织蛋白酶D对于CD11b+髓系来源细胞MMP- 2的激活有重要作用。Erler等通过研究发现,LOX可以增强CD11b+髓系来源细胞MMP- 2的活性,从侧面证实MMP- 2在CD11b+髓系来源细胞的侵袭中发挥了一定的作用。组织蛋白酶D参与恶性肿瘤的浸润和转移,目前主要认为是其活性肽AP片段发挥着重要的作用。已有研究认为,肿瘤以及免疫细胞产生一些在CD11b+髓系来源细胞的募集及扩增中发挥着重要作用的因子,包括血管内皮生长因子、COX、粒细胞、巨噬细胞集落刺激因子(GM- CSF)、IL- 4和IL- 6。Deng等[12]认为,髓系细胞中S1PR1- STAT3信号途径在预转移小生境的形成中发挥着重要的作用。但是组织蛋白酶D与髓系细胞中STAT3和JAK直接激活的相关性研究未见报道,也不清楚AP片段是否与其有关,故组织蛋白酶D是如何动员并迁徙CD11b+髓系来源细胞的机制还未阐释清楚。
从上述实验结果中观察到,纯化的组织蛋白酶D能独立诱导CD11b+髓系来源细胞动员,但与L3.6pl- CM组的结果比较发现,其诱导CD11b+髓系来源细胞动员的能力低于L3.6pl- CM,可能的原因是L3.6pl- CM中蕴含有其他的可溶性因子,同样可以诱导CD11b+髓系来源细胞,或这些可溶性因子对组织蛋白酶D的诱导作用有协同效应,能促进组织蛋白酶D对CD11b+髓系来源细胞的动员。目前的研究中高转移性的胰腺癌细胞系L3.6pl- CM中有很多的可溶性因子,包括有血管内皮生长因子和COX,这在一定程度上解释了L3.6pl- CM动员并迁徙CD11b+髓系来源细胞的能力强于单纯的组织蛋白酶D的动员能力。
综上所述,我们发现,在胰腺癌肝转移模型中CD11b+髓系来源细胞大量招募到肝脏中并参与形成预转移小生境,体外实验中组织蛋白酶D可以促进CD11b+髓系来源细胞的增殖、迁徙,并且通过增强MMP- 2来促进它的侵袭。本实验仅仅是从体外实验说明了组织蛋白酶D能动员CD11b+髓系来源细胞,而缺乏在体内方面的研究,我们将在后续的实验中对此进一步完善明确。
[1] CAIRNS R A,KHOKHA R,HILL R P.Molecular mechanisms of tumor invasion and metastasis:an integrated view[J].Curr Mol Med,2003,3(7):659- 671.
[2] KAPLAN R N,RIBA R D,ZACHAROULIS S et al.VEGFR1- positive haematopoietic bone marrow progenitors initiate the pre- metastatic niche[J].Nature,2005,12:820- 827.
[3] ERLER J T,BENNEWITH K L,COX T R,et al.Hypoxia- induced Lysyl Oxidase is a critical mediator of bone marrow cell recruitment to form the premetastatic niche[J].Cancer Cell,2009,15:35- 44.
[4] YAMAMOTO M,KIKUCHI H,OHTA M,et al.TSU68 prevents liver metastasis of colon cancer xenografts by modulating the premetastatic niche[J].Cancer Res,2008;68(23):9754- 9762.
[5] YACHIDA S,IACOBUZIO- DONAHUE C A.The pathology and genetics of metastatic pancreatic cancer[J].Arch Pathol Lab Med,2009,133(3):413- 422.
[6] 胡方方,周家华.胰腺癌肝转移相关分泌蛋白质的筛选[J].东南大学学报:医学版,2010,29(4):367- 372.
[7] 余泽前,周家华.红色荧光蛋白标记的胰腺癌裸鼠原位移植瘤转移模型的建立[J].中华外科杂志,2009,47(14):1092- 1095.
[8] HIRATSUKA S,WATANABE A,ABURATANI H,et al.Tumour- mediated upregulation of chemoattractants and recruitment of myeloid cells predetermines lung metastasis[J].Nat Cell Biol,2006,8(12):1369- 1375.
[9] GIL- BERNABÉ A M,FERJANCIC S,TLALKA M ,et al.Recruitment of monocytes/macrophages by tissue factor- mediated coagulation is essential for metastatic cell survival and premetastatic niche establishment in mice[J].Blood,2012,119(13):3164- 3175.
[10] VASHISHTA A,OHRI S S,PROCTOR M,et al.Ribozyme- targeting procathepsin D and its effect on invasion and growth of breast cancer cells:an implication in breast cancer therapy[J].Int J Oncol,2007,30(5):1223- 1230.
[11] COUSSENS L M,WERB Z.Inflammation and cancer[J].Nature,2002,420(6917):860- 867.
[12] DENG J,LIU Y,LEE H,et al.S1PR1- STAT3 signaling is crucial for myeloid cell colonization at future metastatic sites[J].Cancer Cell,2012,21(5):642- 654.
