小鼠骨髓来源内皮祖细胞的分离、培养及鉴定
2014-09-12胡若愚承燕李好张雷景华吴海卫
胡若愚,承燕,李好,张雷,景华,吴海卫
(南京大学临床医学院 南京军区南京总医院 心胸外科,江苏 南京 210002)
血液循环是机体生命维持的重要保证。血管内皮作为血液与周围组织的分界,在血液循环的稳定性的维持中起着非常重要的作用[1]。自1997年Asahara首次报道经由外周血获得内皮祖细胞(endothelial progenitor cell,EPC)以来,EPC因其具有的强大增殖潜能及向血管内皮细胞分化的特性,越来越引起广大医学科研工作者的重视[2]。研究表明,EPC作为血管内皮细胞的前体细胞,不仅有着强大的增殖及分化能力,更具备向缺血或受损组织迁移、归巢的特性,在血管新生及内皮修复中起着独特而关键的作用。实验研究发现,EPC不仅是冠心病发病预测的独立危险因素,更在心肌梗死后的血管新生中发挥重要作用[3- 4];利用EPC移植治疗冠心病及心肌梗死也取得了良好的效果[5];利用EPC治疗肢体缺血的试验研究显示出EPC具有强大的促血管新生能力,能够明显地促进闭塞血管周围组织内的血管新生[6- 7]。与此同时,由于生理状态下循环血液中的EPC含量极低,仅占外周血中有核细胞数量的0.01%~0.02%[8],而在冠心病、吸烟人群、糖尿病、老龄人等特定人群中,循环血中的EPC数量会进一步降低[9- 11]。因此,当心肌梗死等突发疾病发生时,患者自体外周血中的EPC数量往往不能在第一时间满足血管修复及再生的需要。因此,通过体外培养及扩增的方法预先获得充足的EPC,并在疾病发生后迅速予以患者输入外源性EPC应当是EPC治疗的重要方法乃至必由之路。
EPC的获取来源及培养方法各家报道不一,而自骨髓提取骨髓单核细胞接种进行细胞培养是目前国外研究所广泛采用的主流培养方法。该方法稳定、高效、经济,且能有效避免细胞获取过程中的细胞污染。特别是在小鼠等外周血量极少的小动物研究中,更具有其独特的可操作性。本研究采用BALB/c小鼠骨髓获得单核细胞,分离培养并鉴定骨髓来源的小鼠EPC,为今后EPC的细胞学治疗研究奠定实验基础。
1 材料与方法
1.1 实验动物、试剂及主要仪器
BALB/c小鼠(雄性,5~7周龄,体重21~25 g·只-1,由南京军区南京总医院比较医学科提供);EGM- 2 SingleQuots培养基(美国Lonza公司);人纤维连接蛋白 (美国R&D公司);小鼠淋巴细胞分离液 (美国Sigma- Aldrich公司);大鼠抗小鼠CD34单克隆抗体、兔抗小鼠VEGFR2多克隆抗体(均购自英国Abcam公司);羊抗大鼠IgG- FITC抗体、羊抗兔IgG- PE抗体(均购自美国SantaCruz公司);DiI- Ac- LDL(美国Invitrogen公司);FITC- UEA- 1(美国Sigma- Aldrich公司);抗小鼠 CD34- FITC流式抗体、抗小鼠VEGFR2- PE流式抗体、大鼠IgG2aK- PE 同型对照流式抗体、大鼠IgG2aK- FITC同型对照流式抗体 (均购自美国eBioscience公司)。超净工作台(苏净集团),细胞培养箱(美国Thermo公司),水平离心机(上海医用分析仪器厂),流式细胞仪(美国BD公司),荧光倒置显微镜(日本Olympus IX71型)。
1.2 小鼠骨髓源性EPC的分离与培养
每次取雄性BALB/c小鼠6只,麻醉后推头法迅速处死并置入75%酒精中浸泡30 min。于超净工作台上将小鼠双下肢股骨、胫骨分离并取出,浸泡于含胎牛血清的PBS溶液中保存。以1 ml注射器及PBS冲洗小鼠胫、股骨骨髓腔,冲洗获得的骨髓细胞悬液收集于15 ml离心管中。每次冲洗PBS液量为6 ml。将4 ml小鼠淋巴细胞分离液加入离心管底部,并将获得的骨髓细胞悬液沿离心管壁缓慢加入离心管中。将该离心管于水平离心机中离心,以2 500 r·min-1离心30 min。离心后可观察到离心管内液体分为3层:底层为红细胞层;中层可观察到约2~3 mm厚的白膜层,此即为单核细胞层;上层为血清层。以无菌吸管将白膜层吸出,以无菌PBS液洗涤所获细胞2次,并以1 ml EGM- 2 SingleQuots培养液定容、混匀,制成母液。细胞计数板计数后,以5×106孔-1细胞量将细胞接种于人纤维连接蛋白包被的6孔培养板中,每孔内培养液为2 ml。将细胞置于37 ℃、5%CO2细胞培养箱中培养。细胞接种后第4天首次更换细胞培养液,弃去未贴壁细胞,将贴壁细胞继续培养。此后每2 d更换培养液1次。细胞培养3周,每日观察细胞生长状态,并拍照留存。
1.3 小鼠EPC的鉴定
1.3.1 细胞表面抗原免疫荧光法鉴定 选用培养至第21天的EPC行细胞表面抗原免疫荧光法鉴定,方法如下:(1) 细胞接种前于细胞培养板各孔内投入1 cm×1 cm无菌载玻片1枚,并行人纤维连接蛋白包被。细胞接种时,将细胞悬液滴加于载玻片上,并轻轻摇匀,使细胞于孔内均匀分布。细胞培养方法同前。(2) 细胞培养至21 d后取出载玻片,并以用4%多聚甲醛固定20 min,PBS漂洗3次,山羊封闭血清作用30 min,分别加入大鼠抗小鼠CD34单克隆抗体(1∶50)及兔抗小鼠VEGFR2多克隆抗体(1∶100),并于4 ℃孵育过夜。次日,以PBS漂洗3次后,加入羊抗大鼠IgG- FITC抗体(1∶200)及羊抗兔IgG- PE抗体(1∶500),常温下孵育1 h。(3) PBS漂洗2遍后,以10%缓冲甘油封片。于荧光倒置显微镜下观察细胞CD34及VEGFR2表达情况。
1.3.2 细胞表面抗原流式细胞仪检测 选择培养至第21天的EPC行流式细胞仪检测,具体方法如下:(1) 吸去细胞培养液,并以PBS洗涤细胞2遍,以充分去除培养液及死亡的悬浮细胞。(2) 选用不含EDTA的0.25%胰酶消化细胞后收集并用血清中和。(3) 离心并以PBS洗涤细胞2次,细胞重悬后计数并收集5×105细胞待检,加入抗小鼠CD34- FITC、VEGFR2- PE流式抗体各10 μl。常温下避光孵育1 h。(4) 1 h后再次离心,弃去上清,并以500 μl PBS重悬细胞后上机检测。流式细胞检测定标采用同型对照抗体标记细胞,方法同上。
1.3.3 细胞功能检测 选用培养第21天的EPC行细胞功能检测,具体方法如下:(1) 细胞爬片及培养方法同前。(2) 培养21 d后取出载玻片,将1 ml含10 μg·ml-1DiI- ac- LDL 的EGM- 2 SingleQuots培养液加入培养孔中,并于37 ℃细胞培养箱内孵育 2 h。(3) 2 h后取出培养板,并以PBS洗涤载玻片2次,4%多聚甲醛固定30 min。再次以PBS洗涤载玻片2次。并加入FITC标记的荆豆凝集素2 ml,FITC- UEA- 1浓度为10 μg·ml-1,常温下孵育1 h。(4) 1 h后取出载玻片, PBS洗涤2遍后10%缓冲甘油封片。(5) 荧光倒置显微镜下观察细胞吞噬DiI- ac- LDL及结合FITC- UEA- 1情况并拍摄照片。
2 结 果
2.1 细胞形态
骨髓单核细胞接种于细胞培养板上,起初为密集的小圆形细胞(图1A)。48 h可观察到细胞开始变大。接种第4天行首次更换培养液后,将培养板内绝大多数未贴壁细胞去除。贴壁细胞开始逐渐出现加速生长趋势,细胞向梭型细胞转变,细胞体积进一步增大。细胞接种后第7天左右,培养板内可观察到多个细胞集落出现。细胞集落形态为:中间小圆形细胞聚集成团,周围长梭型细胞呈放射状排列(图1B)。此后,细胞集落生长速度进一步增快,集落数量也逐渐增多,集落周边细胞也逐渐由长梭型向短梭形转变。在此期间,可观察到部分细胞排列出现极性,呈现管状(图1C)、网状样(图1D)生长,提示EPC具有成血管特性。培养至2周后,细胞集落逐渐消失,细胞形态趋于均一,呈现“铺路石”样生长状态(图1E)。
2.2 免疫荧光检测
免疫荧光检测结果显示,培养至3周后细胞绝大多数能被CD34及VEGFR2同时标记。荧光显微镜下可见CD34标记阳性细胞呈绿色荧光,VEGFR2标记阳性细胞呈红色荧光。通过于同一视野下分别拍摄荧光照片并以Image Pro Plus软件合成双色荧光,可见共表达CD34及VEGFR2细胞呈现橙色,提示该细胞即为EPC(图2)。
2.3 流式细胞仪检测
本研究采用流式细胞仪计量培养细胞中共表达CD34及VEGFR2细胞比例。根据流式细胞仪检测结果,本研究所培养至3周后的细胞中,CD34及VEGFR2双阳性细胞比例均占培养细胞总量的85%以上,提示检测细胞绝大多数为EPC (图3)。
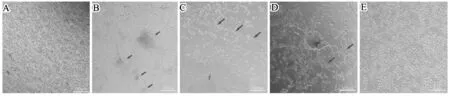
A.骨髓单核细胞接种于人纤维连接蛋白包被的培养板中;B.细胞培养第7天出现细胞集落(箭头所指);C.培养期间,部分细胞呈现管状生长(箭头所指);D. 细胞呈网状样生长(箭头所指为网状样生长的EPC,图中心箭头所指为EPC细胞集落);E.培养至2周后,细胞形态呈现“铺路石”样生长状态
图1细胞形态
A. Bone marrow mononuclear cells were seeded in the human fibronectin- coated flasks; B. Colony forming unit appeared since the 7thday of culture(arrow); C. During the cell culture, EPC were found arranging in a tube- like(arrow); D. EPC were net- like(arrow indicated the EPC network, figure center arrow indicated the EPC cell forming unit); E. EPC gradually changed to a cobblestone- like morphology after 2 weeks of culture.
Fig1Cellmorphology
2.4 细胞功能检测
EPC具备吞噬乙酰化低密度脂蛋白能力及结合荆豆凝集素能力。本研究结果显示,所培养的细胞绝大多数具备吞噬DiI- Ac- LDL及结合FITC- UEA- 1能力。荧光显微镜下可见,吞噬DiI- Ac- LDL的EPC胞浆内呈现红色荧光,结合FITC- UEA- 1的EPC细胞膜呈现绿色荧光。通过于同一视野下分别拍摄荧光照片并以Image Pro Plus软件合成荧光染色照片,可见双阳性细胞呈现橙色荧光,提示该细胞即为EPC(图4)。
3 讨 论
EPC是一类可以分化为成熟内皮细胞的前体细胞,由中胚层的成血管母细胞分化而来。EPC不仅参与人体胚胎血管形成,同时也参与出生后血管形成、再内皮化和机体血管损伤后的修复过程[12- 13]。随着研究的不断进展,科研工作者相继从骨髓、脐血、胚胎肝脏及外周血中分离并提取出EPC。其中,骨髓中EPC含量最高,为外周血中的15倍[14- 15]。因此,自骨髓中提取EPC是一种更加简便、高效的细胞提取方法。特别是对诸如小鼠等外周血量极少的小动物,从骨髓细胞中分离获取单核细胞并诱导分化为EPC的细胞培养方法有着其他方法不可比拟的优势。在本次实验中,我们选择了自骨髓单核细胞诱导培养EPC的方法。通过实验研究我们发现,该方法简便、高效、易行。实验中我们发现:自每只小鼠双下肢股骨、腓骨骨髓中可获得的单核细胞数量大约为1×107个左右。完全可以满足细胞接种及培养需要。我们还发现:选择5~7周龄的小鼠进行骨髓细胞提取,可以获得更多的骨髓单核细胞,过老或过小的小鼠,骨髓单核细胞提取效率则相对较低。有研究表明:人纤维连接蛋白能够促进内皮祖细胞的黏附、生长及增殖。因此,在我们的实验中也采用了预先使用人纤维连接蛋白进行细胞培养板包被的方法。通过比较我们发现:通过使用人纤维连接蛋白进行细胞培养板包被能有效地提高细胞的黏附效率,并能有力地促进细胞增殖及细胞集落的形成[16]。
共表达CD34及VEGFR2细胞呈现橙色,提示该细胞即为EPC
图2CD34、VEGFR2双阳性免疫荧光染色
Cells co- expressing CD34 and VEGFR2 exhibited orange fluoresce-nce and were considered as EPC
Fig2ImmunofluorescencestainingofCD34andVEGFR2
细胞培养至3周后,CD34及VEGFR2双阳性细胞比例均占培养细胞总量的85%以上
图3CD34、VEGFR2流式细胞仪检测
Over 85% of sample cells cultured over 3 weeks co- expressed CD34 and VEGFR2
Fig3CD34andVEGFR2flowcytometerdetermination

DiI、FITC双阳性细胞呈现橙色荧光,提示该细胞即为EPC
图4EPC吞噬DiI-Ac-LDL及结合FITC-UEA-lectin检测
Cells double positive for DiI and FITC showed orange fluorescence were considered as EPC
Fig4DeterminationofDiI-Ac-LDLuptakeandFITC-UEA-LectinbindingofculturedEPC
关于EPC的培养方法各类文献报道不一,其主要区别在于单核细胞接种后,培养未贴壁细胞还是贴壁细胞。Prater等回顾分析了2种细胞培养方法,结果发现,两种方法均可培养获得EPC。但其区别在于将早期未贴壁细胞留取,进行后续培养所获得的细胞与Asahara所报道的相似,为中央圆形细胞聚集,周围为梭型细胞,并呈放射状分布,该类细胞目前又被称为colony forming unit- EC(CFU- EC)或早期内皮祖细胞(early- EPC);而弃去早期未贴壁细胞,而将贴壁细胞留取培养,所获得的细胞呈现“铺路石样”外观,此类细胞目前又被称为endothelial colony forming cell(ECFC)或晚期内皮祖细胞(late- EPC)[17]。而根据Hur等进行的针对这两类细胞的研究表明,早期EPC出现在细胞培养的第2~3周,第4周左右消失,细胞形态为梭形;晚期EPC在细胞第4~8周左右出现,并可生长至第12周左右,细胞集落呈现“铺路石”样形态[18]。研究还表明:晚期EPC在细胞增殖能力、成血管能力及对受损内皮细胞的修复能力上,均较早期EPC有显著提高。而关于两类EPC亚型之间的关系及来源,目前各种报道观点不一,甚至有观点认为两类EPC是由两种不同细胞分化而来[19]。在本研究中,我们发现所培养的细胞先后出现了早期及晚期EPC的细胞形态,该现象提示我们:晚期EPC很可能是由早期EPC演化而来,而并不是一类单独的细胞来源。
EPC的鉴定目前仍然缺乏获得广泛公认的“金标准”。根据目前已有文献报道和研究所普遍采用的鉴定方法,认为EPC的鉴定应包括细胞形态学鉴定、细胞表面抗原鉴定及细胞功能测定。EPC的早期及晚期的形态学特征差异较大。值得注意的是,我们在培养过程中,多次发现细胞生长出现极性排列现象,特别是出现细胞首尾相接并呈现管状生长,以及由一个大的细胞集落生发出网状排列细胞的生长现象。这些现象在其他细胞培养中尚属少见,更加强烈地显示出EPC作为血管内皮细胞的成血管特性。同时,我们还发现:EPC的增殖能力极强,特别是生长至2周左右之后,其增殖加速现象格外明显,提示EPC具有迟发型高增殖能力。有报道表明,EPC的增殖能力是内皮细胞增殖能力的50倍左右[20]。关于EPC的细胞表面标志的鉴定标准,目前各家观点不一。根据Asahara等的首次报道,认为EPC应同时表达CD34、CD133及VEGFR2。早期EPC还表达白细胞通用抗原CD45。但随着研究的不断深入,目前观点认为,EPC的细胞表面标志是一个动态变化过程,随着EPC向内皮细胞逐渐分化,干细胞标志物CD133及白细胞标志物CD45表达会逐渐降低以致丢失。由于EPC是由造血干细胞分化而来,目前观点认为,EPC应至少表达一个造血干细胞标记物CD34及反应内皮细胞特征的细胞标记物VEGFR2或CD31[16]。而Schmidt- lucke等提出的鉴定外周血中EPC的流式细胞鉴定方法也将CD45弱阳性、CD34、VEGFR2双阳性作为定义EPC的检测标准[8]。在本次研究中,我们也选用CD34与VEGFR2双阳性表达鉴定培养获得的EPC。根据免疫荧光及流式细胞仪检测结果,超过85%的细胞共表达上述两抗原。提示所培养细胞确为EPC。关于EPC功能的检测,目前主流的检测方法为测定EPC吞噬乙酰化低密度脂蛋白及结合荆豆凝集素能力。该检测方法曾被广泛采用,甚至有研究仅使用该方法进行EPC鉴定[21]。随着对EPC研究的发展及认识的深入,科研工作者发现,该功能并非EPC所特有,其他细胞如内皮细胞也具有此类功能。因此,该检测方法只能作为EPC鉴定的辅助手段,而完全依赖该方法进行EPC鉴定显然不够严谨。
综上所述,通过本项研究,我们确立了一套自通过分离小鼠骨髓单核细胞进行EPC诱导培养的培养方法。并通过细胞形态学观察、细胞表面抗原测定及细胞功能检测3方面确定我们所培养的细胞为EPC,为今后利用EPC进行相关科学研究奠定了基础。
[1] 张铁须,周建中.内皮祖细胞与高血压病[J].现代医学,2008,36(2):141- 144.
[2] ASAHARA T,MUROHARA T,SULLIVAN A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964- 967.
[3] JI A L,TAKAHASHI M,YOSHIOKA T,et al.Therapeutic potential of endothelial progenitor cells for cardiovascular diseases[J].Curr Vasc Pharmacol ,2006,4(1):59- 65.
[4] STELLOS K,BIGALKE B,LANGER H,et al.Expression of stromal- cell- derived factor- 1 on circulating platelets is increased in patients with acute coronary syndrome and correlates with the number of CD34+progenitor cells[J].Eur Heart J,2009,30(5):584- 593.
[5] HU C H,WU G F,WANG X Q,et al.Transplanted human umbilical cord blood mononuclear cells improve left ventricular function through angiogenesis in myocardial infarction[J].Chinese Med J,2006,119(18):1499- 1506.
[6] DEVANESAN A J,LAUGHLAN K A,GIRN H R,et al.Endothelial progenitor cells as a therapeutic option in peripheral arterial disease[J].Eur J Vas Endovasc,2009,38(4):475- 481.
[7] IWAGURO H,YAMAGUCHI J,KALKA C,et al.Endothelial progenitor cell vascular endothelial growth factor gene transfer for vascular regeneration[J].Circulation,2002,105(6):732- 738.
[8] SCHMIDT- LUCKE C,FICHTLSCHERER S,Aicher A,et al.Quantification of circulating endothelial progenitor cells using the modified ISHAGE protocol[J].PloS One,2010,5(11):e13790.
[9] FADINI G P,SARTORE S,BAESSO I,et al.Endothelial progenitor cells and the diabetic paradox[J].Diabetes Care,2006,29(3):714- 716.
[10] di STEFANO R,BARSOTTI M C,FELICE F,et al.Smoking and endothelial progenitor cells:a revision of literature[J].Cur Pharm Design ,2010,16(23):2559- 2566.
[11] WERNER N,WASSMANN S,AHLERS P,et al.Endothelial progenitor cells correlate with endothelial function in patients with coronary artery disease[J].Basic Res Cardiol,2007,102(6):565- 571.
[12] BONELLO L,BASIRE A,SABATIER F,et al.Endothelial injury induced by coronary angioplasty triggers mobilization of endothelial progenitor cells in patients with stable coronary artery disease[J].J Thromb Haemost,2006,4(5):979- 981.
[13] YAMADA M,KUBO H,ISHIZAWA K,et al.Increased circulating endothelial progenitor cells in patients with bacterial pneumonia:evidence that bone marrow derived cells contribute to lung repair[J].Thorax,2005,60(5):410- 413.
[14] EGGERMANN J,KLICHE S,JARMY G,et al.Endothelial progenitor cell culture and differentiationinvitro:a methodological comparison using human umbilical cord blood[J].Cardiovasc Res,2003,58(2):478- 486.
[15] LIN Y,WEISDORF D J,SOLOVEY A,et al.Origins of circulating endothelial cells and endothelial outgrowth from blood[J].J Clin Invest,2000,105(1):71- 77.
[16] YODER M C,MEAD L E,PRATER D,et al.Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals[J].Blood,2007,109(5):1801- 1809.
[17] PRATER D N,CASE J,INGRAM D A,et al.Working hypothesis to redefine endothelial progenitor cells[J].Leukemia,2007,21(6):1141- 1149.
[18] HUR J,YOON C H,KIM H S,et al.Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis[J].Arterioscl Throm Vas,2004,24(2):288- 293.
[19] FADINI G P,BAESSO I,ALBIERO M,et al.Technical notes on endothelial progenitor cells:ways to escape from the knowledge plateau[J].Atherosclerosis,2008,197(2):496- 503.
[20] RAE P C,KELLY R D,EGGINTON S,et al.Angiogenic potential of endothelial progenitor cells and embryonic stem cells[J].Vascular Cell,2011,3:11.
[21] THOMAS R A,PIETRZAK D C,SCICCHITANO M S,et al.Detection and characterization of circulating endothelial progenitor cells in normal rat blood[J].J Pharmacol Toxicol.2009,60(3):263- 274.
