人胚胎肺成纤维细胞复制性衰老模型的建立
2014-09-12师迎旭郑国光
师迎旭 杜 华 郑国光
(中国医学科学院北京协和医学院血液学研究所,天津 300020)
体外细胞培养法常被用于细胞功能性的相关研究。衰老的起因是由于分子水平上的改变,检测其分子水平上的变化对于鉴定细胞是否衰老十分重要。检测细胞衰老的指标有β-半乳糖苷酶染色(SA-β-cal)〔1,2〕、端粒长度检测〔3,4〕、端粒DNA 3'突出端的长度检测〔5,6〕、α2巨球蛋白(α2M)〔7〕、p16INK4a〔8,9〕、p21WAF-1〔10,11〕表达水平等。还可以通过检测细胞周期来判定细胞的衰老,衰老细胞会停滞于G1期,但停滞于G1期的细胞并不一定会衰老也可能会进入静息期〔12〕。β-半乳糖苷酶随着细胞衰老表达逐渐增高,由此SA-β-cal作为一个最常用的、方便的细胞衰老生物学检测方法。端粒长度随细胞衰老而缩短,端粒长度的检测也是判定复制性衰老的一个重要指标。p21WAF-1在衰老细胞中高表达,而且p21WAF-1还参与细胞周期调控以及p53/ATM信号通路,检测p21WAF-1的表达可在细胞衰老与细胞周期调控以及信号通路之间建立联系,为进一步研究衰老的发生、发展提供实验依据。
1 材料与方法
1.1分离培养人胚肺成纤维(HEL)细胞 选用4月龄的未经药物处理过的女性胚胎,在无菌操作台内将肺脏组织取出,用磷酸盐缓冲液(PBS)将其冲洗干净。将组织切割成1 mm3左右的小块,用眼科镊均匀铺于事先准备好的培养皿内,加入少量含20%胎牛血清的DMEM培养液,以组织块不在培养液内漂浮为宜,然后把培养皿放置在37℃培养箱内。放置2~4 h后待组织小块贴附于培养皿,加入含20%胎牛血清的DMEM培养液,在37℃含5%的CO2的条件下培养,待1~2 d后细胞由组织中游出,摘掉组织块并用PBS清洗培养皿去除死细胞和组织残留物,加入培养液继续培养。待培养皿中的细胞长满后用胰蛋白酶将其消化下来,转入50 ml的塑料培养瓶中培养,此时的细胞我们称其为原代HEL细胞。
1.2HEL细胞的纯化 组织内的细胞都是混杂生长的,因人胚肺组织内主要由成纤维细胞构成,还含有个别其他类型的细胞,进行组织培养后可见游离出的细胞几乎全部都是成纤维细胞,利用成纤维细胞的增殖优势,可排挤其他细胞的生长,通过胰蛋白酶消化传代,靠自然的增殖潜力最后留下生长优势细胞——HEL细胞,达到细胞纯化的目的。
1.3HEL细胞培养传代 细胞生长融合达到约80%~90%,胰蛋白酶消化,按1∶2分瓶进行传代。每次传代时所铺细胞计为N0,当细胞再次生长融合达到约80%~90%时收获细胞并计数此时的细胞数记为NH,经公式(PD=3.32×logNH/N0)〔13〕计算每一次传代的PD。培养基为DMEM,添加10%的新生牛血清与1/1 000的青链霉素(20万U/ml)。在37℃,浓度为5%的CO2培养箱中进行培养。
1.4HEL细胞复制性衰老检测
1.4.1HEL细胞SA-β-Gcal半乳糖苷酶染色〔1,2〕选用培养不同培养代龄(PD)的HEL细胞,用胰蛋白酶消化细胞,细胞计数,铺24孔板,每孔约9×103个细胞,培养箱中培养48 h。然后固定细胞,加入染色液X-gal。培养箱中孵育过夜,阳性细胞被染成蓝色。显微镜观察,并进行照相。
1.4.2测定HEL细胞的端粒长度〔3,4〕①寡核苷酸探针(TTAGGG)标记,用T4 PNK标记探针,保存于-20 ℃备用。 ②提取HEL细胞的基因组DNA,培养HEL维细胞至PD为21、29、36、44、51、59,收集约106~108个细胞,离心弃上清,裂解细胞。加入蛋白酶K至终浓度为100 μg/ml,于50℃水浴中孵育3 h。进行酚氯仿抽提。加入异丙醇于-20℃沉淀过夜。离心弃上清。用75%乙醇洗沉淀,离心弃上清,室温干燥。加入TE溶解沉淀。测定基因组DNA的浓度。③用EcoR I 酶切不同PD的HEL基因组DNA各5 μg,于37℃酶切过夜。酶切后进行电泳。采用毛细管虹吸转移法将DNA片段转移到尼龙膜上。紫外交联固定,然后放入杂交管内,加入杂交液。37℃预杂交3 h,加入标记好的探针37℃杂交过夜。洗膜,放射显影。
1.5Western印迹检测HEL细胞衰老过程中的p21WAF-1蛋白表达量 ①收获并裂解HEL细胞:在细胞培养瓶内加入RIPA裂解液裂解细胞,将裂解物超声破碎。超声破碎后,冰浴30 min。4℃离心,收集上清。采用Bradford法检测蛋白浓度。②SDS-聚丙烯酰胺凝胶电泳、转膜与杂交:每一样品取等量的蛋白进行10%SDS-PAGE电泳。电泳结束后将SDS-PAGE切割成合适的大小,恒流,根据p21WAF-1蛋白分子量的大小转膜。转膜结束后封闭膜2 h。封闭结束后加入p21WAF-1一抗,室温作用2 h,4℃继续作用过夜,洗膜。再加入HRP二抗作用2 h,洗膜。加化学发光底物于膜上,检测目的蛋白的表达。
2 结 果
2.1HEL细胞复制性衰老细胞模型的建立 每传一代的PD值,累计算出最终PD为64。在培养过程中对细胞形态进行观察,后期培养的细胞形态发生了明显的变化,细胞轮廓变得不再鲜明,细胞变粗、变大、形态不规则,细胞质内黑色颗粒增多,细胞在培养后期生长缓慢,倍增时间延长,表明细胞分裂增生能力下降,细胞周期延长。相比之下,前期细胞轮廓鲜明,呈纤维样,细胞细长,伸展能力强,细胞质清晰透明,细胞生长旺盛。细胞形态上的变化显示HEL细胞发生了细胞衰老。
2.2HEL细胞复制性衰老细胞模型的分子水平验证
2.2.1不同PD的HEL细胞SA-β-Gal结果 可观察到随着HEL细胞PD的增加,细胞被蓝染的个数及程度明显增加。HEL细胞从PD29开始被蓝染,PD44之后细胞被蓝染程度加深,到PD51时所有细胞都被成染色蓝,表明细胞衰老。此外,通过SA-β-Gal染色可对不同PD的HEL细胞进行形态学观察,随着HEL细胞的PD增加,细胞形态明显变的粗大且不伸展,细胞轮廓模糊不清晰;相反早期的细胞轮廓清晰,细胞细长呈纤维样。在PD36时,HEL细胞开始变的粗大,但仍保持纤维样。PD44之后,细胞的外形发生明显的变化,不能继续维持纤维样的外形,细胞变得不伸展,每个细胞的轮廓模糊不清晰。形态学的比较证明细胞发生了衰老。见图1。
2.2.2HEL细胞衰老过程中端粒长度的变化 随着HEL细胞的PD增加,细胞内的短DNA的量也明显增加,表明衰老造成短基因组DNA的片段增加了,基因组DNA的不稳定性增加了。随着HEL细胞PD的增加和细胞的衰老,端粒长度不断变短。因单个染色体的端粒长度不相同,所以得到的条带为smear带。随着PD的增加短端粒的数量明显增加,表明随着HEL细胞的衰老其端粒不断缩短。见图2。

PD21、PD29、PD36、PD44、PD5分别代表第21、29、36、44、51代HEL细胞,下图同
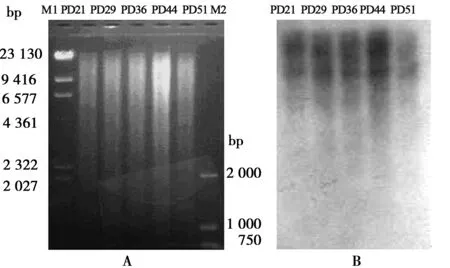
A:EcoR Ⅰ酶切基因组DNA后的琼脂糖电泳图,图中M1为Hind Ⅲ,M2为 DL-2000;B:Southern印迹检测端粒长度
2.2.3不同PD的HEL细胞p21WAF-1蛋白表达检测结果 p21WAF-1的蛋白表达水平与细胞衰老密切相关,它伴随着细胞的衰老表达量逐渐增加,在PD44之前p21WAF-1的蛋白表达水平呈梯度上升。PD44之后p21WAF-1的蛋白表达水平增加程度减弱,表达水平趋于一平台,说明HEL细胞在PD44时进入衰老状态。
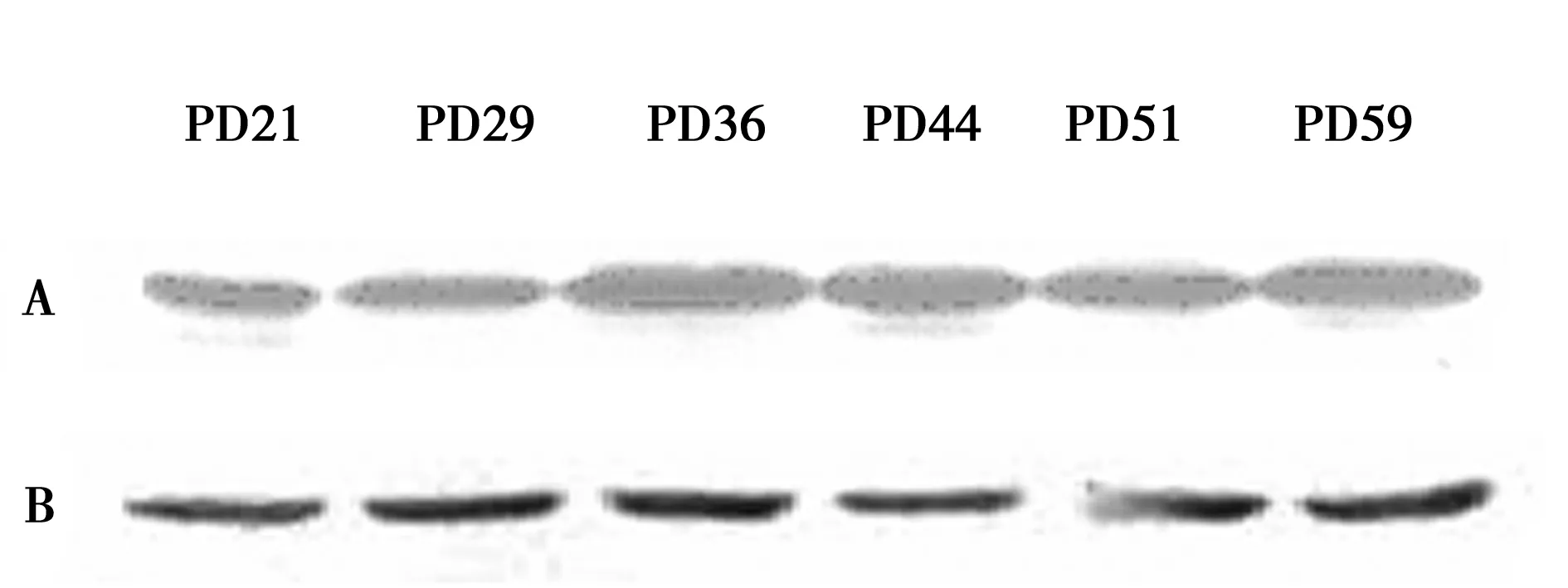
A:p21WAF-1,B:β-actin
3 讨 论
对生物衰老的研究,其中心问题之一就是体外衰老是否与生物体衰老有联系,用体外培养的细胞进行研究是否与生物的整体相关。也就是说,体外细胞衰老过程的研究是否有助于阐明体内衰老的基本过程。Hayflick证实人二倍体成纤维细胞在体外培养时,随体外培养所传代数的增加,细胞的增殖能力逐渐丧失。此后,发现衰老现象不是细胞培养的人为产物,除了最早发现的人二倍体成纤维细胞,许多人类其他细胞也存在衰老现象,如表皮角质细胞、T淋巴细胞等,这些都提示了体外复制衰老也是由遗传控制的。体外培养细胞衰老与体内衰老的另一个共同特征是端粒长度的缩短。总之,体外培养的细胞其复制衰老作为研究生物整体衰老的模型是可行的,而且是有用和有效的。目前,成纤维细胞体外增殖能力作为衰老生物学标志,广泛用于衰老研究,成为衰老研究的重要工具。
人们通常采用化学损伤或氧化损伤的极端方法诱使细胞迅速衰老,但这一过程不能够完全模拟正常细胞的衰老过程,这只能反映出一种应急状态下的细胞衰老现象。细胞衰老是一个非常复杂的过程,简单的比较衰老细胞与年轻细胞的基因表达情况并不能深刻的揭示细胞衰老的机制。只有研究细胞衰老过程中不同PD细胞的基因表达情况,才可以在不同的层次上揭示细胞衰老的机制,确定衰老复合调控的基因群,寻找明确的衰老标志,发现衰老相关疾病的新靶点。因此,模拟正常细胞衰老过程的模型可能会更好的用于研究细胞衰老这一生命现象。
衰老细胞的形态变化主要表现在细胞皱缩,膜通透性、脆性增加,核膜内折,细胞器数量特别是线粒体数量减少,胞内出现脂褐素等异常物质沉积,最终出现细胞凋亡或坏死。总体来说老化细胞的各种结构呈退行性变化。但这些细胞形态上的变化只是表面现象。
根据Hayflick证实成纤维细胞可分裂40~50次,细胞形态及细胞周期均发生变化,导致细胞衰老。理论上PD64已是一衰老细胞。本研究发现细胞的倍增能力下降、倍增时间增长。通过端粒长度测定进一步证实随着细胞的不断分裂增殖端粒DNA长度明显缩短,表明端粒长度是与细胞复制性衰老的确是密切相关的。由p21WAF-1的表达量可以进一步证实人胚肺细胞发生了细胞衰老,而且可以看出在PD44时细胞进入衰老状态,因为此后的p21WAF-1表达量趋于一平台,p21WAF-1在细胞衰老后增加量是趋于一平台的。通过这些验证试验可以进一步确定成功建立了细胞复制性衰老模型。
衰老是生物体的一个复杂过程。衰老细胞的表型在细胞生活史中是独特而稳定的。衰老细胞的细胞周期稳定的、不可逆的阻滞于G1期,丧失了对有丝分裂原的反应能力,不能进行DNA合成,不能进入S期,细胞形态及功能均发生变化。但仍能维持代谢活动,HEL细胞衰老时不易凋亡。细胞衰老与端粒密切相关,端粒的长度可由端粒酶调控,可通过在HEL细胞中表达hTERT建立衰老与癌变的联系。复制性衰老模型的建立不仅可用于研究细胞衰老,还可用于研究细胞凋亡、癌变在细胞生长、衰老过程中的可发生性,为在实践中抗衰老和治疗肿瘤提供新的材料基础。本实验成功建立了HEL细胞衰老模型,为进一步研究正常细胞复制性衰老的关系奠定了基础。
4 参考文献
1Debacq-Chainiaux F, Erusalimsky JD, Campisi J,etal. Protocols to detect senescence-associated beta-galactosidase (SA-βgal) activity, a biomarker of senescent cells in culture and in vivo〔J〕. Nature Protocols,2009;4(12):1798-806.
2Kurz DJ,Decary S,Hong Y,etal. Senescence-associated (beta)-galactosidase reflects an increase in lysosomal mass during replicative ageing of human endothelial cells 〔J〕. J Cell Sci,2000;113(20):3613-22.
3Harte AL,Silva NF, Miller MA,etal. Telomere length attrition, a marker of biological senescence, is inversely correlated with triglycerides and cholesterol in south asian males with type 2 Diabetes Mellitus 〔J〕. Exp Diabetes Res,2012;2012: 895185.
4Ignacio A,Rodriguez-Brenes,Charles S,etal. Quantitative theory of telomere length regulation and cellular senescence 〔J〕.PNAS,2010;107(12):5387-92.
5Hultdin M, Grönlund E, Norrback K,etal. Telomere analysis by fluorescence in situ hybridization and flow cytometry〔J〕. Nucleic Acids Res,1998;26(16):3651-6.
6Graziella Cimino-Reale, Esterina Pascale, Eva Battiloro,etal. The length of telomeric G-rich strand 3'overhang measured by oligonucleotide ligation assay〔J〕.Nucleic Acids Res,2001;29(7): e35.
7Li R, Ma L, Huang Y,etal. Characterization of a novel positive transcription regulatory element that differentially regulates the alpha-2-macroglobulin gene in replicative senescence〔J〕. Biogerontology,2011;12(6):517-625.
8Hong M, Li R,Zhang ZY,etal. mRNA level of alpha-2-macroglobulin as an aging biomarker of human broblasts in culture〔J〕. Exp Gerontol,2004;39(3):415-21.
9Baker DJ, Wijshake T, Tchkonia T,etal. Clearance of p16Ink4 a-positive senescent cells delays ageing-associated disorders〔J〕. Nature,2011;479(7372):232-6.
10Liu Y, Soren Johnson SM, Fedoriw YR,etal. Expression of p16INK4 a prevents cancer and promotes aging in lymphocytes〔J〕.Blood, 2011;117(12): 3257-67.
11Wang WG, Martindale JL, Yang XL,etal. Increased stability of the p16 mRNA with replicative senescence〔J〕.EMBO Reports,2005;6(2):158-64.
12Demidenko ZN, Zubova SG, Bukreeva EI,etal. Rapamycin decelerates cellular senescence〔J〕. Cell Cycle, 2009; 8(12):1888-95.
13Blagosklonny MV. Cell cycle arrest is not senescence〔J〕.Aging, 2011;3(2):94-101.
