吡格列酮对大鼠局灶性脑缺血再灌注损伤的神经保护作用机制
2014-09-12廖小明唐永刚刘开祥
余 智 廖小明 唐永刚 齐 立 孙 军 刘开祥
(杭州市淳安县第一人民医院神经内科,浙江 杭州 311700)
吡格列酮(PGZ)是一种人工合成的胰岛素增敏剂噻唑烷二酮类药,临床上广泛应用于2型糖尿病的治疗。目前有报道提示PGZ能通过激活PPARγ抑制炎症等过程,从而对脑缺血再灌注损伤具有一定的神经保护作用〔1〕。但关于PPARγ激动剂的神经保护作用机制尚未完全阐明。本实验采用大鼠局灶性脑缺血再灌注模型,应用PGZ进行预处理,观察其对大鼠术后神经功能及脑含水量、炎症反应和细胞凋亡的影响。
1 材料与方法
1.1动物分组 清洁级SD雄性大鼠120只,重量250~280 g。术前12 h禁食不禁水,随机(随机数字法)分为5组,每组各24只:①假手术组;②模型组;③PGZ组;④GW9662+PGZ组(GP组);⑤二甲基亚砜(DMSO)组。
1.2试剂 PGZ、GW9662和10% DMSO(Sigma公司,美国);核转录因子(NF)-κB及干扰素(IFN)-γ ELISA试剂盒(R&D Systems公司,美国);甲苯胺蓝(国药集团)、原位末端标记(TUNEL)试剂盒(Promega公司);Labo fuge 400R高速低温离心机(Heraeus公司,德国),多功能酶标仪(BioTek公司,美国),电子显微镜(OLYMPUS,日本)等。
1.3动物模型制备及处置 模型组:术前45 min经尾静脉注射生理盐水2 ml/kg,采用改良的Zea-Longa〔2〕法制备大鼠大脑中动脉阻断(MCAO)模型:麻醉成功后,取颈部左旁正中切口,暴露左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),结扎并游离ECA的近端,将蛙心夹夹闭CCA和ICA后在ECA游离段上剪开一个小口将制备好的尼龙线栓经CCA分支处通过ICA入颅,线栓深度为18~19 mm。缺血90 min后抽出线栓即可造成再灌注模型。PGZ组:术前45 min经尾静脉注射PGZ10 mg/kg。GP组:术前45 min先经尾静脉注射GW9662,剂量是0.3 mg/kg〔3〕,10 min后再经尾静脉注射吡格列酮10 mg/kg。D组:术前45 min经尾静脉注射10%DMSO 2 ml/kg。假手术组:术中分离左侧CCA、ICA及ECA,但不做任何缺血处理。
1.4指标检测
1.4.1神经功能评分 再灌注24 h后采用双盲法严格按Zea-Longa 5分法进行神经功能评分。
1.4.2脑含水量检测 再灌注24 h后随机抽取各组8只大鼠,立即断头取脑,去除小脑及低位脑干后快速用精密天平称取湿重,然后烘至恒重,称取干重,将(湿重-干重)/湿重×100%作为脑含水量的指标。
1.4.3NF-κB及IFN-γ含量水平测定 再灌注24 h后,各组再随机抽取8只大鼠,迅速断头取脑。于冰上在距额叶前端3 mm和9 mm处进行冠状分离,取中间6 mm厚的脑组织块,然后沿此脑块矢状缝两侧约2 mm处,从上至下切去两侧半球的正中结构,将左侧脑块作为缺血脑组织。严格按ELISA试剂盒检测要求进行操作。
1.4.4HE染色 将各组其余8只大鼠麻醉,以4℃生理盐水进行心脏快速灌洗,予多聚甲醛灌洗充分固定,并以同样的方法取得缺血脑组织,制成蜡块。自前往后连续冠状位切片,厚约5 μm。HE染色光学显微镜下(×400)观察神经细胞形态学变化并采图。
1.4.5尼氏染色及TUNEL染色 严格按照试剂盒检测步骤进行操作。尼氏染色在光镜(×400)下观察健存神经元(以尼氏小体为代表)的数量,计算尼氏小体的数目/相应的面积并采图。TUNEL染色在光镜下(×400)观察凋亡细胞(以胞核出现棕黄染色颗粒代表),计算TUNEL阳性率即TUNEL阳性细胞数占总细胞数的比值并采图。
2 结 果
2.1各组大鼠一般状况及神经功能 与模型组相比,经PGZ预处理的大鼠神经功能评分明显降低(P<0.01)。见表1。
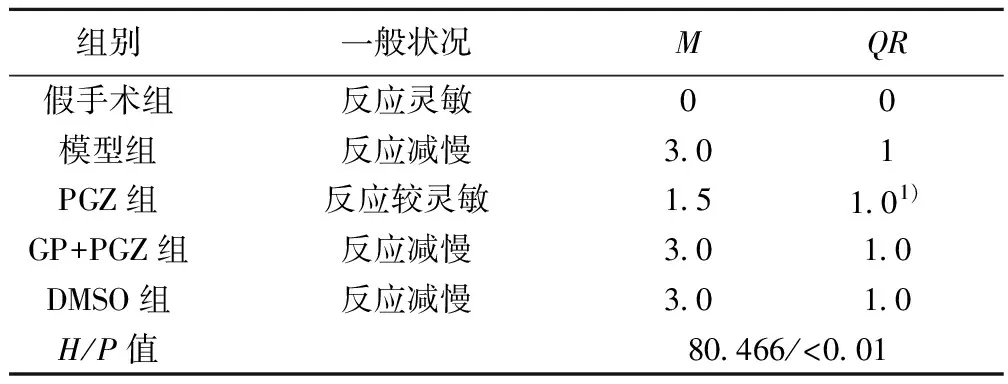
表1 各组大鼠一般状况及神经功能(n=24)
2.2脑组织含水量 与模型组相比,PGZ组大鼠含水量明显降低(P<0.01)。5组大鼠脑组织含水量的比较见表2。
2.3NF-κB、IFN-γ含量水平及相关性分析 与模型组比较,PGZ组大鼠NF-κB及IFN-γ含量水平均显著降低(P<0.05)。两组脑组织NF-κB与IFN-γ含量水平均呈显著正相关,回归方程模型组=-0.432+0.271x,rM=0.947(P<0.001),PGZ组=-4.168+0.748x,rP=0.961(P<0.001)。见表2。
2.4HE染色 切片经HE染色后,光镜下可见模型组呈明显的缺血损伤性改变,多数细胞体积缩小,正常组织结构消失,胞质疏松,胞核固缩深染,部分细胞坏死。PGZ组缺血性损伤改变较模型组明显减轻,细胞膜较完整,间质水肿减轻,坏死区域缩小。
2.5尼氏染色及TUNEL染色 假手术组尼氏小体多且体积大,呈紫色分布于核周围,且只有少量凋亡细胞。模型组尼氏小体数量明显减少,且变小或变形〔(63.06±9.05)%〕,而PGZ组相应区域尼氏体数量较多且变形较少〔(48.10±7.61)%〕,两组相比差异也有统计学意义(P<0.01)。见表2,图1。

表2 各组大鼠脑组织含水量、 NF-κB、IFN-γ含量、尼氏小体平均数值及凋亡细胞数
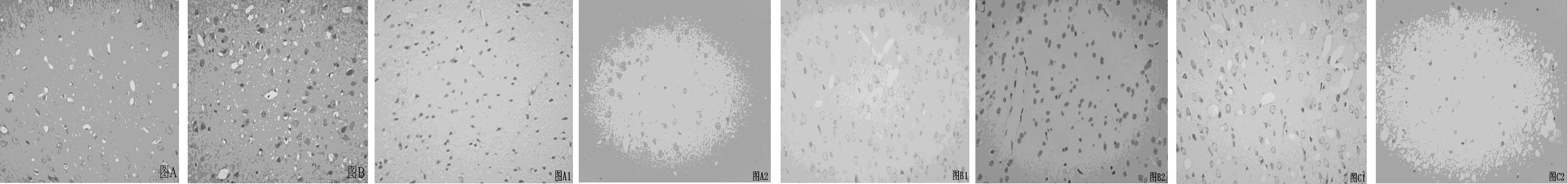
A:假手术组 B:模型组 C:PGZ组 D:DMSO组 A1:假手术组 B1模型组 C1:PGZ组 D1:DMSO组(A~D:尼氏小体染色;A1~D1:TUNEL染色)
3 讨 论
近期研究表明,脑缺血再灌注时神经细胞释放大量炎症信号,介导大量炎性细胞的聚集和炎性因子的释放〔4〕,加重缺氧直接造成的神经元坏死和凋亡,从而放大对缺血损伤区域细胞甚至是机体的损伤。本研究也已证实,减轻炎症反应可抑制脑缺血再灌注损伤所致的细胞凋亡〔5〕。炎症反应的要素包括信号传导分子、炎症细胞、黏附分子和转录因子。NF-κB属于NF-κb/Rel家族蛋白的一员,能够启动基因转录,从而参与一系列基因的调控和表达,在炎症反应、免疫应答、细胞凋亡调控等方面发挥重要作用。本实验结果表明脑缺血后诱导释放NF-κB而促进IFN-γ的表达。本实验结果与Xu 等〔6〕研究报道基本一致。此外,有研究表明IFN-γ可活化P38激酶,诱导细胞因子及Ⅱ类组织相容性复合体(MHC)的表达,共同参与细胞的凋亡〔7〕。本研究也发现模型组中IFN-γ的含量水平及细胞凋亡数量相比假手术组显著升高,我们推测IFN-γ在脑缺血再灌注损伤后形成细胞凋亡过程中发挥至关重要的作用。
有研究发现,PPARγ激动剂能活化细胞外信号调节激酶而抑制NF-κB的激活〔8〕。国内有研究报道,PGZ作为PPARγ特异性激动剂,可促进PPARγmRNA和蛋白的表达,增强其对脑缺血再灌注损伤的神经保护作用〔9〕。本实验发现PGZ可通过降低诱发NF-kB的释放能力,进而减少促炎介质(IFN-γ)的含量水平,从而发挥增加健存神经元而减少细胞凋亡的作用;若先给予GW9662〔10〕后再予PGZ处理,则可逆转PGZ的上述保护作用;同样,单独行DMSO预处理后的大鼠在相关方面未得到明显的改善。
本文提示PGZ具有阻止或延缓神经细胞水肿坏死,对保护缺血再灌注后神经细胞损伤具有积极意义,而GW9662则可逆转PGZ抗细胞水肿坏死的效应。
本研究结果表明,吡格列酮可通过激活PPARγ负性调节脑组织中NF-κB的含量水平,进一步减少促炎介质(IFN-γ)的释放,减轻了大鼠缺血再灌注后的细胞水肿,从而很好地增加健存神经元而减少细胞凋亡。
4 参考文献
1Sundararajan JL,Gamboa NA, Victor EW,etal.Peroxisome proliferator-activated receptor-ligands reduce inflammation and infarction size in transient ischemia〔J〕.Neuroscience,2005;130(3):685-96.
2Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
3Shimizu T,Szalay L,Hsieh YC,etal.A role of PPAR gamma in and rostenediol-mediated salutary effects on cardiac function following trauma-hemorrhage〔J〕.Ann Surg,2006;244(1):131-8.
4A.Denes P,Thornton NJ,Rothwell,etal.Inflammation and brain injury:acute cerebral ischaemia,peripheral and central inflammation〔J〕.Brain Behav Immun,2010;24(5):708-23.
5吴 岚,周素娴,刘开祥.青藤碱对糖尿病大鼠脑缺血再灌注损伤后BCl-2和caspase-3表达的影响〔J〕.中国老年学杂志,2010;30(11):1543-5.
6Xu H,Tang Y,Liu DZ,etal.Gene expression in peripheral blood differs after cardioembolic compared with large-vessel atherosclerotic stroke:biomarkers for the etiology of ischemic stroke〔J〕.Cereb Blood Flow Metab,2008;28(7):1320-8.
7Schindle C,Shuai K,Prezioso VR,etal.Interferon-dependent tyrosine PhosPhorylation of alatent cytoplasmic transeription factors〔J〕.Science,1992;257(5071):809-13.
8Chen F,Wang MO,Connor JP,etal.Phosphorylation of PPARgamma via active ERKI/2 leads to its physical association with P65 and inhibition of NF- kappabeta〔J〕.J Cell Biochem,2003;90(4):732-44.
9刘尊敬,杨期东,刘运海,等.脑梗死患者周围血淋巴细胞PPARγmRNA动态变化〔J〕.中风与神经疾病杂志,2004;21(6):521-2.
10Kamada N,Calne RY.Orthotopic liver transplantation in the rat.Technique using cuff for portal vein anastomosis and biliary drainage〔J〕.Transplantation,1979;28(1):47-50.
