浸润性乳腺癌中14-3-3σ基因的甲基化及其转录表达的意义
2014-09-12齐凤杰赵树鹏
齐凤杰 刘 廷 姚 萍 赵树鹏
(辽宁医学院病理教研室,辽宁 锦州 121001)
14-3-3σ是一种特异性上皮细胞因子,被认为是肿瘤抑制基因,与肿瘤关系最为密切〔1〕。研究显示,多种肿瘤细胞中14-3-3σ基因的CpG岛发生高频率甲基化,使14-3-3σ基因沉默或低表达,造成G2期检控点损伤,使基因缺陷积累,从而导致细胞发生恶性转化〔1〕。本研究通过采用甲基化特异性聚合酶链反应法(MSP)对浸润性乳腺癌患者癌组织及相应癌旁组织进行14-3-3σ甲基化检测,RT-PCR法检测14-3-3σ mRNA转录,探讨在浸润性乳腺癌中14-3-3σ甲基化与转录的关系,为寻找乳腺癌的特异性肿瘤标志及为乳腺癌的早期诊断提供理论和实验依据。
1 材料与方法
1.1病例材料 选取2010年5月至2011年4月辽宁医学院附属第一医院手术切除并经2位以上病理医师确诊的浸润性乳腺癌组织标本73例。患者均为女性,年龄27~79岁,中位年龄48岁。所有患者术前均未进行放化疗及内分泌治疗,按国际抗癌联盟(UICC)2003年TNM分期:Ⅰ期患者22例、Ⅱ期31例、Ⅲ期20例;根据2003年世界卫生组织(WHO)乳腺癌分类标准进行组织学分类:非特殊型浸润性导管癌40例、浸润性小叶癌10例、特殊型浸润性乳腺癌23例,有淋巴结转移34例、无淋巴结转移39例。另取同一患者的癌旁>5 cm处乳腺组织73例作对照。新鲜癌组织及癌旁组织均冻存于-80℃冰箱用于提取DNA及RNA。
1.2试剂 DNA甲基化修饰试剂盒购自EPIGENTEK公司,基因组DNA提取试剂盒、Trizol、RT-PCR试剂盒、Hot Start Taq DNA聚合酶、L1000TMDNA Marker均购自大连宝生物工程有限公司。
1.3方法
1.3.1RNA提取和cDNA合成 50 mg组织剪碎后,按照Trizol说明书从乳腺癌组织及相应癌旁组织中提取总RNA,紫外分光光度法测定RNA的浓度和纯度,1%琼脂糖凝胶电泳检测RNA。取总RNA 1 μg,按反转录第1链cDNA合成试剂盒说明书进行cDNA链合成,置于-20℃保存。
1.3.2DNA提取 每例新鲜标本均按照说明书进行DNA提取,最后加入适量灭菌水溶解基因组DNA。核酸蛋白定量仪测定DNA浓度和OD值。取DNA溶液2 μl加3 μl 6×Loading Buffer,1%琼脂糖凝胶电泳(80 V电压,50 min),紫外灯下观察,凝胶图像分析系统拍照。其余DNA溶液均-80℃冻存。
1.3.3DNA的甲基化修饰 每例DNA标本取1 μg按试剂盒说明书进行修饰,在初步去盐,脱磺酸基后,加12 μl R6溶液到这个离心管里过滤,1 2000 r/min离心20 s来洗脱修饰的DNA,终浓度约为40 ng/μl,-80℃冻存;经此修饰后,DNA中未甲基化的胞嘧啶(C)被去氨基和磺化,转化为尿嘧啶(U)。
1.3.4MSP 14-3-3σ基因MSP和非甲基化特异性聚合酶链反应(USP)上下游引物均由大连宝生物工程有限公司合成,引物序列参考文献〔2〕设计如表1;配制PCR反应液前,先把盛放修饰后DNA的EP管简单离心,避免残留的试剂接触PCR反应管(此步重要)。PCR反应体系20 μl:其中Hot Start Taq酶(5 U/μl)0.2 μl,10×PCR Buffer(Mg2+Plus)3 μl,dNTP Mixture(各2.5 mmol/L)2 μl,甲基化修饰后的DNA模板1 μl,上下游引物各1 μl(20 μmol/L),灭菌蒸馏水11.8 μl。PCR反应条件:95℃预变性5 min;95℃变性30 s,65℃(M)或59℃(U)退火30 s,72℃延伸30 s,共35个循环;72℃后延伸5 min。灭菌蒸馏水代替模板DNA做阴性对照。琼脂糖凝胶电泳:取扩增产物20 μl加3 μl 6×Loading Buffer, 2%琼脂糖凝胶电泳(110 V电压,40 min)。DL1000TMDNA Marker每次取10 μl直接电泳。凝胶成像系统拍照。
1.3.5RT-PCR反应 14-3-3σ基因和作为内参照的β-actin基因引物设计均由大连宝生物工程有限公司合成,引物序列参考文献〔3〕设计。20 μl反应体系包括1 μg总RNA反转录所获得的cDNA、5×RT Buffer(含Mg2+)4 μl、d NTPs 1 μl 、10 μmol/L的上下游引物各1 μl、TaKaRa Taq HS0.2 μl、超纯水9.8 μl。见表2。
PCR反应条件:94℃ 5 min,94℃ 30 s、52℃ 30 s、72℃30 s,37个循环,72℃延伸4 min。
1.4统计学处理 采用SPSS17.0软件,组间率的比较采用χ2检验。分析浸润性乳腺癌14-3-3σ启动子甲基化与基因表达间关系采用Spearman相关分析。

表1 浸润性乳腺癌14-3-3σ基因甲基化特异性PCR引物

表2 浸润性乳腺癌14-3-3σ基因RT-PCR引物
2 结 果
2.1基因组DNA的提取及电泳结果 1%的琼脂糖凝胶电泳结果显示:基因组DNA条带清晰,无拖尾现象。核酸蛋白定量仪测定其浓度及OD值,满足进一步DNA修饰的实验要求。见图1。

1~3:癌旁乳腺组织;4~7:浸润性乳腺癌组织

1,3,5:甲基化PCR产物;2,4,6:未甲基化PCR产物;M:DL1000 DNA Marker
2.2MSP检测结果 MSP检测结果分为甲基化、未甲基化和部分甲基化3种(见图2),其中部分甲基化的病例归为甲基化统计。73例浸润性乳腺癌和癌旁乳腺组织中,甲基化的检出率分别为54.79%(40/73)和23.29%(17/73),差异有统计学意义(χ2=15.225,P<0.05)。甲基化在105 bp处出现条带,非甲基化在107 bp处出现条带。
2.3RT-PCR检测结果 73例浸润性乳腺癌组织中有53例表达缺失,缺失率为72.6%。癌旁正常组织中14-3-3σ基因的表达缺失15例,缺失率为20.55%,明显低于浸润性乳腺癌组织(χ2=39.748,P<0.05)。14-3-3σ在247 bp处出现条带,内参β-actin在520 bp处出现条带。见图3。
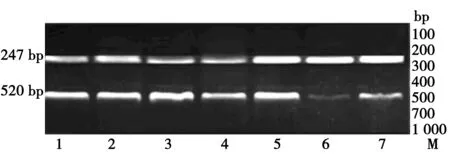
1~4:浸润性乳腺癌,5~7:乳腺癌旁组织M:DL 1 000 DNA Marker
2.4浸润性乳腺癌14-3-3σ基因启动子的甲基化与临床病理特征的关系 浸润性乳腺癌14-3-3σ基因甲基化检出率与TNM分期、腋窝淋巴结转移及ER受体等分组间差异均有显著性意义(P<0.05),与其他临床特征之间差异均无统计学意义(P>0.05)。见表3。

表3 浸润性乳腺癌14-3-3σ基因启动子的甲基化与临床病理特征的关系〔n(%)〕
2.573例浸润性乳腺癌14-3-3σ基因启动子甲基化与基因表达的关系 在40例14-3-3σ基因启动子CpG岛发生异常甲基化的浸润性乳腺癌组,均未检测到14-3-3σ的mRNA表达;而33例非甲基化组,有25例表达,表达率为75.76%,应用Spearman相关分析14-3-3σ基因启动子甲基化和基因表达呈负相关性(r=-0.676,P=0.000)。
3 讨 论
14-3-3蛋白,是一组高度保守且几乎在所有真核生物细胞中都有表达的蛋白质家族,具有多种生物学功能〔4〕:参与信号转导、细胞增殖、凋亡、蛋白质运输、细胞骨架构建及离子通道的表达、转录和复制等。14-3-3σ抑癌基因定位于1p35,在细胞周期信号传导途径中起着重要作用,是G2细胞周期检查点的基因家族成员,为CDK抑制因子,负责DNA的损伤修复,故被认为是细胞周期检查点基因。国外研究发现,14-3-3σ基因甲基化异常改变与肿瘤发生发展的关系极为密切,有较高的甲基化频率〔5,6〕。在Ferguson等〔7〕研究中,对48例原发性乳腺癌组织标本进行14-3-3σ mRNA检测,结果只有3例表达,且表达缺失率与其甲基化直接相关。乳腺癌细胞株经过5-氮杂胞苷药物处理后,14-3-3σ基因发生去甲基化,又重新转录表达。故首次提出乳腺癌的转录表达缺失与基因甲基化密切相关,说明14-3-3σ基因的甲基化是其转录缺失的重要原因。Yang等〔5〕报道,14-3-3σ蛋白在原发性乳腺癌中处于低表达状态,增加乳腺癌细胞14-3-3σ的表达可以抑制肿瘤的发生。14-3-3σ蛋白主要表达于上皮组织,通过细胞周期蛋白CDKS复合物的磷酸化作用而参与细胞周期调控,抑制细胞进入增殖周期,阻止分裂,促进终末分化,最终诱导其凋亡。吕军等〔8〕发现散发性乳腺癌中14-3-3σ基因有较高的甲基化率(90%),其甲基化与乳腺癌的组织分型、组织分级和淋巴结转移存在密切关系,且浸润性癌甲基化率高于原位癌,可能由于14-3-3σ基因甲基化程度的增加,造成其转录水平下调或缺失,从而导致了乳腺癌的进展。因此,认为14-3-3σ高甲基化频率可能预示着甲基化是使该基因失活的重要方式之一。本研究检测结果说明14-3-3σ基因甲基化很可能是导致乳腺癌发生的一个条件。本实验还发现,不同的实验组,研究结果有所不同。分析原因,甲基化率的高低与甲基化实验条件和标本的选取关系密切。Ferguson 等〔7〕在退火温度为56℃,31个循环条件下,检测到14-3-3σ基因在乳腺癌组织标本中甲基化率达91%,标本选取都经过显微切割技术处理,以保证标本肿瘤成分的纯度。吕军等〔8〕实验研究显示,14-3-3σ基因在散发性乳腺癌组织标本中甲基化率也为90%,反应条件为58℃,30~35个循环。钟政荣等〔9〕采用60℃退火温度,35个循环条件,检测到14-3-3σ基因在散发性乳腺癌中甲基化率为85%。我们是在65℃退火温度,35个循环条件下得出甲基化率为66.17%。以上研究和本实验均采用相同的甲基化引物〔8〕。所有研究都显示14-3-3σ基因在乳腺癌中甲基化率很高,为其成为乳腺癌诊断的肿瘤标记物提供可能,但应用于临床尚需规范与标准化。
4 参考文献
1Simpson PT,Gale T,Reis Filho JS,etal.Distribution and significance of 14-3-3σ,a novel myoepithelial marker,in normal,benign,and malignant breast tissue〔J〕.J Pathol,2004;202(3):274-85.
2Zurita M,Lara PC,del Moral R,etal.Hypermethylated 14-3-3-sigma and ESR1 gene promoters in serum as candidate biomarkers for the diagnosis and treatment efficacy of breast cancer metastasis〔J〕.BMC Cancer, 2010;217(10):1186-90.
3耿翠芝,桑梅香,王士杰,等.P53突变型乳腺癌细胞系中P73对细胞周期抑制因子14-3-3σ的调节作用〔J〕.中华实验外科杂志,2007;24(1):12-4.
4Paul G,Heusden HV.14-3-3σ:regulators of nu2merous eukaryotic proteins〔J〕.Iubmb Life,2005;57(9):623-9.
5Yang H,WenN YY,Zhao RY,etal.DNA damage-induced protein 14-3-3σ inhibits protein kinase B /Akt activation and suppresses Akt-activated cancer〔J〕.Cancer Res,2006;66(4):3097-105.
6Henrique R,Carmen J,Mohammad OH,etal.Frequent 14-3-3σ promoter methylation in benign and malignant prostate lesions〔J〕.DNA Cell Biol,2005;24(5):264-9.
7Ferguson AT,Evron E,Umbr icht CB,etal.High frequency of hypermethylation at the 14-3-3 sigma locus leads to gene silencing in breast cancer〔J〕.Proc Natl Acad Sci USA,2000;97(11):6049-54.
8吕 军,冯 景,周有利,等.散发性乳腺癌癌变过程14-3-3σ异常甲基化与其转录水平的关系〔J〕.中国癌症杂志,2007;17(4):311-4.
9钟政荣,沈继龙,李兴武,等.乳腺癌14-3-3σ基因异常甲基化的研究〔J〕.中华检验医学杂志,2007;30(1):41-4.
