阿司匹林对宫颈癌Hela细胞凋亡及增殖的影响
2014-09-12邢邯英李建立褚兆苹贾利刚
王 蓓 邢邯英 李建立 褚兆苹 贾利刚 秦 英
(河北省人民医院妇产科,河北 石家庄 050051)
肿瘤的发生、发展涉及多基因及其他多种因素的共同参与,是细胞增殖与凋亡机制紊乱的结果。抑制肿瘤细胞增殖,诱导其发生凋亡在肿瘤的预防和治疗过程中发挥着重要的作用。目前,越来越多的研究表明,非甾体类抗炎药物阿司匹林能够通过抑制细胞增殖、促进肿瘤细胞凋亡而降低胃癌、肺癌、卵巢癌等多种恶性肿瘤的发生,对肿瘤具有一定的预防和治疗作用〔1,2〕。本研究探讨阿司匹林对人宫颈癌Hela细胞增殖及凋的影响。
1 材料和方法
1.1材料 人宫颈癌Hela细胞(河北医科大学第四医院科研中心);阿司匹林(Sigma公司);RPMI-1640培养基(Hyclone公司);小牛血清、胰酶DMSO等(Gibco公司);鼠抗人Bcl-2、抗人Bax和羊抗鼠IgG-HRP二抗(Santa Cruz生物工程公司);Hochest33258(美国Sigma-Aldrich 公司);WST-1(瑞士 Roche 公司)。
1.2细胞常规培养 接种宫颈癌Hela细胞于含10%新生牛血清的RPMI-1640培养基中,于37℃,5%CO2饱和湿度的恒温培养箱中培养。细胞贴壁生长约90% 融合时,以0.25%胰酶消化,每周传代2~3次。
1.3分组 实验分为对照组和阿司匹林干预组。①对照组:取对数生长期的Hela细胞以5×105/瓶的密度接种于25 cm2培养瓶中,24 h后更换含1% 乙醇的RPMI-1640培养基,然后继续培养48 h;②阿司匹林干预组:细胞接种24 h后更换含有阿司匹林浓度分别为1.0、5.0、10.0 mmol/L 的RPMI-1640培养基(阿司匹林纯品溶于无水乙醇中,过滤除菌,再用RPMI-1640培养基分别配置成终浓度为1、5、10 mmol/L,无水乙醇最大浓度为1%),再置于37℃,CO2含量5%饱和湿度的培养箱中48 h。
1.4细胞增殖检测
1.4.1显微镜观察 接种对数生长期的Hela细胞到6孔板,每孔1×105个,培养24 h后,以不同浓度的阿司匹林(1.0、5.0、10.0 mmol/L)处理细胞48 h,镜下观察其生长状况。
1.4.2水溶性四氮唑(WST-1) 检测 取对数生长期的Hela细胞接种到 96 孔板 ,每孔0.1×104个,接种细胞24 h后加入不同浓度的阿司匹林(1.0、5.0、10.0 mmol/L),分别于作用后24、48、72 h每孔加入10 μl细胞增殖试剂WST-1,继续培养2 h,然后用酶标仪检测 450 nm 波长各孔的光密度值(D450),每组设立 3 个复合孔。 计算增殖抑制率。 增殖抑制率(%)= 〔1-观察组D450值/对照组D450值〕×100%。
1.5细胞凋亡检测
1.5.1Hochest 33258染色 不同浓度的阿司匹林(1.0、5.0、10.0 mmol/L)处理Hela细胞48 h后吸尽培养液,加入固定液,用PBS洗2遍。加入Hoechst 33258染色液,染色5 min。滴一滴抗荧光淬灭封片液于载玻片上,荧光显微镜下观察。
1.5.2TUNEL染色 接种1×105个细胞于6孔板中,培养过夜后用设定浓度的 阿司匹林处理细胞48 h收获细胞。4%多聚甲醛液固定30 min,过氧化氢孵育、牛血清白蛋白封闭、抗体孵育、SABC法染色,封片后光学显微镜下观察、计数、拍照。
1.6Western印迹检测Bcl-2、Bax蛋白表达 细胞经药物处理后24、48 h,收集细胞加入细胞裂解液,冰上放置30 min,10 000 r/min离心1 min,保留上清,考马斯亮蓝染色酶标仪测定蛋白含量,加入上样Buffer沸水中水浴5 min使得蛋白变性,在10% SDS-PAGE凝胶垂直电泳分离蛋白,再将其转移到PVDF膜上,5%脱脂奶粉封闭过夜,分别加鼠抗人Bcl-2、抗人Bax抗体一抗作用后,羊抗鼠IgG-HRP反应2 h,TBST洗涤2遍,ECL显影压胶片。

2 结 果
2.1细胞增殖情况 显微镜观察:与对照组相比,处理48 h后,阿司匹林浓度在1 mmol/L时,肿瘤细胞生长速度变慢;5 mmol/L时,可以看到大量变圆的凋亡细胞;10 mmol/L时,几乎看不到贴壁的完整细胞(图1)。WST-1检测:与对照组相比,处理24 h,高剂量组(10 mmol/L)细胞数目明显减少;处理48~72 h 后,中剂量组(5 mmol/L)对细胞的生长已有明显抑制作用,高剂量组(10 mmol/L)细胞出现凋亡,少见存活细胞(见表1)。
2.2Hochest 33258染色镜下观察凋亡现象 见图2。阿司匹林作用于细胞48 h后,各剂量组均出现凋亡征象,表现为细胞核内可见浓染致密的蓝色荧光颗粒及明显核形态变化,并且随着阿司匹林浓度的增高凋亡现象越明显。
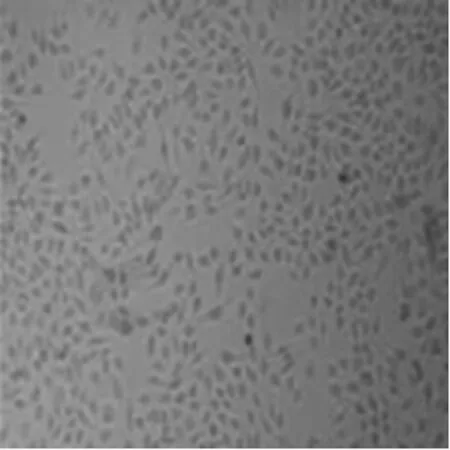
对照组

1 mmol/L

5 mmol/L

10 mmol/L
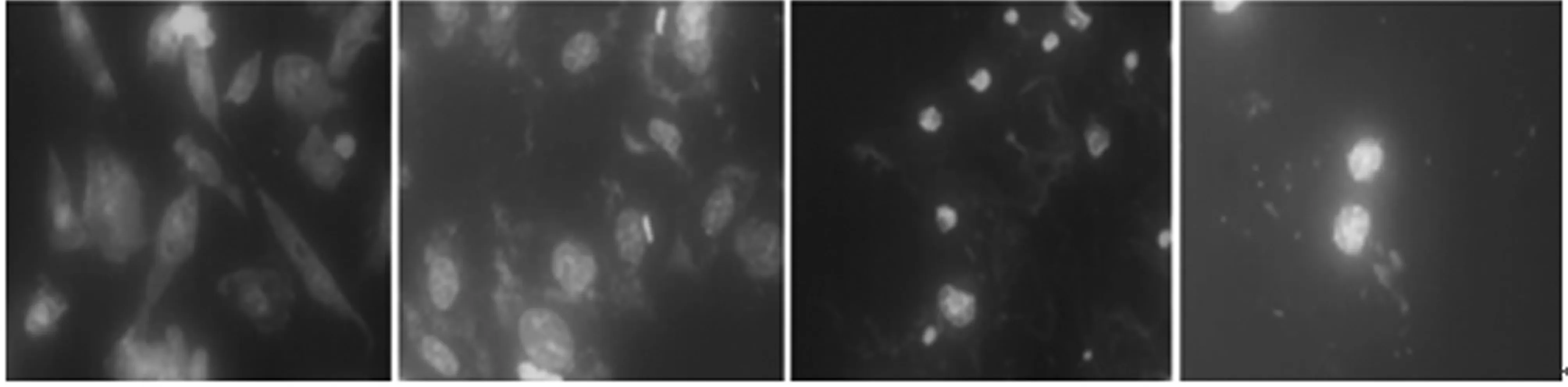
对照组 1 mmol/L 5 mmol/L 10 mmol/L
2.3TUNEL染色镜下观察凋亡现象 细胞经不同浓度阿司匹林作用48 h后,TUNEL法检测结果显示不同浓度的阿司匹林可诱导细胞均发生凋亡,其表现为TUNEL染色阳性,即细胞核被染成颜色深浅不同的棕黄色,并且随着剂量的增加效应越明显,见图3。

表1 WST-1测定阿司匹林剂量和时间依赖性抑制Hela细胞的增殖

对照组
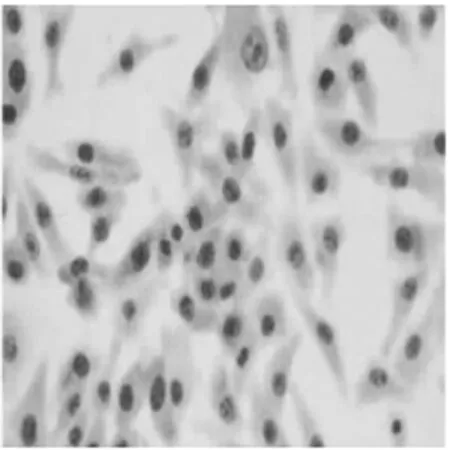
1 mmol/L
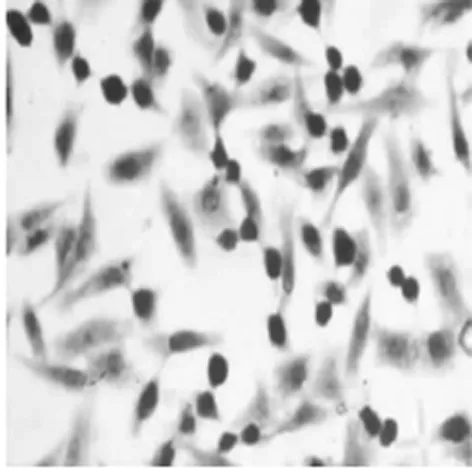
5 mmol/L
10 mmol/L
2.4Western印迹检测Bcl-2、Bax蛋白表达 不同浓度阿司匹林作用24 h后,Hela细胞抑凋亡基因Bcl-2蛋白表达减少,促凋亡基因Bax蛋白表达增加,作用48 h后Bcl-2蛋白表达明显减少,Bax蛋白表达显著增加(见图4)。
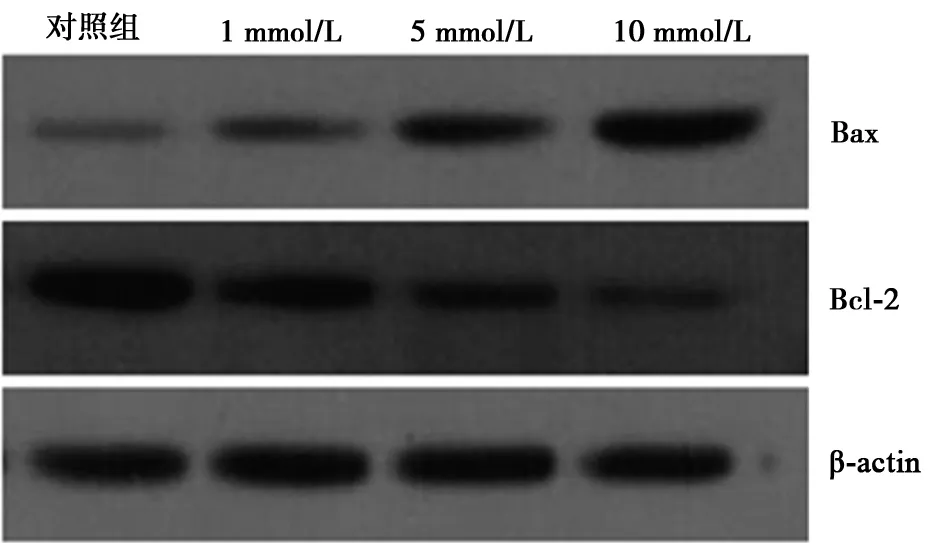
图4 Western印迹检测Bcl-2、Bax蛋白表达
3 讨 论
近年来人们发现阿司匹林等具有防治肿瘤的作用,其诱导肿瘤细胞凋亡的相关机制主要分为依赖于环氧化酶(COX)-2 途径和非COX-2 途径两大方面〔3〕。研究认为,COX-2 的活性增高可以引起前列腺素 E2(PGE2)和Bcl-2 的高度表达,降低 E-钙黏蛋白的活性而抑制细胞凋亡、刺激血管生成,从而导致肿瘤的发生,并增加恶性肿瘤的侵袭力〔4〕。而阿司匹林可通过抑制环氧化酶使花生四烯酸至前列腺素的代谢通路受阻,对肿瘤的发生、发展起到化学预防和治疗的作用〔5〕。在非 COX-2 的途径中,研究表明,阿司匹林可通过调节 B 细胞淋巴瘤/白血病(BCL) 家族,C-myc,P 53,Caspase 等癌基因和抑癌基因〔6〕,影响细胞凋亡信号的传导而抑制肿瘤细胞的生长,促进其发生凋亡。
Donowitz等〔7〕首次报道了长期服用阿司匹林的人群较普通人群结直肠癌的发病率明显降低,此后数项流行病学调查、动物实验和体外实验都得出了类似的结论。Moysich等〔8〕通过临床调查发现,规律服用阿司匹林可有效降低肥胖妇女子宫内膜癌的发病率,Kutuk等〔5〕研究发现,阿司匹林能够以剂量依赖的方式抑制体外子宫内膜腺癌细胞株Ishikawa的生长,细胞凋亡是这些变化的机制之一。细胞凋亡已经成为重要的生物学事件,也是抗肿瘤治疗的一大研究热点和新靶向〔10〕。此外,近年来许多文献报道,DNA损伤因子包括化疗药物和放疗等,在损伤DNA的同时还可以引起肿瘤细胞在G2/M期阻滞,甚至诱导细胞凋亡〔11〕。
本研究结果显示,一定浓度的阿司匹林可以抑制人宫颈癌细胞株Hela增殖,并随着药物浓度的增加和作用时间的延长,其抑制作用也逐渐增强;且通过凋亡特异性细胞核染色等检测证实,阿司匹林在抑制人宫颈癌细胞增殖的同时还诱导细胞发生凋亡。本研究结果提示,阿司匹林能有效抑制宫颈癌细胞的生长和增殖,诱导其发生凋亡,有望成为临床上治疗恶性肿瘤的重要手段。
综上所述,阿司匹林处理宫颈癌Hela细胞后,可以影响Bcl-2基因家族的调控,上调促进凋亡的Bax基因表达同时下调抑制凋亡Bcl-2基因,使得线粒体参与的凋亡途径被活化,最终激活细胞凋亡过程中最重要的终末执行酶Caspase-3,引起细胞凋亡〔12〕,可能为阿司匹林诱导Hela细胞凋亡的主要机制。
4 参考文献
1Leung AM,Redlak MJ,Miller TA.Aspirin-induced mucosal cell death in human gastric cells:role of a caspase-independent mechanism〔J〕.Dig Dis Sci,2009;54(1):28-5.
2Xiang S,Sun Z,He Q,etal.Aspirin inhibits ErbB2 to induce apoptosis in cervical cancer cells〔J〕.Med Oncol,2010;27(2):379-87.
3Lee SK,Park MS,Nam MJ.Aspirin has antitumor effects via expression of calpain gene in cervical cancer cells〔J〕.J Oncol,2008(2);2008:285-374.
4Kutuk O,Basaga H.Aspirin inhibits TNFα- and IL-1-induced NF-κB activation and sensitizes Hela cells to apoptosis〔J〕.Cytokine,2004;25(2):229-37.
5Kutuk O,Basaga H.Aspirin prevents apoptosis and NF-κB activationinduced by H2O2in Hela cells〔J〕.Talor﹠Francis healthsciences,2003;12(10):1267-76.
6Rajnish A.Cyclooxygenase-1 is overexpressed and promotes angiogenic growth factor production in ovarian cancer〔J〕.Cancer Res,2003;63(3):906-11.
7Donowitz M,Pauker SG.Evaluation for colon cancer in patients with occult fecal blood loss while taking aspirin:a Bayesian viewpoint〔J〕.Med Decis Making,1982;2(2):147-60.
8Moysich KB,Baker JA,Rodabaugh KJ,etal.Regular analgesic use and risk of endometrial cancer〔J〕.Cancer Epidemiol Biomarkers Prev,2005;14(12):2923-8.
9Hector A,Arango MD.Aspirin effects on endometrial cancer cell growth〔J〕.Obstet Gynecol,2001;97(3):423-7.
10Morré DJ,Morre DM.tNOX,an alternative target to COX-2 to explain the anticancer activities of non-steroidal anti-inflammatory drugs (NSAIDS) 〔J〕.Mol Cell Biochem,2006;283(1-2):159-67.
11朱慧明,吴 铁,崔 燎.阿司匹林诱导人肺腺癌细胞株SPC-1凋亡研究〔J〕.中国药理学通报,2004;20(6):640-3.
12Kim KY,Seol JY,Jeon GA,etal.The combined treatment of aspirin and radiation induces apoptosis by the regulation of bcl-2 and caspase-3 in human cervical cancer cell〔J〕.Cancer Lett,2003;89(2):157-66.
