Cripto-1、Activin-A在人肺腺癌组织中的表达及临床意义
2014-09-12单杨杨李晟磊
单杨杨 李晟磊
(郑州大学第五附属医院老年病科,河南 郑州 450052)
畸胎瘤衍生生长因子 (Cripto)-1基因属于表皮生长因子Cripto -FRL-Criptic(EGF-CFC)基因家族成员,研究表明,Cripto-1蛋白在正常组织中低表达或不表达,但在许多恶性肿瘤中高表达,因此在一定程度上发挥着癌基因的作用。激活素(Activin)-A基因属于转化生长因子(TGF) 的超家族成员,大量研究证实Activin-A对多种肿瘤细胞具有抑制作用,在多数肿瘤细胞中低表达,而在正常组织细胞中高表达,在一定程度上发挥着抑癌基因的作用。本研究探讨这两种基因蛋白对肿瘤临床治疗的指导意义。
1 材料与方法
1.1材料 选择2011年1月至2013年4月在郑州大学第一附属医院胸外科手术的肺腺癌患者石蜡包埋标本47例,其中男29例,女18例,平均年龄(48.8±7.8)岁,其中无淋巴结转移19例,有淋巴结转移28例;按照肺癌TNM分期标准,Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期20例。结合2011年国际肺腺癌新分类标准〔1〕,47例肺腺癌均为浸润性,具体又可分为:乳头型20例、微乳头型8例、实体型5例、腺泡型14例。对照组:选择同期在郑州大学第一附属医院胸外科手术切除的正常肺组织石蜡包埋标本25例,其中男11例,女14例,平均年龄(47.9±9.1)岁。
1.2免疫组化染色 染色方法按照免疫组织化学链霉素抗生物素-过氧化物酶(SP)法进行操作。主要试剂:兔抗人Cripto-1多克隆抗体 (英国abcam公司);羊抗人Activin-A多克隆抗体 (美国R&D公司);封闭用正常羊血清、生物素标记的羊抗兔二抗、生物素标记的兔抗山羊IgG、免疫组化显色试剂盒(北京康为试剂公司)。
1.3结果判断 Cripto-1蛋白阳性表达产物主要定位于细胞质和细胞膜中,而Activin-A蛋白阳性表达产物主要定位于细胞质中,两者均以细胞质和(或)细胞膜中呈现棕黄色颗粒为阳性细胞。免疫组化结果评分标准:①阳性细胞数计分:每张切片于显微镜下随机选择10个高倍视野,染色结果判定采用半定量加分法,即阳性细胞数<5%计0分,5%~20%计1分,21%~50%计2分,51%~75%计3分,>75%计4分;②细胞染色强度计分:淡黄色计1分,棕黄色计2分,棕褐色计3分,不着色计0分。将①和②所计分数相加,≥3分为阳性,<3分为阴性。
1.4统计学方法 应用SPSS13.0软件进行分析,免疫组化结果与临床病理参数之间采用χ2检验,Cripto-1与Activin-A两者的相关性分析采用Spearman检验。
2 结 果
2.1Cripto-1蛋白在肺腺癌组织及正常肺组织中的表达 Cripto-1在肺腺癌组织中的阳性表达率〔72.3%(34/47)〕远高于其在正常肺组织中表达〔12.0%(3/25)〕(χ2=23.786,P<0.05)。见图1。

高表达 低表达 正常肺组织(阳性)
2.2Cripto-1蛋白的表达与肺腺癌各项临床病理学特征之间的关系 Cripto-1蛋白的高表达与肺腺癌的TNM分期、淋巴结转移及肺腺癌的主要病理组织学分型具有密切相关性(P<0.05)。Cripto-1蛋白的阳性表达在Ⅲ~Ⅳ期肺腺癌组织中较Ⅰ~Ⅱ期明显升高,在有淋巴结转移组中的阳性表达率远高于在无淋巴结转移组,并且Cripto-1蛋白在肺腺癌不同病理组织学分型标本中的阳性表达率也存在显著统计学差别,其中在实体型和微乳头型中的阳性表达率远高于在乳头型和腺泡型中的阳性表达率,见表1。
2.3Activin-A蛋白在肺腺癌组织及正常肺组织中的表达 Activin-A蛋白在肺腺癌组织中的阳性表达率〔59.6%(28/47)〕远低于其在正常肺组织中的表达〔92.0%(23/25)〕(χ2=17.860,P<0.05)。见图2。

阳性 低表达 正常肺组织(高表达)
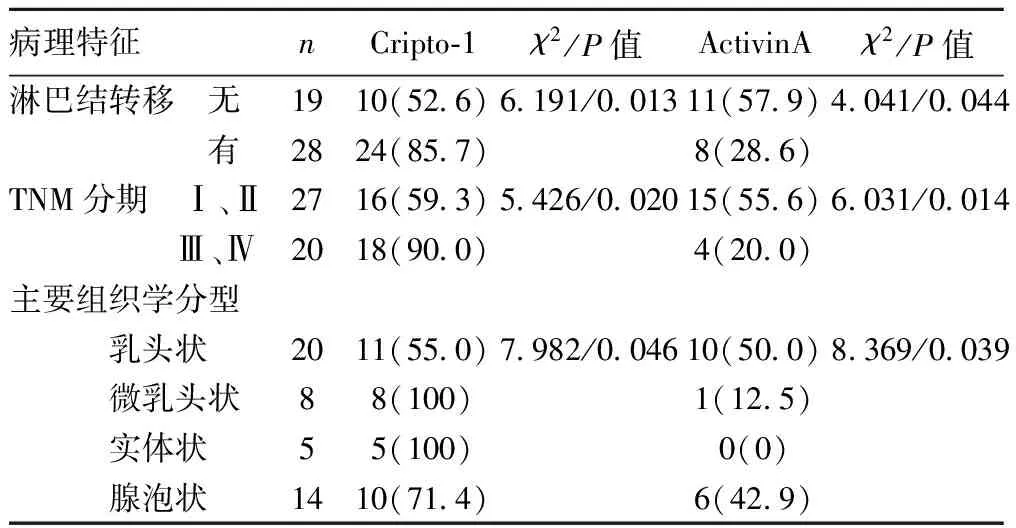
表1 Cripto-1 蛋白及Activin-A蛋白阳性表达与肺腺癌临床病理学特征的关系〔n(%)〕
2.4Activin-A蛋白的表达与肺腺癌各项临床病理学特征之间的关系 Activin-A蛋白的低表达与肺腺癌患者的TNM分期、淋巴结转移及肺腺癌的主要病理组织学分型密切相关(P<0.05)。Activin-A蛋白在肺腺癌有淋巴结转移组中的阳性表达率远低于在无淋巴结转移组,在Ⅲ~Ⅳ期癌组织中的阳性表达率较Ⅰ~Ⅱ期明显降低,并且在实体型和微乳头型中的阳性表达率明显低于乳头型和腺泡型(均P<0.05),见表1。
2.5Activin-A蛋白与Cripto-1蛋白在肺腺癌中表达的关系 在Activin-A阳性表达的28例肺腺癌组织中,Cripto-1阳性表达3例,阴性表达25例;在阴性表达的19例肺腺癌组织中,Cripto-1阳性表达9例,阴性表达10例。Activin-A蛋白及Cripto-1蛋白在肺腺癌中的表达呈负相关性(r=-0.418,P<0.05)。
3 讨 论
不同类型肺腺癌之间预后存在显著差异,其中原位腺癌、微浸润性腺癌预后好,浸润性腺癌中贴壁型、乳头型及腺泡型预后相对较好,而实体型和微乳头型预后较差〔2,3〕。研究〔4〕表明,恶性肿瘤的发生与细胞周期紊乱及增殖分化失调密切相关,而肿瘤的早期阶段主要为细胞过度增生,继而细胞增生调节机制紊乱,最终导致肿瘤发生。人们认识到癌基因与抑癌基因的调节功能失衡是肿瘤发生、发展的重要因素。寻找癌基因、对相关癌基因的早期检测及针对相关癌基因的分子靶向治疗在肿瘤患者的治疗中其作用越来越显著,并且许多癌基因靶向分子已经在多种不同的肿瘤中被鉴定〔5,6〕,癌基因靶向分子也成为近些年来医学界研究的热点。
Cripto-1基因蛋白具有癌基因特性,它在多数恶性肿瘤中的表达阳性率大约从40%~80%不等,但对于肺腺癌中的表达却鲜有报导。本研究显示,肺腺癌组织中Cripto-1蛋白的高表达与肺腺癌的发生密切相关。而且Cripto-1蛋白在肺腺癌的发展、侵袭和转移过程中发挥着非常重要的作用,Cripto-1蛋白的高表达也预示着肺腺癌的高恶性程度,预后不良。
Activin-A的信号通过ActivinⅠ型受体(Alk4)和ActivinⅡ型受体(ActRⅡ/ⅡB)来传递〔7〕。Activin-A是一种复杂的具有多种生物功能的激素,在人体多种正常组织细胞中表达,它的功能包括调节细胞的生长发育、生殖、分化、参与机体炎症反应、损伤修复甚至参与调节肿瘤细胞生长和凋亡的过程〔8〕,因此被认为是一种抑癌基因。激活素信号转导通路的紊乱则可使细胞逃避由此介导的生长抑制作用,从而导致肿瘤的发生。在以往的多项研究中发现,Activin-A可抑制多种肿瘤细胞系的生长,但对于Activin-A与肺腺癌的相关性研究国内外资料却罕有报道。本研究显示出在肺腺癌组织中Activin-A蛋白的低表达与肺腺癌的发生密切相关,Activin-A蛋白的高表达预示着肿瘤的预后较好,因此在肿瘤的发生上Activin-A扮演着抑癌基因的作用。另外提示Activin-A蛋白的低表达在肺腺癌的发展和转移中同样起着非常重要的作用,是肺腺癌预后不良的标志。本研究还提示这二者在肺腺癌的发生、发展中起着相互抑制的作用,相关研究表明,Cripto-1的促癌基因作用是通过调节Actvin信号转导通路来实现的。Cripto-1蛋白的过表达可阻碍细胞内Activin-A 信号的转导,Cripto-1可直接与Alk4结合,抑制Actvin-A与Alk4结合,在肿瘤细胞中,Activin的信号阻断是由于形成了Cripto-1、Activin及 ActivinⅡ型受体(ActRⅡ)复合物〔9〕,继而阻断了Activin抑制肿瘤细胞增殖的作用。此外,Cripto-1与Actvin-AB可直接结合从而达到阻断Actvin-A抑制肿瘤细胞生长的作用。用Cripto-1的抗体抑制剂与ActvinA结合可明显抑制肿瘤细胞的生长,其抑制率可达到70%〔10〕,这为进一步研究肿瘤细胞的靶向治疗提供了指导方向。针对Cripto-1研究最多的肿瘤生物靶向治疗有:Cripto-1的反义寡核苷酸研究、RNA干扰技术及肿瘤单克隆抗体研究等。其中反义寡核苷酸研究在动物模型中发现不仅能有效抑制多种肿瘤细胞株生长,还能降低肿瘤组织内微血管的密度。RNA干扰技术是近年来研究出的较反义寡核苷酸技术更有望应用于临床治疗的方法。目前国外研究最多的是针对Cripto-1分子结构的两个重要CFC和EGF研制出的单克隆抗体。针对Activin-A和Cripto-1信号转导通路的Cripto-1/ActRⅡ阻断剂是最新研究的潜在的肿瘤靶向治疗新方法,代表药物阿兰内酯通过阻断Cripto-1与ActivinⅡ型受体结合,阻断Cripto-1信号的传导来发挥抗肿瘤作用,相关资料显示出该药物在体外培养的人结肠腺癌细胞中显示出特异性抗肿瘤增殖的功能,而对正常细胞几乎没有毒性〔9〕。此外,直接应用Activin-A治疗在一些肿瘤中能够起到促进肿瘤肌肉组织萎缩的作用,在小鼠体内进行Activin-A全身治疗可起到促进肿瘤组织肌肉萎缩和细胞凋亡的效果〔11〕。上述研究虽然因为多种局限性暂不能应用于人体内研究,但为今后的临床肿瘤靶向生物治疗指出了新的方向。
4 参考文献
1Travis WD,Brambilla E,Noguchi M,etal.International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary of lung adenocarcinoma〔J〕.J Thorac Oncol,2011;6(2):244-85.
2Yoshizawa A,Motoi N,Riely GJ,etal.Impact of proposed LASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stageⅠcase〔J〕.Mod Pathol,2011;24(5):653-64.
3Russell PA,Wainer Z, Wright GM,etal.Does lung adenocarcinoma subtype predict patient survival: a clinicopathologic study based on the new international association for the study of lung Cancer/American Thoracic Society/ European Respiratory Society International Multidisciplinary lung Adenocarcinoma Classification〔J〕.J Thorac Oncol,2011;6(9):1496-504.
4刘庆亮,牟晓燕,张 敏,等. EGFR-TKI联合Cox-2抑制剂抑制肺腺癌A549细胞的增殖及其机制〔J〕.中国肿瘤生物治疗杂志,2012;19(4):442-6.
5Guo JX, Tao QS, Lou PR,etal.miR-181b as a potential molecular target for anticancer therapy of gastric neoplasms〔J〕.Asian Pac J Cancer Prev,2012;13(5):2263-7.
6Xia J, Chen C, Chen Z,etal. Targeting pancreatic cancer stem cells for cancer therapy〔J〕.Biochim Biophys Acta,2012;1826(2):385-99.
7Gray PC, Harrison CA, Vale W.Cripto forms a complex with activin and typeⅡ activin receptors and can block activin signaling〔J〕.Proc Natl Acad Sci USA,2003;100(9):5193-8.
8Gold E,Marino FE,Harrison C,etal.Activin-β(C) reduces reproductive tumour progression and abolishes cancer-associated cachexia in inhibin-deficient mice〔J〕.J Pathol,2013;229(4):599-607.
9Shi Y,Bao YL,Wu Y,etal.Alantolactone inhibits cell proliferation by interrupting the interaction between Cripto-1 and activin receptor typeⅡA in activin signaling pathway〔J〕.J Biomol Screen,2011;16(5):525-35.
10Hu XF, Xing PX.Cripto monoclonal antibodies〔J〕.Drug News Perspect,2005;18(5):293-303.
11Thissen JP,Loumaye A.Role of Activin A and Myostatin in cancer cachexia〔J〕.Ann Endocrinol(Paris),2013;74(2):79-81.
