乙酸染色结合窄带成像内镜对早期结直肠癌和癌前病变的诊断价值*
2014-09-11黄惠泉王富文华国安
王 蓉 黄惠泉 王富文 姜 新 朱 军 华国安
上海市浦东新区光明中医医院消化内科(201300)
近年全球结直肠癌发病率以每年2%的速度上升,我国高达每年4.2%[1]。如何发现早期结直肠癌和癌前病变,已成为结直肠癌研究的重点课题。本研究通过采用内镜下乙酸染色结合窄带成像(NBI)内镜,利用乙酸喷洒后能迅速凸显黏膜表面腺管形态、有效去除黏膜表面黏液等特点,为NBI观察微血管形态提供更清晰的形态结构,再结合黏膜变白至恢复正常的时间和靶向活检,旨在对结直肠可疑病灶进行观察,从而为结直肠癌和癌前病变的筛查和治疗提供一种方法。
对象与方法
一、研究对象
收集2011年11月-2013年7月上海市浦东新区光明中医医院接受结肠镜检查的1 636例患者,检出180例早期结直肠癌和癌前病变的患者(包括隆起型、平坦型病灶),诊断符合“中国早期大肠癌内镜诊治共识意见”[2]和“中国大肠肿瘤筛查、早诊早治和综合预防共识意见”[3]。排除标准:①肠道准备差影响观察者;②家族性腺瘤性息肉病;③炎症性肠病;④已知的结直肠癌;⑤不能耐受结肠镜检查、对染色剂过敏等的患者。本研究方案经浦东新区光明中医医院伦理委员会审核批准,所有患者检查前均签署知情同意书。
二、研究方法
1. 主要试剂、仪器:本组患者检查所用内镜主机为Olympus CF-H260AI,冷光源型号为CLV-260SL,监视器型号为SONY LMD-2140MD,高清显示器分辨率1 026×768(北京天助盈通技术有限公司),2%的乙酸(上海宝鼎酿造有限公司,以蒸馏水稀释),0.4%的靛胭脂溶液(南京微创医学科技有限公司)。
2. 检查方法:本研究为前瞻性、按检查方法分组的平行对照临床试验。将复方聚乙二醇电解质散溶于2 000 mL水,患者接受结肠镜前口服并继续饮水1 000 mL行肠道清洁准备。常规进镜至回盲部,对可疑早期结直肠癌和癌前病变的病灶按以下顺序进行观察:①NBI组:进镜时发现可疑病灶,用清水冲洗病变表面,切换到NBI模式观察内镜图像清晰度、腺管形态和微血管形态;②乙酸染色结合NBI组(联合组):病灶表面和邻近区域局部喷洒2%的乙酸10~20 mL,突出黏膜表面结构,并观察内镜图像清晰度、黏膜变白至恢复正常的时间、腺管形态,黏膜表面完全白化后,切换到NBI模式观察微血管形态;③靛胭脂组:退镜时即待黏膜白化恢复正常后,病灶再次用清水冲洗,将0.4%的靛胭脂溶液5 mL喷洒于病灶和邻近区域,30 s后观察内镜图像清晰度、腺管形态。为避免三种检查方法之间的互相干扰,严格按操作步骤,靛胭脂染色在退镜时进行,即待黏膜白化完全恢复正常后行靛胭脂染色。同时于病灶处靶向取活检、内镜下切除或外科手术后标本送病理,由病理科经验丰富的医师根据世界卫生组织诊断标准[4],作出病理诊断。比较内镜诊断和病理诊断的一致性,分析不同检查方法对结直肠癌和癌前病变的诊断价值。
3. 评价标准:腺管形态、微血管形态、黏膜白化时间任一指标提示癌或癌前病变者判断为癌或癌前病变。由两位高年资内镜医师对内镜图像清晰度进行评分,1分,不清楚;2分,模糊可见;3分,较清晰;4分,非常清晰。病变黏膜表面腺管形态按Kudo’s分型法[5]分为5型:Ⅰ 型为规则圆形小窝,为正常黏膜;Ⅱ型为星状、乳头状小窝,为炎性或增生性病灶;ⅢL型为大管状或大圆盘形小窝,为管状腺瘤;ⅢS型为小管状或小圆盘形小窝,多为腺瘤和早期癌;Ⅳ型为树枝状或脑回状,为绒毛状腺瘤;ⅤI型:极不规则小窝,多为早期癌;ⅤN型为小窝缺如呈无结构型,多为浸润性癌。微血管形态按佐野分型法[6]分为3型:Ⅰ 型:黏膜表面结构为规整的蜂巢样,血管网不可见,为增生性息肉;Ⅱ 型:黏膜表面结构蜂巢样圆形,周围规整的血管网,血管管径均匀,多为腺瘤性病灶,病变来自黏膜层;Ⅲ 型:围绕腺管开口周围的血管不规整分支中断,血管粗细不均,Ⅲ 型分为ⅢA型和ⅢB型[3],ⅢA病理类型多为腺瘤,病变浸润至黏膜下浅层,ⅢB病理类型多为癌,病变浸润至黏膜下深层。根据乙酸喷洒后黏膜变白至恢复正常的时间,将黏膜白化时间分为[7]:>60 s,黏膜持续发白;31~60 s,白色延迟消退;6~30 s,白色早期消失;0~5 s,无反应;肿瘤周边的黏膜和轻度腺瘤为持续发白,腺瘤和非浸润性癌为白色早期消失,黏膜下癌和浸润性癌均为无反应。病理活检结果分为炎症、增生性、管状腺瘤、绒毛状腺瘤、早期癌和浸润性癌,腺瘤可伴低级别上皮内瘤变(LGIN)(包括轻度、中度异型增生)或伴高级别上皮内瘤变(HGIN)(重度异型增生),早期癌指局限于黏膜层或黏膜下浅层(距黏膜肌层<1 000 μm, SM1)的病变,浸润性癌指浸润至黏膜下层SM2及以下的病变[4,8]。
三、统计学分析
采用SPSS 18.0统计软件,计数资料用频数和百分率表示,组间比较用χ2检验。对检查方法的敏感性、特异性、准确率行四格表的诊断试验分析等方法。观察者间一致性评价行κ检验。P<0.05为差异有统计学意义。
结 果
一、 一般资料
本组180例结直肠癌患者中,男111例,女69例;年龄26~95岁,平均60.1岁。共检出236例病灶,非肿瘤性病灶85例,其中炎性息肉39例,增生性息肉46例。肿瘤性病灶151例,其中腺瘤性息肉135例,包括管状腺瘤(图1)91例、绒毛状或管状绒毛状腺瘤44例,腺瘤性息肉伴LGIN(图2)107例、伴HGIN 28例;早期癌(图3)5例;浸润性癌(图4)11例。
二、内镜图像清晰度的比较
联合组腺管形态的内镜图像清晰度明显优于NBI组、靛胭脂组(χ2=15.113,P=0.000;χ2=6.128,P=0.013);联合组微血管形态的内镜图像清晰度亦明显优于NBI组(χ2=7.384,P=0.007)(表1)。

表1 三组内镜图像清晰度的比较(n)
三、三组腺管形态、微血管形态和黏膜白化时间与组织病理学结果符合的关系
联合组、NBI组、靛胭脂组对结直肠癌和癌前病变的诊断总符合率分别为91.9%(217/236)、89.0%(210/236)、86.9%(205/236),联合组的诊断总符合率与NBI组、靛胭脂组相比差异均无统计学意义(χ2=1.204,P=0.273;χ2=3.221,P=0.073)。联合组腺管形态的诊断符合率明显优于NBI组(χ2=4.490,P=0.034),与靛胭脂组无明显差异(χ2=2.161,P=0.142),NBI组与靛胭脂组亦无明显差异(χ2=0.435,P=0.510)。联合组微血管形态的诊断符合率与NBI组无明显差异(χ2=0.591,P=0.442)。
联合组、NBI组、靛胭脂组Ⅲ、Ⅳ、Ⅴ型腺管形态诊断结直肠癌(早癌和浸润性癌)和癌前病变(结直肠腺瘤)的敏感性分别为94.0%、90.8%、90.0%,特异性分别为87.4%、75.8%、81.4%,准确率分别为91.5%、84.8%、86.9%,阳性预测值分别为 92.7%、84.8%、89.4%,阴性预测值分别为 89.4%、87.1%、82.4%;联合组和NBI组Ⅱ型、Ⅲ型微血管形态诊断结直肠癌和癌前病变的敏感性分别为 92.8%、92.5%,特异性分别为88.1%、83.2%,准确率分别为91.1%、89.0%,阳性预测值分别为93.4%、90.1%,阴性预测值分别为87.1%、87.1%;联合组黏膜白化时间<30 s诊断结直肠癌和癌前病变的敏感性为92.2%,特异性为88.0%,准确率为 90.7%,阳性预测值为93.4%,阴性预测值为 85.9%(表2)。
四、联合组腺管形态、微血管形态和黏膜白化时间对浸润深度的诊断
联合组ⅤN型或高度不规则ⅤI型腺管形态诊断浸润性癌的敏感性、特异性、准确率、阳性预测值、阴性预测值分别为71.4%、96.7%、88.6%、90.9%、87.9%;ⅢB型微血管形态诊断浸润性癌的敏感性、特异性、准确率、阳性预测值、阴性预测值分别为66.7%、96.6%、86.3%、90.9%、84.9%;而黏膜白化时间0~5 s诊断浸润性癌的敏感性、特异性、准确率、阳性预测值、阴性预测值分别为 66.7%、96.6%、86.3%、90.9%、84.9%(表3)。
五、观察者间的一致性
观察者间一致性评价的平均κ值0.792,一致性评价强度为较好。
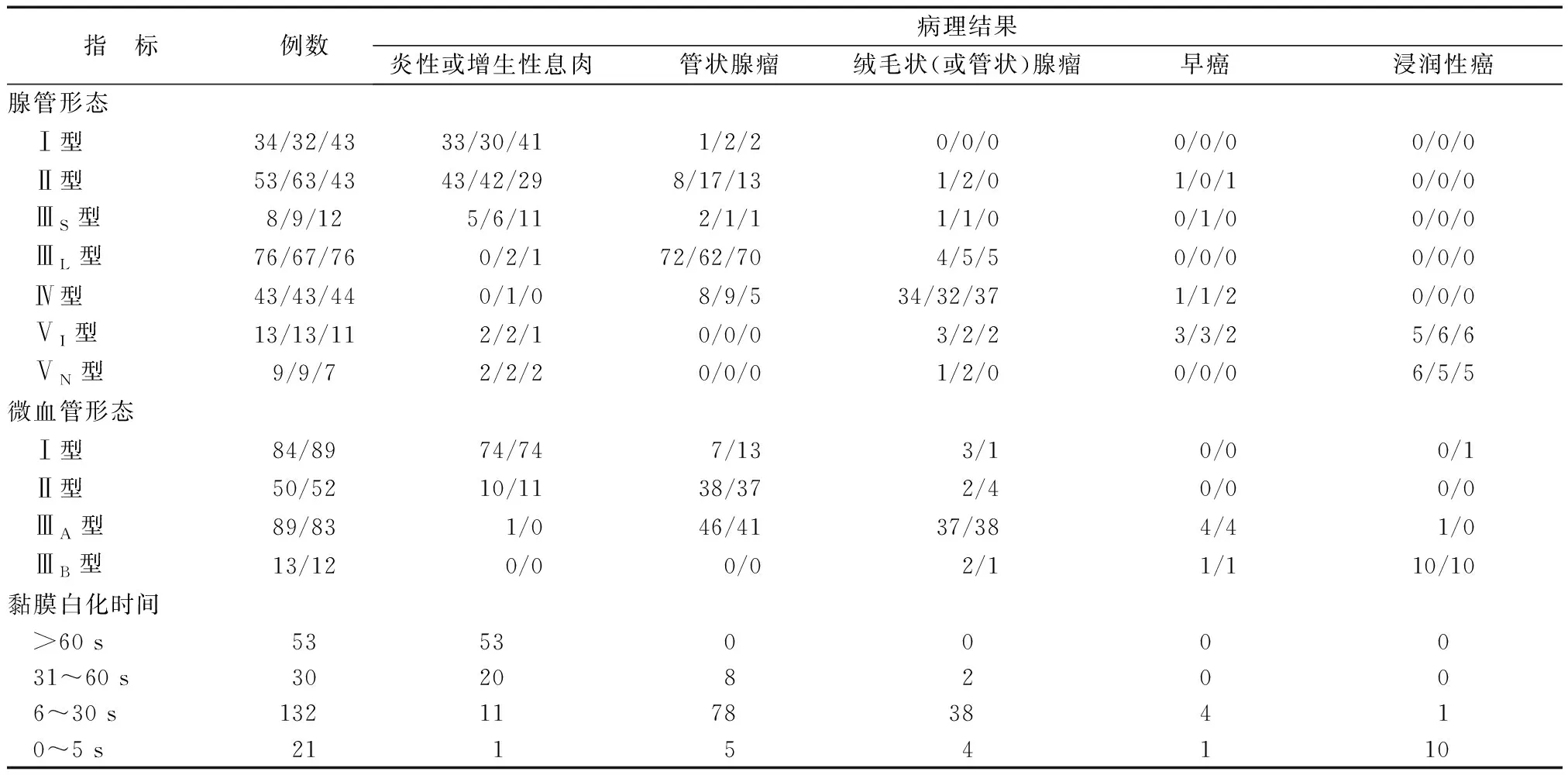
表2 三组腺管形态、微血管形态和黏膜白化时间与组织病理学结果的符合关系

A:普通白光;B:NBI观察;C:乙酸染色;D:联合组;E:靛胭脂染色;F:HE染色(×10)

A:普通白光;B:NBI观察;C:乙酸染色;D:联合组;E:靛胭脂染色;F:HE染色(×10)

A:普通白光;B:NBI观察;C:乙酸染色;D:联合组;E:靛胭脂染色;F:HE染色(×10)

表3 乙酸染色后NBI内镜下腺管形态、微血管形态和黏膜白化时间对浸润性和非浸润性癌的预测(n)
讨 论
结直肠腺瘤是主要的结直肠癌癌前病变。早期结直肠癌(M、SM1)和结直肠腺瘤均可在内镜下治疗。黏膜下深层浸润性癌(SM2以下)存在淋巴结转移风险,不能内镜下治疗,但病变经活检后可能造成能内镜下治疗的病灶黏膜与黏膜下层发生粘连,为下一步内镜治疗带来困难,故依据内镜下形态判断病变性质成为临床需要[9-10]。
早期结直肠癌、结直肠腺瘤与炎性、增生性病灶的黏膜表面腺管形态和微血管形态明显不同,目前常采用色素内镜、NBI、放大内镜等观察腺管形态和微血管形态。0.4%的靛胭脂为色素内镜常用的染色剂,利用靛胭脂可沉积于腺管开口内,使腺管开口隐窝着色,清楚显示腺管开口形态和大小,且靛胭脂易于用水冲洗,可反复染色。本研究结果显示靛胭脂染色对结直肠癌和癌前病变的诊断总符合率为86.9%。但靛胭脂易受黏膜表面黏液的影响,可出现染色不均,且染色可使清晰的微血管形态变得模糊;此外靛胭脂有毒性,价格亦不便宜,尚未能在中小型医院普及。NBI是电子染色内镜,已成为目前诊断结直肠癌和癌前病变的主要手段之一[11-13]。NBI具有下列特点:①操作简单、方便,无需染色,通过简单的按钮即可完成普通内镜与NBI之间的转换,并可对病变反复观察;②可避免因染色剂不均而导致对病变的错误判断;③避免染色剂的毒副作用;④显示微血管形态更有优势[14]。本研究NBI对结直肠癌和癌前病变的诊断总符合率较高,为89.0%。
乙酸喷洒黏膜表面后,可破坏黏液层中糖蛋白的二硫键,使糖蛋白的四聚体结构解聚,导致黏液变稀,易被洗去,起清洁黏膜表面的作用。乙酸还可产生黏膜白化效应:①细胞内结构的改变:乙酸喷洒后增加了上皮细胞表面不反光物质,并掩盖了上皮下血管网,从而出现短暂的“白化效应”,突出黏膜表面形态结构;②细胞间结构的影响:腺体或隐窝开口是乙酸渗入通道之一,增加了细胞暴露于乙酸的表面积,使有腺体的黏膜总体变厚、发白,小凹形态清楚显示,可观察到清晰的腺管形态[15-16]。乙酸染色后可能会引起微血管损失,故需等待1 min待黏膜白化恢复正常再用NBI观察,可取得较好的效果。本研究中,乙酸喷洒黏膜表面后NBI下可见清晰的腺管形态和微血管形态,其内镜图像清晰度明显优于NBI和(或)靛胭脂染色。由此可见,应用乙酸喷洒结合NBI内镜,可取长补短,发挥两种方法的优势。
本研究结果显示,乙酸染色结合NBI的图像清晰度明显优于靛胭脂和单一NBI;诊断的总符合率与单一NBI和靛胭脂染色无明显差异;对腺管形态的观察优于单一NBI,与靛胭脂无明显差异;对微血管形态的观察与单一NBI均无明显差异。若腺管形态为Ⅰ、Ⅱ型,微血管形态为Ⅰ型,黏膜白化时间>1 min,病灶多为炎性或增生性病灶,可内镜随访或内镜下治疗(右侧结肠的增生性息肉亦需行摘除治疗);若腺管形态为Ⅲ、Ⅳ型、微血管形态为Ⅱ型、ⅢA型、黏膜白化时间为31~60 s,病灶多为腺瘤,行内镜下摘除;若腺管形态为轻度不规则ⅤI型、微血管形态为ⅢA型、黏膜白化时间为6~30 s,则有一定的早癌倾向,应尽早行ESD或EMR治疗;若腺管形态为ⅤN型或高度不规则ⅤI型、微血管形态为ⅢB型、黏膜白化时间为0~5 s,病灶多为浸润性癌,需行外科手术治疗。
综上所述,乙酸染色结合NBI能清晰显示早期结直肠癌和癌前病变的腺管形态和微血管形态,且与病理诊断具有较好的一致性,可判断其可能的病理类型和是否伴有浸润。乙酸价格低廉,NBI内镜检查方便,避免了染色剂对人体的危害,两者结合,效果优于单一NBI和靛胭脂染色,大大提高了早期结直肠癌和癌前病变的诊断率,值得临床推广使用。但目前对乙酸染色后黏膜表面形态的认识仍不足并缺乏诊断标准,今后仍需深入、大规模、多中心研究进一步明确。本课题组今后将尝试使用2011年Hewett等提出的更简便、易行的非放大内镜下NBI观察的国际结直肠NICE分型系统。
1 Chen WQ, Zheng RS, Zhang SW, et al. Report of incidence and mortality in china cancer registries, 2008[J]. Chin J Cancer Res, 2012, 24 (3): 171-180.
2 中华医学会消化内镜学分会肠道学组. 中国早期大肠癌内镜诊治共识意见[J]. 中华消化内镜杂志, 2008, 25 (12): 617-620.
3 房静远, 郑树, 姜泊, 等. 中国大肠肿瘤筛查、早诊早治和综合预防共识意见[J]. 胃肠病学和肝病学杂志, 2011, 20 (11): 979-995.
4 Bosman FT, Carneiro F, Hruban RH, et al. World Health Organization classificat ion of tumours of the digestive system[M]. 4th ed. Lyon: IARC Press, 2010: 1-155.
5 Kudo S, Tamura S, Nakajima T, et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy[J]. Gastrointest Endosc, 1996, 44 (1): 8-14.
6 Sano Y, Horimatsu T, Fu KI, et al. Magnifying observation of micro-vascular architecture of colorectal lesions using narrow band imaging system[J]. Dig Endosc, 2006, 18 (suppl 1): S44-S51.
7 Yagi K, Aruga Y, Nakamura A, et al. The study of dynamic chemical magnifying endoscopy in gastric neoplasia[J]. Gastrointest Endosc, 2005, 62 (6): 963-969.
8 Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited[J]. Gut, 2002, 51 (1): 130-131.
9 Strul H, Kariv R, Leshno M, et al. The prevalence rate and anatomic location of colorectal adenoma and cancer detected by colonoscopy in average-risk individuals aged 40-80 years[J]. Am J Gastroenterol, 2006, 101 (2): 255-262.
10 Lieberman DA, Prindiville S, Weiss DG, et al. Risk factors for advanced colonic neoplasia and hyperplastic polyps in asymptomatic individuals[J]. JAMA, 2003, 290 (22): 2959-2967.
11 Machida H, Sano Y, Hamamoto Y, et al. Narrow-band imaging in the diagnosis of colorectal mucosal lesions: a pilot study[J]. Endoscopy, 2004, 36 (12): 1094-1098.
12 Sakamoto T, Saito Y, Nakajima T, et al. Comparison of magnifying chromoendoscopy and narrow-band imaging in estimation of early colorectal cancer invasion depth: a pilot study[J]. Dig Endosc, 2011, 23 (2): 118-123.
13 姜泊, 龚伟. 如何提高早期大肠癌及癌前病变内镜诊断率[J]. 广东医学, 2011, 32 (1): 1-5.
14 Wada Y, Kudo SE, Misawa M, et al. Vascular pattern classification of colorectal lesions with narrow band imaging magnifying endoscopy[J]. Dig Endosc, 2011, 23 (Suppl 1): 106-111.
15 Lambert R, Rey JF, Sankaranarayanan R. Magnification and chromoscopy with the acetic acid test[J]. Endoscopy, 2003, 35 (5): 437-445.
16 Kawamura YJ, Togashi K, Saski J, et al. Acetic acid spray in colonoscopy: an alternative to chromoendoscopy[J]. Gut, 2005, 54 (2): 313.
