百里醌抑制人胰腺癌BxPC-3细胞体外运动和侵袭的研究*
2014-09-11慕刚刚于红刚李红艳
慕刚刚 于红刚 李红艳 李 维
武汉大学人民医院消化内科1(430060) 兰州大学第二医院综合内科2
胰腺癌是极度恶性的消化道肿瘤,位居癌症死亡原因的第四位,过去10年间胰腺癌发病率逐年上升,全世界每年约227 000例患者死于胰腺癌,其5年生存率不足5%[1-2]。胰腺癌早期诊断困难,确诊时多已发生局部浸润或远处转移,丧失了早期手术切除的机会[3]。胰腺癌的高转移率归因于胰腺癌细胞的强运动、侵袭能力,目前吉西他滨等一线化疗药物对抑制胰腺癌的转移效果欠佳,且多有化疗耐药性产生。研发有效抑制胰腺癌细胞黏附、侵袭运动、远处转移的辅助化疗方式已成为目前胰腺癌研究的重点。
在众多新型化疗药物的研究中,天然形式的百里醌(thymoquinone)受到越来越多的关注,1963年人们首次从黑种草(Nigella sativa)草籽中提取出具有多种生物活性的百里醌,其能有效抗氧化、抗炎症,对糖尿病、动脉粥样硬化有较好的疗效[4]。百里醌还能有效抑制多种人肿瘤细胞增殖、运动、迁移以及肿瘤新生血管生成等肿瘤生物学特性[5]。大量体内外实验表明百里醌能抑制结直肠癌、前列腺癌、乳腺癌、卵巢癌等多种恶性肿瘤的生长和转移[6-8]。对人正常前列腺上皮细胞、小肠细胞、胰腺导管上皮细胞作用的研究表明百里醌对正常细胞无毒性损害作用[7,9-10]。本研究通过探讨百里醌对人胰腺癌细胞体外运动、侵袭的作用及其可能的调控机制,旨在为百里醌能运用于胰腺癌的临床辅助化疗提供有效依据。
材料与方法
一、实验材料
胎牛血清、RPMI-1640、青霉素-链霉素抗菌药物购自美国Hyclone公司。Boyden小室购自美国Corning公司;MatrigelTM基质胶购自美国BD Biosciences公司。兔抗β-actin、FAK、磷酸化Akt(Ser 473)抗体、小鼠抗Akt抗体、羊抗兔IgG (H+L)、F(ab’)2Fragment(Alexa Fluor®555 Conjugate)荧光二抗购自美国Cell Signaling Technology, Inc,纤维状肌动蛋白(F-actin)标记的抗体Acti-stainTM488 Fluorescent Phalloidin购自Cytoskeleton,Inc.;HRP标记的山羊抗兔二抗均购自美国Santa Cruz公司;细胞核染色液4’,6 - 二脒-2’-苯基吲哚二盐酸盐(4’, 6-Diamidino-2’-phenylindole dihydrochloride, DAPI)购自Roche公司;百里醌购自美国Sigma公司。
二、实验方法
1. 细胞培养:人胰腺癌细胞株BxPC-3购自中国科学院典型培养物保藏委员会细胞库。BxPC-3细胞培养于含10%胎牛血清的RPMI-1640培养基中,37 ℃、5% CO2、适合湿度培养箱中培养,细胞贴壁生长至约70%~80%密度时经胰酶消化传代培养。
2. 侵袭实验:将MatrigelTM基质胶4 ℃过夜溶解。经稀释的MatrigelTM基质胶40 μL/室包被Boyden小室内室底膜,4 ℃过夜,使用前加200 μL RPMI-1640于37 ℃水化30 min。取对数生长期的BxPC-3细胞,用含0.1% BSA的RPMI-1640培养液制备单细胞悬液1×106个/mL,取200 μL细胞悬液加入Boyden小室的内室(孔径8 μm),其中包含不同浓度的百里醌(0、10、25 μmol/L),下室加入含10%胎牛血清的RPMI-1640培养液600 μL,37 ℃、5% CO2培养16 h。培养结束后,用棉球小心拭去内室培养液和细胞,将内室用4%多聚甲醛溶液固定15 min,Giemsa染色10 min,置于倒置显微镜下观察。每个小室高倍镜下(×200)随机选取5个视野,计数各组穿透细胞数。细胞侵袭率(%)=(对照组平均穿透细胞数-实验组平均穿透细胞数)/对照组平均穿透细胞数×100%。
3. 运动实验:基本步骤与侵袭实验相同,仅Boyden小室内室不包被MatrigelTM基质胶。
4. 蛋白质印迹法:选择对数生长期的BxPC-3细胞,按1×105个细胞/孔接种至6孔板,待贴壁生长至70%~80%密度,分别给予0、10、25、50 μmol/L百里醌处理24 h。培养终止后,PBS洗涤2遍,加入细胞裂解液充分裂解并离心提取总蛋白。BCA法测定总蛋白浓度,取40 μg总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转移蛋白至硝酸纤维素膜,5%脱脂奶粉/10% BSA溶液封闭非特异性位点。加入FAK、磷酸化Akt、Akt一抗(工作浓度均为1∶1 000)4 ℃孵育过夜;TBST洗涤,加入HRP标记的二抗室温孵育1 h;漂洗后经ECL法显色,X线胶片曝光。以β-actin蛋白为内参照,实验独立重复3次。
5. 免疫荧光:收集对数生长期BxPC-3细胞,制备单细胞悬液并调整细胞浓度为2×104~3×104个/mL,接种于无菌盖玻片。加入0、25 μmol/L百里醌培养12 h。PBS洗涤3遍,用预热的4%多聚甲醛溶液固定15 min,0.3% Triton-X 100/PBS溶液穿透15 min,5% BSA/PBS+山羊非免疫血清溶液封闭1 h去除非特异性结合;加入1∶100稀释的兔抗FAK一抗溶液,4 ℃湿盒孵育过夜;PBS洗涤3遍后加入1∶1 000稀释的羊抗兔IgG(H+L)、F(ab’)2Fragment(Alexa Fluor®555 Conjugate)荧光二抗和1∶200稀释的Acti-stainTM488 Fluorescent Phalloidin抗体,室温湿盒孵育60 min;0.1 μg/mL DAPI染核 1 min,充分洗涤后用抗荧光淬灭剂封片;Olympus荧光显微镜下观察。
三、统计学分析
结 果
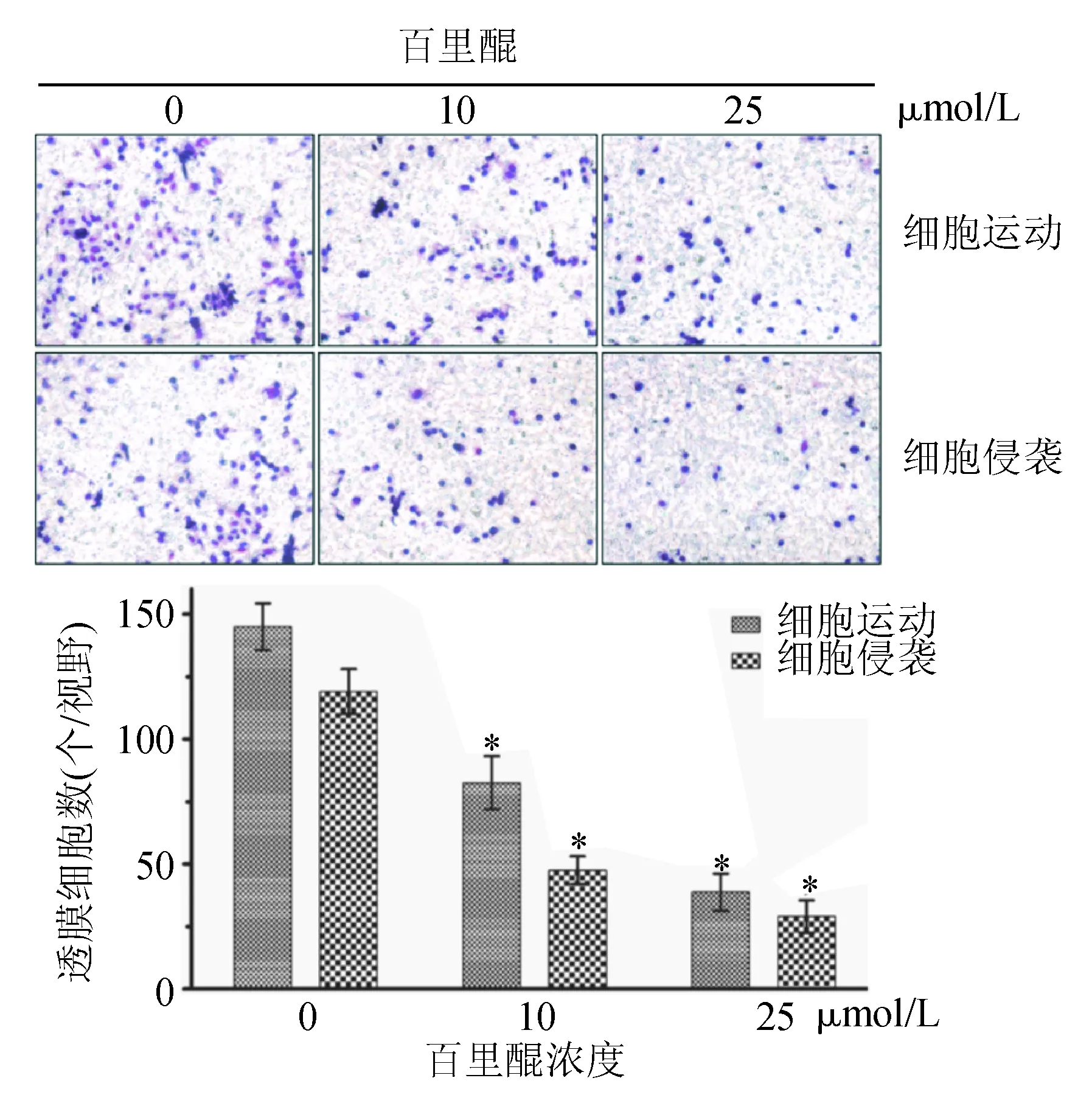
一、百里醌对胰腺癌BxPC-3细胞运动能力的影响
空白对照组、10 μmol/L、25 μmol/L百里醌组穿过微孔膜的细胞数分别为145±9、82±10、38±7,与空白对照组相比,10、25 μmol/L百里醌组细胞迁移运动透膜数显著减少(P<0.05),且25 μmol/L组细胞迁移数又明显少于10 μmol/L组(P<0.05)(图1)。两组百里醌组的细胞运动抑制率分别为43.4%、73.8%,差异有统计学意义(P<0.05)。说明百里醌能呈浓度依赖性地抑制人胰腺癌BxPC-3细胞的体外运动。
二、百里醌对胰腺癌BxPC-3细胞侵袭能力的影响
空白对照组、10 μmol/L、25 μmol/L百里醌组透膜细胞数分别为119±10、47±6、29±5,与空白对照组相比,10 μmol/L、25 μmol/L百里醌组BxPC-3细胞侵袭透膜数均显著减少(P<0.05),且25 μmol/L组细胞侵袭透膜数又明显少于10 μmol/L组(P<0.05)(图1)。两组百里醌组的侵袭抑制率分别为60.5%、75.6%,差异有统计学意义(P<0.05)。说明百里醌能呈浓度依赖性地抑制人胰腺癌BxPC-3细胞的体外侵袭。
三、百里醌对胰腺癌BxPC-3细胞FAK表达、 磷酸化Akt的影响
与空白对照组相比,10 μmol/L百里醌组BxPC-3细胞FAK表达、磷酸化Akt水平无明显差异,而25、50 μmol/L百里醌组能明显下调FAK、磷酸化Akt的表达,但25 μmol/L与50 μmol/L组间FAK、磷酸化Akt水平无明显差异;各组间总Akt蛋白表达无明显差异(图2)。说明百里醌能明显抑制BxPC-3细胞FAK表达和Akt Ser 473位点的磷酸化激活。
*与空白对照组比较,P<0.05

1 Da=0.992 1 u
四、百里醌对胰腺癌BxPC-3细胞FAK定位、黏着斑形成和F-actin集化的影响
25 μmol/L百里醌组BxPC-3细胞FAK表达明显减少,FAK标记的黏着斑面积明显缩小,弥散分布于胞质,胞膜和细胞边缘区聚集较少;F-actin多呈点状分布,无明显集化现象。而空白对照组细胞具有更强荧光标记的FAK表达,FAK表达量明显较多,且黏着斑面积较大,数目较多,多集中在细胞膜边缘区;F-actin多有集化,且与胞膜的黏着斑紧密相连,细胞骨架多向黏着斑分布密集区聚集(图3)。表明百里醌能明显抑制细胞黏着斑的形成,下调FAK表达,同时抑制F-actin集化的发生,进而降低细胞的黏附、侵袭和运动转移。
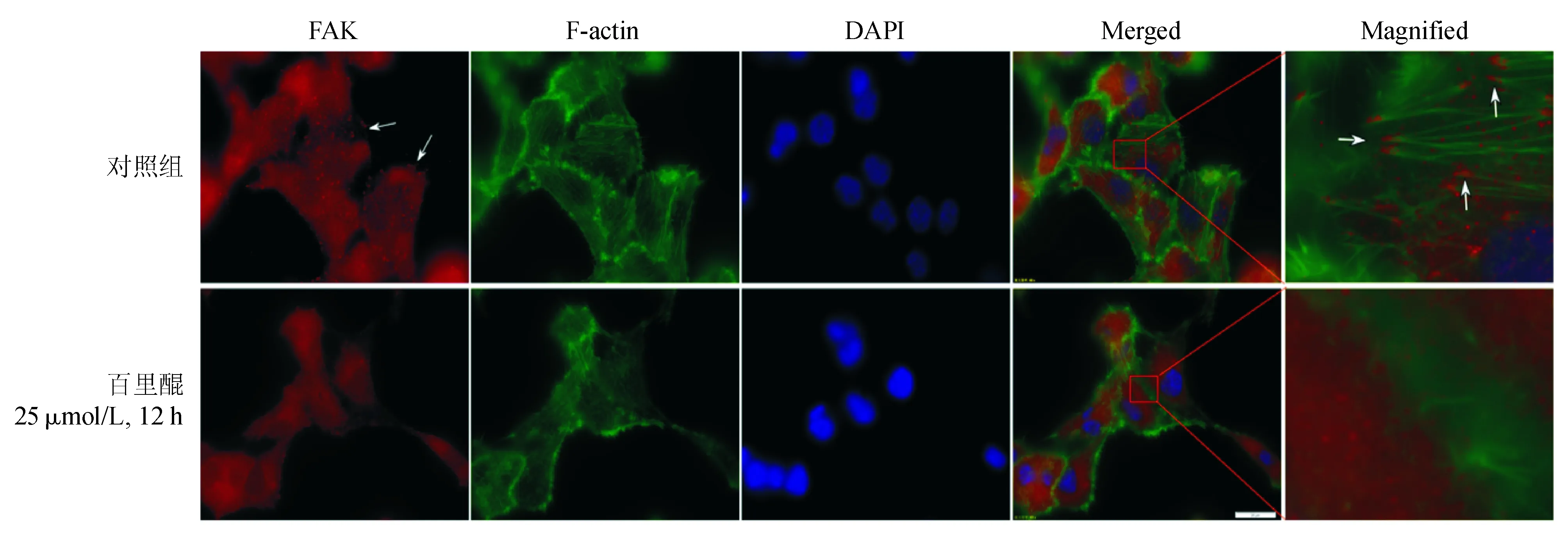
图3 百里醌对胰腺癌BxPC-3细胞FAK、黏着斑和F-actin的影响(箭头所示处为FAK定位)
讨 论
天然植物单体百里醌能有效抑制多种肿瘤细胞的增殖,诱导肿瘤细胞体内、体外的凋亡,包括乳腺癌、结直肠癌、前列腺癌等[5]。有研究[10]证实百里醌同样能有效抑制胰腺癌细胞增殖,促进细胞凋亡,但又不影响人正常胰腺导管上皮细胞的生长。进一步对百里醌影响肿瘤其他生物学行为的研究[11-13]发现,其能有效抑制肿瘤新生血管的生成、增加肿瘤细胞对化疗药物的敏感性、抑制肿瘤细胞迁移运动等。
胰腺癌的转移一个多步骤、多因素的过程,包括上皮细胞极性改变、肿瘤细胞间黏附改变、运动能力增强、癌细胞穿透基底膜、转移灶新生血管生成等一系列变化[5]。其中肿瘤细胞依赖黏着斑黏附到细胞外基质、破坏基底膜侵入血管或淋巴管是关键步骤,该过程需要肿瘤细胞的趋化性运动、侵入基底层的能力和单个细胞的迁移运动能力。癌细胞在迁移运动时,引导端形成大量突起,触发肌动蛋白的聚合集化和尾端的收缩协调,导致细胞通过肌动球蛋白张力纤维产生对抗黏附的牵引力,促进细胞向引导端迁移运动。癌细胞迁移运动还涉及多种黏附蛋白、激酶、细胞因子及其所参与的信号转导和调控,其中FAK是参与细胞黏着斑形成、翻转的关键激酶[14],同时也是诱导细胞骨架和引导端突起形成的关键信号调节蛋白。肿瘤细胞黏附时FAK发生活化,通过FAK-Src-Cas-Crk-Dock180/Ras、FAK-PI3K/Akt等多种信号通路的激活介导肿瘤细胞的极化、运动、侵袭,进而促进肿瘤的转移和恶化[15-16]。目前已知FAK在肿瘤细胞和肿瘤组织中明显高表达,与肿瘤侵袭、转移等生物学行为密切相关[17-19]。
Kolli-Bouhafs等[20]的研究发现百里醌通过抑制FAK的活化来抑制人恶性胶质瘤细胞的侵袭、转移,这与本研究发现百里醌能抑制胰腺癌BxPC-3细胞中FAK表达、阻断黏着斑的形成以及抑制F-actin聚合集化的结果相一致。FAK表达下调、活性降低依赖细胞内信号转导引发肿瘤侵袭、迁移相关的广泛信号调节蛋白的改变,如细胞外基质中基质金属蛋白酶(matrix metalloproteinase, MMP)-2、-9的活性下调、ERK或PI3K/Akt/NF-κB信号通路的抑制、F-actin的解聚等,这些级联反应直接或间接抑制了肿瘤细胞侵袭、迁移能力的降低。本研究中百里醌呈浓度依赖性地抑制胰腺癌BxPC-3细胞的体外运动、侵袭,且FAK表达下调,磷酸化Akt的激活受抑,说明百里醌可能是通过抑制FAK表达和Akt磷酸化水平来降低胰腺癌BxPC-3细胞的体外运动、侵袭能力。
综上所述,百里醌通过下调FAK的表达,抑制黏着斑的形成和引导端聚集,继而抑制Akt磷酸化水平,通过抑制FAK/PI3K/Akt通路,间接抑制人胰腺癌BxPC-3细胞的运动、侵袭和转移,但具体的调控机制还有待进一步研究。本研究也为百里醌未来应用于胰腺癌的辅助化疗提供了新的证据。
1 Vincent A, Herman J, Schulick R, et al. Pancreatic cancer[J]. Lancet, 2011, 378 (9791): 607-620.
2 Bosetti C, Bertuccio P, Negri E, et al. Pancreatic cancer: overview of descriptive epidemiology[J]. Mol Carcinog, 2012, 51 (1): 3-13.
3 He XY, Yuan YZ. Advances in pancreatic cancer research: Moving towards early detection[J]. World J Gastroenterol, 2014, 20 (32): 11241-11248.
4 Salem ML. Immunomodulatory and therapeutic properties of the Nigella sativa L. seed[J]. Int Immunopharmacol, 2005, 5 (13-14): 1749-1770.
5 Schneider-Stock R, Fakhoury IH, Zaki AM, et al. Thymoquinone: fifty years of success in the battle against cancer models[J]. Drug Discov Today, 2014, 19 (1): 18-30.
6 Gali-Muhtasib H, Diab-Assaf M, Boltze C, et al. Thymoquinone extracted from black seed triggers apoptotic cell death in human colorectal cancer cells via a p53-dependent mechanism[J]. Int J Oncol, 2004, 25 (4): 857-866.
7 Koka PS, Mondal D, Schultz M, et al. Studies on molecular mechanisms of growth inhibitory effects of thymoquinone against prostate cancer cells: role of reactive oxygen species[J]. Exp Biol Med (Maywood), 2010, 235 (6): 751-760.
8 Odeh F, Ismail SI, Abu-Dahab R, et al. Thymoquinone in liposomes: a study of loading efficiency and biological activity towards breast cancer[J]. Drug Deliv, 2012, 19 (8): 371-377.
9 El-Najjar N, Chatila M, Moukadem H, et al. Reactive oxygen species mediate thymoquinone-induced apoptosis and activate ERK and JNK signaling[J]. Apoptosis, 2010, 15 (2): 183-195.
10 Banerjee S, Kaseb AO, Wang Z, et al. Antitumor activity of gemcitabine and oxaliplatin is augmented by thymoquinone in pancreatic cancer[J]. Cancer Res, 2009, 69 (13): 5575-5583.
11 Peng L, Liu A, Shen Y, et al. Antitumor and anti-angiogenesis effects of thymoquinone on osteosarcoma through the NF-κB pathway[J]. Oncol Rep, 2013, 29 (2): 571-578.
12 Siveen KS, Mustafa N, Li F, et al. Thymoquinone overcomes chemoresistance and enhances the anticancer effects of bortezomib through abrogation of NF-κB regulated gene products in multiple myeloma xenograft mouse model[J]. Oncotarget, 2014, 5 (3): 634-648.
13 Ahmad I, Muneer KM, Tamimi IA, et al. Thymoquinone suppresses metastasis of melanoma cells by inhibition of NLRP3 inflammasome[J]. Toxicol Appl Pharmacol, 2013, 270 (1): 70-76.
14 Webb DJ, Donais K, Whitmore LA, et al. FAK-Src signalling through paxillin, ERK and MLCK regulates adhesion disassembly[J]. Nat Cell Biol, 2004, 6 (2): 154-161.
15 Lee YC, Cheng TH, Lee JS, et al. Nobiletin, a citrus flavonoid, suppresses invasion and migration involving FAK/PI3K/Akt and small GTPase signals in human gastric adenocarcinoma AGS cells[J]. Mol Cell Biochem, 2011, 347 (1-2): 103-115.
16 Hsia DA, Mitra SK, Hauck CR, et al. Differential regulation of cell motility and invasion by FAK[J]. J Cell Biol, 2003, 160 (5): 753-767.
17 Chatzizacharias NA, Giaginis C, Zizi-Serbetzoglou D, et al. Evaluation of the clinical significance of focal adhesion kinase and SRC expression in human pancreatic ductal adenocarcinoma[J]. Pancreas, 2010, 39 (6): 930-936.
18 Aust S, Auer K, Bachmayr-Heyda A, et al. Ambivalent role of pFAK-Y397 in serous ovarian cancer--a study of the OVCAD consortium[J]. Mol Cancer, 2014, 13: 67.
19 Crompton BD, Carlton AL, Thorner AR, et al. High-throughput tyrosine kinase activity profiling identifies FAK as a candidate therapeutic target in Ewing sarcoma[J]. Cancer Res, 2013, 73 (9): 2873-2883.
20 Kolli-Bouhafs K, Boukhari A, Abusnina A, et al. Thymoquinone reduces migration and invasion of human glioblastoma cells associated with FAK, MMP-2 and MMP-9 down-regulation[J]. Invest New Drugs, 2012, 30 (6): 2121-2131.
