LFA-1基因缺失对小鼠Naïve T细胞体外向Th17细胞分化的影响*
2014-09-11于成功
孙 淼 于成功
南京医科大学鼓楼临床医学院消化科1(210008) 南京医科大学附属鼓楼医院消化科2
大量实验研究表明Th17细胞是连接固有免疫与获得性免疫的桥梁,除清除入侵的病原微生物外,尚与自身免疫性疾病的发生、发展密切相关[1]。Th17细胞分泌的细胞因子白细胞介素-17A(IL-17A)、IL-6等可促进T细胞活化,刺激上皮细胞、成纤维细胞分泌多种细胞因子如趋化因子受体CCR6、IL-8以及细胞黏附分子-1(CAM-1)等,对中性粒细胞起动员、活化作用,进而诱导或加重炎症反应。随着对T细胞研究的不断深入,T细胞受体(TCR)及其共受体/配体系统与T细胞活化和功能的关系在作为自身免疫性疾病之一的炎症性肠病(IBD)中的意义引起关注。淋巴细胞功能相关抗原-1(lymphocyte function-associated antigen-1, LFA-1)是淋巴细胞活化的重要共刺激受体,参与T细胞的活化和功能调节,能增强抗原呈递细胞活性,维持抗炎与促炎因子平衡。LFA-1在调节性T细胞(Treg细胞)的稳态和功能发挥中的作用已得到认可[2],与Th17细胞分化和功能的关系则尚无定论。本实验旨在观察不同诱导条件下LFA-1基因缺失(LFA-1-/-)对小鼠脾脏初始T细胞(Naïve T细胞)体外向Th17细胞分化的影响,探讨LFA-1参与IBD的潜在机制。
材料与方法
一、实验动物和主要试剂、仪器
LFA-1-/-小鼠15只,为购自Jackson Laboratory的纯合子LFA-1-/-小鼠(Strain Name: B6.129S7-Itgaltm1Bll/J, Stock Number: 005257)在南京鼓楼医院动物实验中心SPF条件下繁殖的子代小鼠,均经基因型鉴定筛选。具有相同遗传背景的LFA-1+/+[野生型(WT)]C57BL/6J小鼠15只作为对照组。两组小鼠均为6~10周龄,雌鼠7只,雄鼠8只。
RPMI 1640培养基、FBS(Gibco®, Thermo Fisher Scientific Inc.),ReadyMixTMTaq PCR反应混合物(Sigma-Aldrich Co. LLC.),淋巴细胞分离液(深圳市达科为生物技术有限公司),CD4+CD62L+Naïve T细胞磁珠分选试剂盒、Mini & MidiMACSTM分选器、分选缓冲液(Miltenyi Biotec),CD4-FITC、CD62L-PE、IL-17A-PE荧光标记单克隆抗体和CD3、CD28单克隆抗体(eBioscience, Inc.),重组人转化生长因子-β(TGF-β)、重组小鼠IL-6和IL-23、小鼠IL-17A ELISA试剂盒(R&D Systems, Inc.),RNAiso Plus试剂、PrimeScriptTM逆转录试剂盒(Perfect Real Time)、SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)(Takara Bio Inc.)。
BD FACSCantoTM流式细胞仪(BD Biosciences),普通PCR仪、7500 Fast Real-Time PCR仪(Applied Biosystems®, Thermo Fisher Scientific Inc.)。
二、方法
1. PCR鉴定筛选LFA-1-/-子代小鼠:从Jackson Laboratory基因库中得到LFA-1 PCR引物序列:olMR0204: CAC GGG TAG CCA ACG CTA TGT C, olMR0221: GCC CTG AAT GAA CTG CAG G, olMR3637: AGA AGC CAC CAT TTC CCT CT, olMR3638: AGC TGG AGT CCC AGT AGC AA,由南京金斯瑞生物科技有限公司合成。随机选取15只子代小鼠,剪除3 mm鼠尾尖端,编号并作标记,加入裂解缓冲液A(1 g NaOH + 0.372 g EDTA,溶于0.8 L去离子水中,定容至1 L)100 μL,95 ℃ 20 min(DNA快速提取法),冷却后加入裂解缓冲液B(6.3 g Tris-HCl溶于0.8 L去离子水中,定容至1 L)100 μL和ReadyMixTMTaq PCR反应混合物,行PCR扩增。扩增产物行2%琼脂糖凝胶电泳,凝胶成像系统扫描并分析结果。
2. 磁珠分选小鼠脾脏CD4+CD62L+Naïve T细胞:每次于无菌屏障内取2只同组小鼠脾脏,细胞筛研磨,与5~8 mL淋巴细胞分离液充分混合,缓慢加入1 mL含15% FBS的完全培养基,300×g梯度离心30 min,分离得到单个核细胞悬液,计数后取1×108个细胞用于分选。细胞以分选缓冲液重悬至400 μL,按磁珠分选试剂盒说明书要求进行CD4+CD62L+Naïve T细胞分选,分选得到的细胞离心后重悬于含15% FBS的完全培养基,密度调整至1×106/mL。
3. 流式细胞术检测Naïve T细胞纯度:分别取5×105个分选得到的细胞至2个流式管,300×g离心 5 min,吸去上清,以流式缓冲液重悬至100 μL,其中一管不加荧光标记抗体(空白对照),另一管加入CD4-FITC、CD62L-PE单抗各1 μL,4 ℃避光孵育40 min,流式缓冲液清洗2次后重悬至500 μL,上流式细胞仪检测。
4. Naïve T细胞体外诱导Th17细胞:磁珠分选细胞前夜以无菌PBS包被96孔板,每孔50 μL,包被液中分别加入CD3单抗10 μg/mL和CD28单抗5 μg/mL,4 ℃孵育过夜。将LFA-1-/-组和WT对照组分选得到的细胞密度调整至1×106/mL,分别进一步分为四组,予不同细胞因子诱导:空白对照组(不添加任何细胞因子),TGF-β组(重组人TGF-β 3 ng/mL),TGF-β+IL-6组(重组人TGF-β 3 ng/mL,重组小鼠IL-6 40 ng/mL),TGF-β+IL-6+IL-23组(重组人TGF-β 3 ng/mL,重组小鼠IL-6 40 ng/mL,重组小鼠IL-23 30 ng/mL)。取出冰箱内包被好的96孔板,PBS清洗1次,将各组细胞悬液以每孔200 μL加入96孔板,37 ℃ 5% CO2培养箱培养72~96 h,行Th17细胞比率检测。
5. 流式细胞术检测Th17细胞比率:每个待测细胞培养孔加入细胞因子刺激剂PMA 200 ng/mL、IONO 500 ng/mL,37 ℃ 5% CO2培养箱孵育1 h,再加入细胞因子释放阻断剂BFA 300 μg/mL,继续孵育4~5 h,收集待测细胞至流式管(每管5×105个细胞),300×g离心5 min,吸去上清,以流式缓冲液重悬至100 μL, 加入CD4-FITC 1 μL,4 ℃避光孵育40 min,清洗1次后加入500 μL破膜固定剂,4 ℃避光孵育30 min,重悬至100 μL,分别加入IL-17A-PE单抗和IgG-PE(阴性对照)各1 μL,4 ℃避光孵育30 min,流式缓冲液清洗1次,以10×固定液重悬至300 μL,上流式细胞仪检测。
6. 荧光定量PCR:收集经TGF-β+IL-6+IL-23诱导的细胞,RNAiso Plus试剂裂解提取RNA,按逆转录试剂盒说明书进行操作合成cDNA。引物序列:目的基因ROR-γt F 5’-CAC GGC CCT GGT TCT CAT-3’,R 5’-GCA GAT GTT CCA CTC TCC TCT TCT-3’;目的基因IL-17A F 5’-AGC TTT CCC TCC GCA TTG A-3’,R 5’-GCT CCA GAA GGC CCT CAG A-3’;内参照GAPDH F 5’-CAT GGC CTT CCG TGT TCC TA-3’,R 5’-TGT CAT CAT ACT TGG CAG GTT TCT-3’。按荧光定量PCR试剂盒说明书进行操作,2-ΔΔCt法计算目的基因mRNA相对表达量。
7. ELISA法检测IL-17A浓度:收集经TGF-β+IL-6+IL-23诱导的细胞培养上清液,按试剂盒说明书进行操作,检测IL-17A浓度。
三、统计学分析
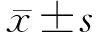
结 果
一、子代小鼠基因型鉴定
PCR鉴定筛选显示随机选取的15只子代小鼠(分别标记为A1~6、C1~5、D1~3和D5,D4为加样失误,不作为统计样本)均为LFA-1-/-小鼠(图1)。
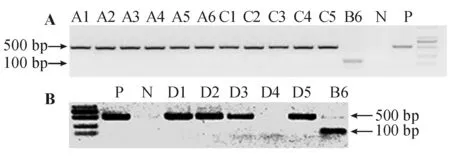
P:阳性对照(亲代纯合子LFA-1-/-小鼠基因组DNA);B6:阴性对照(WT对照组小鼠基因组DNA);N:空白对照
二、磁珠分选小鼠脾脏Naïve T细胞纯度
流式细胞分析显示,分选前CD4+T细胞纯度为12.2%(图2A),分选后得到的CD4+T细胞纯度均大于96%(图2B);以分选后单独标记CD4作为空白对照(图2C),对比确定分选后CD4+CD62L+Naïve T细胞纯度大于95%(图2D)。表明所采用的磁珠分选方法能成功分选出高纯度的Naïve T细胞,为后续实验的顺利进行提供了保证。
三、Naïve T细胞体外诱导Th17细胞
组内比较:WT对照组Naïve T细胞经低剂量TGF-β刺激后,Th17细胞比率为0.5%±0.3%,与空白对照组相比差异无统计学意义(P>0.05);TGF-β+IL-6联合刺激能诱导出少量Th17细胞,比率为1.5%±0.1%,与空白对照组和TGF-β组相比差异均有统计学意义;在TGF-β联合IL-6刺激的基础上加入IL-23,Th17细胞比率升高至5.7%±0.2%,与空白对照组、TGF-β组和TGF-β+IL-6组相比差异均有统计学意义(图3A、3C)。LFA-1-/-组Naïve T细胞经低剂量TGF-β刺激后,Th17细胞比率已达4.4%±0.4%;IL-6的加入使该比率升高至14.1%±1.0%;在此基础上加入IL-23,Th17细胞比率进一步升高至17.2%±1.4%,组内两两比较差异均有统计学意义(图3B、3D)。
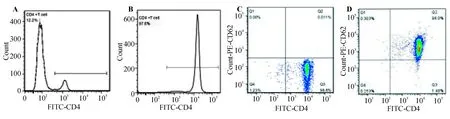
A:分选前CD4+ T细胞比率;B:分选后CD4+ T细胞比率;C:分选后CD4+CD62L- T细胞比率;D:分选后CD4+CD62L+ T细胞比率

*P<0.05,**P<0.01,***P<0.001
组间比较:在相同诱导分化体系中(TGF-β+IL-6+IL-23),LFA-1-/-组Naïve T细胞诱导出的Th17细胞比率明显高于WT对照组,组间差异有统计学意义(图3E)。
四、ROR-γt和IL-17A mRNA表达
荧光定量PCR检测显示,LFA-1-/-组Naïve T细胞经TGF-β+IL-6+IL-23诱导后,ROR-γt和IL-17A mRNA相对表达量分别为4.002±0.076和5.161±0.168,分别明显高于WT对照组的1.214±0.109 和 1.038±0.035,相应组间差异均有统计学意义(P<0.001)。
五、细胞培养上清液IL-17A浓度
ELISA检测显示,LFA-1-/-组Naïve T细胞经TGF-β+IL-6+IL-23诱导后,细胞培养上清液中IL-17A浓度为(1 049.70±48.86) pg/mL,明显高于WT对照组的(634.64±51.72) pg/mL,组间差异有统计学意义(P<0.01)。
讨 论
从胸腺迁移至外周的Naïve T细胞经特定细胞因子刺激活化后,产生特定的效应表型,包括Th1、Th2、Th17细胞,在对抗大量病原体、组织损伤和其他免疫缺陷时发挥不同生物学功能[3],对Th17途径的研究发现其分化具有可塑性[4]。Th17细胞分泌的效应细胞因子主要有IL-17A、IL-17F、IL-21、IL-22等,其中以IL-17A促炎能力最强,被认为是Th17细胞的特异性标记物[5],而ROR-γt为其特异性转录因子[3]。Th17细胞及其效应细胞因子除介导宿主对外来细菌感染的防御机制外,还参与了多种自身免疫性疾病的发生,其在自身免疫性疾病中的作用包括上调促炎细胞因子、趋化因子表达,引起组织炎性细胞浸润和组织破坏,加速细胞凋亡[6],被认为是IBD炎症反应的始动因素。
淋巴细胞在免疫监视和免疫反应中,其迁移、渗出、活化均与其黏附能力密切相关,LFA-1与细胞间黏附分子-1(ICAM-1)介导的跨膜双向信号传递在其中起重要作用;此外,LFA-1与ICAM-1亦是与淋巴细胞活化密切相关的共刺激受体/配体[7]。LFA-1为黏附分子β2 整合素家族成员,是由α链(CD11a)与β链(CD18)两个亚单位通过非共价键连接形成的异二聚体(αLβ2),表达于大部分淋巴细胞表面,为其活化提供第二信号,并具有降低TCR阈值的作用[8-10]。近年来,一些研究探讨了LFA-1基因缺失动物模型对炎症刺激的反应,但结论争议颇多。Wang等[11]对小鼠实验性自身免疫性脑脊髓炎(EAE)模型的研究发现,敲除LFA-1基因能抑制引流淋巴结内的淋巴细胞募集和抗原特异性Th17细胞产生,降低EAE发生率,减轻EAE炎症程度。Haasken等[12]则发现敲除β2整合素基因可使小鼠Treg细胞功能受损,免疫应答异常激活,从而加重自身免疫性心内膜炎。因此,LFA-1似具有抗炎与促炎的双向作用。
本课题组前期研究发现溃疡性结肠炎(UC)和克罗恩病(CD)患者外周血单个核细胞LFA-1表达显著低于健康对照者[13],推测外周血LFA-1高表达的淋巴细胞群迁移至肠黏膜可能是引起IBD肠黏膜炎症的重要因素;同时发现IBD患者外周血中Treg细胞比率显著降低,Th17细胞比率显著升高,并与疾病活动度相关[14-15]。随后进行的动物实验发现,LFA-1-/-小鼠外周血中CD4+细胞、Treg细胞比率明显低于野生型小鼠,对葡聚糖硫酸钠(DSS)诱导的结肠炎症的耐受性较野生型小鼠差;LFA-1-/-结肠炎小鼠血清TGF-β1、IL-10、IL-17A水平明显高于未诱导结肠炎的LFA-1-/-小鼠,但低于野生型结肠炎小鼠[16],再次表明LFA-1与IBD发病密切相关,并可能对T细胞的诱导分化和Treg/Th17比例产生影响。
为验证上述假设,本实验进一步观察了LFA-1基因缺失对小鼠脾脏Naïve T细胞体外向Th17细胞分化的影响。实验结果显示,对于野生型小鼠的Naïve T细胞,TGF-β单独存在不能有效诱导其向Th17细胞分化,而TGF-β与IL-6共同作用可提高Th17细胞比率(1.5%±0.1%);诱导分化体系中再加入IL-23,Th17细胞比率进一步升高(5.7%±0.2%),表明IL-23可激活Th17细胞并维持其稳定性[1]。然而,对于LFA-1-/-小鼠的Naïve T细胞,低剂量TGF-β即可产生较高的Th17细胞诱导率(4.4%±0.4%),而TGF-β与IL-6共同作用可使诱导效应明显增强(14.1%±1.0%);诱导分化体系中再加入IL-23,Th17细胞比率可进一步升高至17.2%±1.4%。在相同诱导分化体系中(TGF-β+IL-6+IL-23),LFA-1-/-小鼠的Naïve T细胞体外向Th17细胞分化的能力显著强于野生型小鼠的Naïve T细胞,随后进行的基因水平和细胞因子水平的检测亦显示该组Th17细胞特异性转录因子ROR-γt、特异性标记物IL-17A mRNA表达和细胞培养上清液中的IL-17A浓度均显著高于野生型小鼠。上述结果表明,在相同诱导分化体系中,LFA-1-/-与LFA-1+/+相比更有利于Th17细胞的诱导分化,即LFA-1基因缺失对小鼠脾脏Naïve T细胞体外向Th17细胞分化具有明显促进作用。
综上所述,本研究成功确立了小鼠脾脏Naïve T细胞体外向Th17细胞分化的诱导分化体系,并发现LFA-1基因缺失能促进Naïve T细胞向Th17细胞分化,为后续Th17途径及其致炎作用的研究奠定了实验基础。如能深入研究LFA-1对Th17细胞功能的影响,有可能为IBD的治疗提供新的思路和药物靶点。
1 Bettelli E, Korn T, Kuchroo VK. Th17: the third member of the effector T cell trilogy[J]. Curr Opin Immunol, 2007, 19 (6): 652-657.
2 Wohler J, Bullard D, Schoeb T, et al. LFA-1 is critical for regulatory T cell homeostasis and function[J]. Mol Immunol, 2009, 46 (11-12): 2424-2428.
4 Basu R, Hatton RD, Weaver CT. The Th17 family: flexibility follows function[J]. Immunol Rev, 2013, 252 (1): 89-103.
5 Ouyang W, Kolls JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation[J]. Immunity, 2008, 28 (4): 454-467.
6 Kleinewietfeld M, Manzel A, Titze J, et al. Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells[J]. Nature, 2013, 496 (7446): 518-522.
7 李猛,高春记. LFA-1与配体ICAM-1黏附分子功能的研究进展[J]. 中国实验血液学杂志, 2008, 16 (1): 213-216.
8 Bachmann MF, McKall-Faienza K, Schmits R, et al. Distinct roles for LFA-1 and CD28 during activation of naive T cells: adhesion versus costimulation[J]. Immunity, 1997, 7 (4): 549-557.
9 Kandula S, Abraham C. LFA-1 on CD4+ T cells is required for optimal antigen-dependent activationinvivo[J]. J Immunol, 2004, 173 (7): 4443-4451.
10 Abraham C, Griffith J, Miller J. The dependence for leukocyte function-associated antigen-1/ICAM-1 interac-tions in T cell activation cannot be overcome by expression of high density TCR ligand[J]. J Immunol, 1999, 162 (8): 4399-4405.
11 Wang Y, Kai H, Chang F, et al. A critical role of LFA-1 in the development of Th17 cells and induction of experimental autoimmune encephalomyelytis[J]. Biochem Biophys Res Commun, 2007, 353 (4): 857-862.
12 Haasken S, Auger JL, Binstadt BA. Absence of β2 integrins impairs regulatory T cells and exacerbates CD4+ T cell-dependent autoimmune carditis[J]. J Immunol, 2011, 187 (5): 2702-2710.
13 华梦超,孙瑾,于成功. 炎症性肠病患者外周血淋巴细胞功能相关抗原-1的表达与临床特征的关系[J]. 胃肠病学, 2013, 18 (11): 667-671.
14 王轶,刘雪平,赵治彬,等. 外周血CD4+CD25+FOXP3+调节性T细胞与炎症性肠病疾病活动度的关系[J]. 胃肠病学, 2010, 15 (4): 218-221.
15 刘雪平,王轶,赵治彬,等. 炎症性肠病患者外周血Th17细胞的变化及其临床意义[J]. 胃肠病学, 2010, 15 (5): 284-287.
16 姚仁玲,邹晓平,于成功. 淋巴细胞功能相关抗原-1调节Treg细胞对炎症性肠病的影响[J]. 胃肠病学, 2013, 18 (6): 346-351.
