2-甲基菲加氢反应热力学研究
2014-09-05杨惠斌江洪波翁惠新
杨惠斌,张 晴,江洪波,翁惠新
(华东理工大学石油加工研究所,上海 200237)
2-甲基菲加氢反应热力学研究
杨惠斌,张 晴,江洪波,翁惠新
(华东理工大学石油加工研究所,上海 200237)
以2-甲基菲加氢反应为研究对象,采用对比态法和基团贡献法对各化合物的物性进行估算,并以物性数据为基础,对不同反应温度下反应网络中各步反应的吉布斯自由能变、平衡常数和反应焓变进行计算,根据平衡常数计算不同氢分压和反应温度下的加氢反应产物平衡组成及反应氢耗。计算结果表明:2-甲基菲加氢的各步反应均为放热反应,反应平衡常数随着反应温度的升高逐渐降低,较高的反应温度或较低的氢分压均有利于中间环加氢产物的生成并使反应过程的总氢耗降低。
2-甲基菲 多环芳烃 加氢 热力学 选择性
石油资源短缺以及世界原油品质的重质化、劣质化,使得石油加工的难度增大,随着全球车用燃料市场对轻质油品需求量的逐渐增加,如何将重质油中的多环芳烃在较低的成本下最大量地转化为轻质油品成为炼油领域研究的核心[1-2]。多环芳烃是重质油品中最难轻质化的化合物,在几种成熟的重油轻质化工艺中,热裂解无法将多环芳烃开环,多环芳烃在热裂解反应过程中只能以结焦前身物的形式存在;催化裂化反应过程中存在的氢转移反应和裂化反应可将少部分多环芳烃转化成轻质油品,但多环芳烃仍主要发生脱氢积炭反应;加氢裂化可将多环芳烃加氢、开环、裂化成轻质化合物,但多环芳烃的氢碳比很低,传统的加氢裂化技术往往是将多环芳烃全加氢再开环、裂化成轻质油品,反应条件苛刻,反应过程氢耗高,液体产物收率低。与全加氢反应不同,多环芳烃中间环加氢饱和反应氢耗低,中间环加氢产物经裂化反应后可得到单环芳烃类高附加值产品,近年来受到学者的普遍关注[3-5]。多环芳烃的芳环数较多,其加氢反应是一个极其复杂的过程,存在多条反应路径。传统的芳烃加氢催化剂对中间环加氢选择性较低,因此有必要开发多环芳烃中间环选择性加氢催化剂[3-4]。多环芳烃加氢反应热力学是研究多环芳烃加氢反应限度和开发加氢催化剂的基础,目前公开报道的文献较少。
原油中常见的多环芳烃包括蒽、菲、芘、芴、荧蒽及其衍生物等,它们主要存在于较重的馏分油中[5],三环芳烃菲作为一种典型的多环芳烃,常常作为模型化合物用于多环芳烃加氢实验中,但实际油品中的多环芳烃大部分都是带侧链的多环芳烃。本课题选择2-甲基菲作为研究对象,通过对比态法和基团贡献法[6-7]估算反应体系中各物质的物性及热力学性质,考察2-甲基菲加氢反应体系的热力学特点及中间环选择性加氢的优化操作条件,为多环芳烃选择性加氢催化剂的开发提供理论指导。
1 2-甲基菲加氢反应体系
据文献[8-9]报道,2-甲基菲加氢反应过程中出现的主要物质有:2-甲基菲(A)、氢气(B)、2-甲基-9,10-二氢菲(C)、2-甲基-1,2,3,4-四氢菲(D)、2-甲基-5,6,7,8-四氢菲(H)、2-甲基-1,8-八氢菲(E)、2-甲基-1,10-八氢菲(F)、2-甲基-5,10-八氢菲(I)和2-甲基全氢菲(G)。考虑各种可能的反应路径,2-甲基菲的加氢反应网络如图1所示(图中氢气未示出),其中C是2-甲基菲中间环加氢产物。
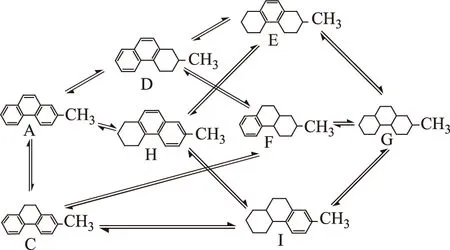
图1 2-甲基菲加氢反应网络
从图1可以看出,2-甲基菲的加氢反应网络极其复杂,从2-甲基菲加氢到2-甲基全氢菲的反应过程存在多条反应路径,需要通过每一种化合物的物化性质来计算相应加氢反应的热力学参数。然而,该反应体系中除氢气的物性可以通过相关数据手册查到外,其余物质的许多性质很难直接从物性手册中查得,但可以通过合适的分子性质估算方法计算得到。本课题组曾经利用对比态法和基团贡献法对菲加氢反应体系的热力学性质进行了估算,并将求得的热力学平衡常数在反应动力学参数估算过程中加以应用,实验数据拟合效果良好,且正负反应速率常数之比符合平衡关系[10]。
2 2-甲基菲加氢反应热力学性质计算
2.1 标准状态下各物质的物性


表1 2-甲基菲加氢反应体系中各物质的物性
2.2 标准状态下反应焓变、熵变和吉布斯自由能变
2.3 不同反应条件下吉布斯自由能变、平衡常数和焓变

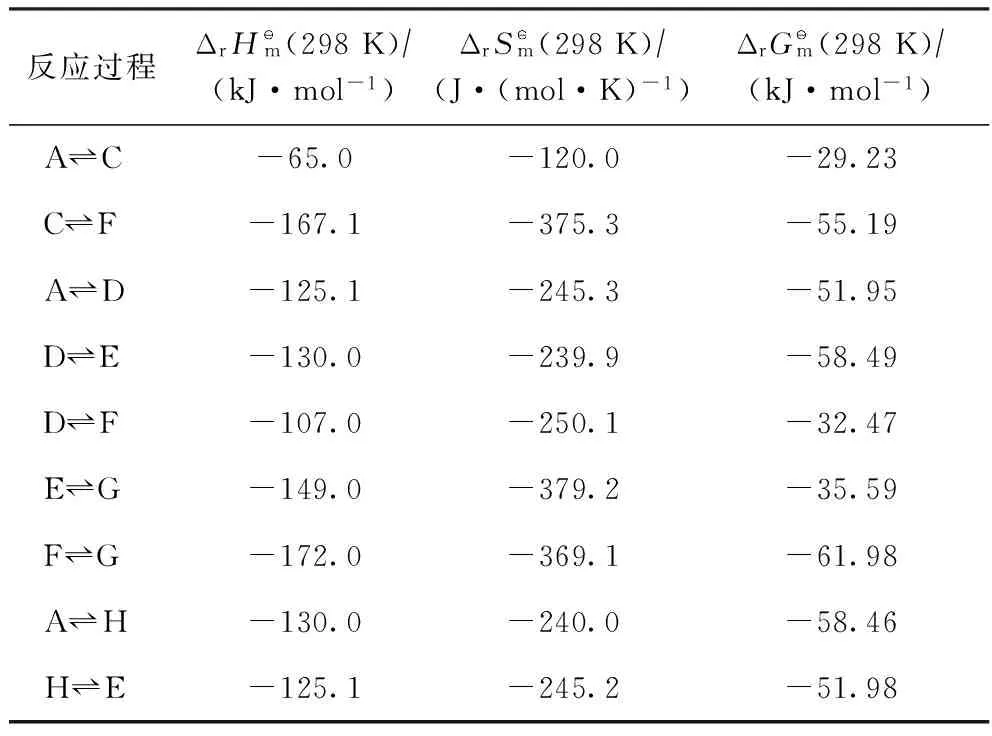
表2 标准状态下各反应的焓变、熵变和吉布斯自由能变

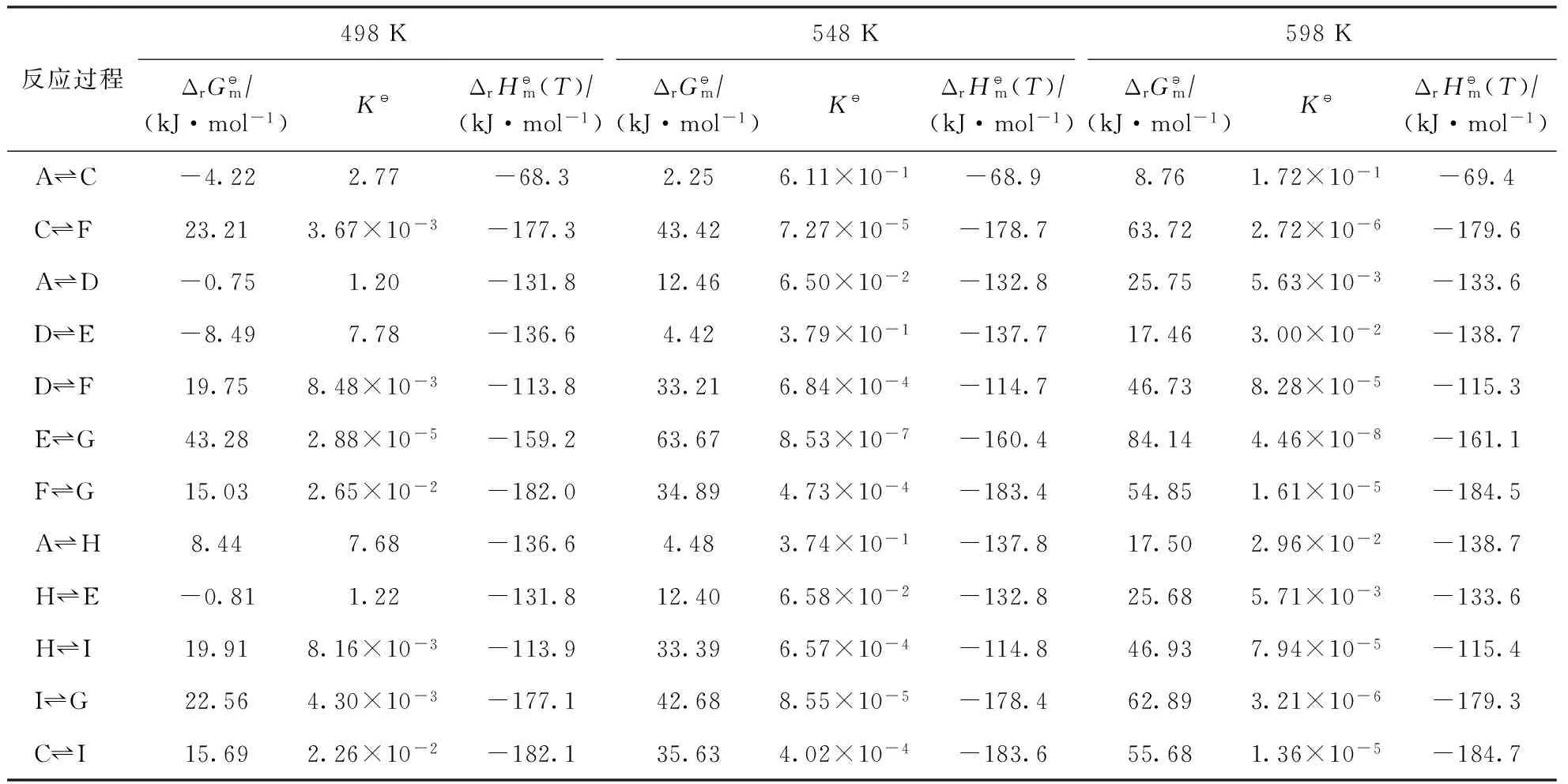
表3 498,548,598 K时各反应的吉布斯自由能变、平衡常数和焓变
由表3可知,当反应温度为498~598 K时,2-甲基菲加氢反应网络中的各反应焓变均小于零,表明该反应网络中的各反应均为放热反应,但随着反应温度的升高,热效应的增加并不明显。当反应温度为498 K时,2-甲基菲加氢反应网络中部分反应的吉布斯自由能变小于零,表明这些反应可自发进行,而当反应温度升高到548 K和598 K时,反应网络中各反应的吉布斯自由能变均大于零,表明各反应均不可自发进行。随着反应温度的升高,各反应的吉布斯自由能变增加比较明显,同时表现出平衡常数减小,表明相应的加氢产物热力学平衡浓度降低。从热力学角度分析,降低反应温度有利于加氢产物热力学平衡浓度的增加,而由阿伦尼乌斯方程可知,反应温度是影响反应速率的关键因素,反应温度升高,加氢反应速率增大,获得相同浓度的加氢产物时所需的反应时间减小。因此,存在使反应速率和产物浓度均达到最优值的最佳反应温度。
3 反应平衡浓度与氢耗
3.1 不同反应条件下各物质的平衡浓度
通过计算得到不同温度下2-甲基菲加氢反应的平衡常数,并得到不同氢分压下2-甲基菲及其加氢产物的热力学平衡浓度(Ci,摩尔分数)随反应温度(T)的变化关系,结果见图2。

图2 不同氢分压下反应体系平衡浓度与反应温度的关系■—2-甲基菲; ●—2-甲基-9,10-二氢菲; ▲—2-甲基-1,2,3,4-四氢菲; 甲基-1,8-八氢菲; 甲基-1,10-八氢菲; 甲基全氢菲;◆—2-甲基-5,6,7,8-四氢菲; ★—2-甲基-5,10-八氢菲
从图2可以看出,在相同的氢分压下,随着反应温度的升高,2-甲基菲的平衡浓度逐渐增加,中间环加氢产物2-甲基-9,10-二氢菲的平衡浓度逐渐增加,而2-甲基全氢菲的平衡浓度逐渐降低。在相同的反应温度下,随着氢分压的升高,2-甲基菲的平衡浓度逐渐减小,2-甲基-9,10-二氢菲的平衡浓度减小,2-甲基全氢菲的平衡浓度逐渐增加。反应体系中的其它组分,随着反应条件的变化其平衡组成浓度变化趋势各有不同。因此,适当地提高反应温度或降低反应压力均可使中间环加氢产物2-甲基-9,10-二氢菲的平衡浓度得到提高。
3.2 不同反应条件下的总氢耗
2-甲基菲加氢反应深度不同其反应氢耗也不同,其中由1 mol 2-甲基菲加氢生成1 mol 2-甲基-9,10-二氢菲需要1 mol H2,生成1 mol的2-甲基-1,2,3,4-四氢菲或2-甲基-5,6,7,8-四氢菲需要2 mol 的H2,生成1 mol 2-甲基-1,8-八氢菲或2-甲基-1,10-八氢菲或2-甲基-5,10-八氢菲需要4 mol H2,生成1 mol 2-甲基全氢菲需要7 mol H2。随着加氢深度的增加,氢耗逐渐增加。
根据生成每种加氢产物的反应氢耗,计算不同反应条件下1 mol 2-甲基菲的加氢反应达到热力学平衡状态时所需要消耗的氢气物质的量,结果见表4。
由表4可看出:在相同的反应温度下,随着氢分压的升高,总反应氢耗逐渐增加;在相同的反应压力下,随着反应温度的升高,总反应氢耗逐渐减小。因此,适当提高反应温度或降低氢分压均有利于降低2-甲基菲加氢反应的氢耗。同时,对照图2的各加氢产物热力学平衡浓度分布规律,通过改变反应温度和氢分压可以控制加氢反应深度和反应氢耗,获得更多的中间环加氢产物。从表4可以看出,在反应温度为648 K、氢分压为1 010 kPa的反应条件下,总反应氢耗为0.75 mol/mol,是全部计算结果中的最低值;由图2可知,在该反应条件下,中间环加氢产物2-甲基-9,10-二氢菲的平衡浓度是全部计算结果中的最高值,表明高温、低压有利于提高2-甲基菲中间环加氢反应的选择性。在实际生产过程中,由于生产条件和经济性等方面的限制,多环芳烃加氢反应的停留时间往往较短,反应很难完全达到热力学平衡状态,很多工况下的加氢反应深度还远未达到热力学平衡状态,因此,实际氢耗往往低于理论氢耗。

表4 不同反应条件下1 mol 2-甲基菲的加氢反应达到热力学平衡时的总氢耗 mol
4 结 论
以2-甲基菲加氢反应为研究对象,通过热力学计算得到了不同反应条件下的产物浓度分布规律,较高的反应温度或较低的氢分压均有利于中间环加氢产物2-甲基-9,10-二氢菲的生成并使反应体系的总氢耗降低,从而获得较多的选择性加氢产物并降低加氢反应的生产成本。
[1] 钱伯章.2010年中国石化进口高硫原油加工量增长17%[J].炼油技术与工程,2011,41(3):64
[2] 曹志涛,高原.含硫和高硫原油的加工技术[J].化学工业与工程技术,2010,31(2):24-27
[3] Yasuda H,Higo M,Yoshitomi S,et al.Hydrogenation of tetralin over sulfided nickel-tungstate/alumina and nickel-molybdate/alumina catalysts[J].Catalysis Today,1997,39(1/2):77-87
[4] Ahuja S P,Derrien M L,Le Page J F.Activity and selectivity of hydrotreating catalysts[J].Industry & Engineering Chemical Product Research and Development,1970,9(3):272-281
[5] 张成,周涵,王丽新,等.芘加氢分子模拟研究[J].计算机与应用化学,2012,29(2):161-164
[6] 董新法,方利国,陈砺.物性估算原理及计算机计算[M].北京:化学工业出版社,2006:30-237
[7] 马沛生.化工热力学(通用型)[M].北京:化学工业出版社,2005:261-291
[8] Korre S C,Klein M T.Hydrocracking of polynuclear aromatic hydrocarbons.Development of rate laws through inhibition studies [J].Industry Engineering Chemistry Research,1997,36(6):2041-2050
[9] Michele Nuzzi,Bruno Marcandalli.Hydrogenation of phenanthrene in the presence of Ni catalyst.Thermal dehydrogenation of hydrophenanthrenes and role of individual species in hydrogen transfers for coal liquefaction[J].Fuel Processing Technology,2003,80(1):35-45
[10]杨惠斌,常小瑞,江洪波,等.菲加氢反应体系的热力学计算和分析[J].化学反应工程与工艺,2012,28(6):499-505
[11]孙世刚,陈良坦,李海燕,等.物理化学(上)[M].厦门:厦门大学出版社,2008:356-406
[12]Speight J G.Lange’s Handbook of Chemistry[M].16th ed.New York:McGraw-Hill,2005:135-1233
[13]Lide D R.CRC Handbook of Chemistry and Physics[M].87th ed.Boca Raton FL:Taylor and Francis Group,2007:3-10
THERMODYNAMICS OF 2-METHYLPHENANTHRENE HYDROGENATION REACTION
Yang Huibin, Zhang Qing, Jiang Hongbo, Weng Huixin
(ResearchInstituteofPetroleumProcessing,EastChinaUniversityofScienceandTechnology,Shanghai200237)
The hydrogenation of 2-methylphenanthrene was studied by group contributions and corresponding state methods to investigate the physicochemical properties of compounds involved. The Gibbs free energy change, equilibrium constants and enthalpy changes of each step of the reaction network at different temperatures were calculated based on the physicochemical properties obtained. The calculations of the product compositions and hydrogen consumptions under different pressures and temperatures according to the equilibrium constants were conducted. The calculation results show that all step reactions are exothermic, their equilibrium constants decrease as the reaction temperature increases. High temperature and low pressure are beneficial for the production of intermediate 2-methyl-9,10-dihydro-phenanthrene and for the reduction of total hydrogen consumption.
2-methylphenanthrene; polycyclic aromatics; hydrogenation; thermodynamics; selectivity
2014-01-03; 修改稿收到日期: 2014-02-18。
杨惠斌,高级工程师,博士研究生,从事反应动力学的研究及人事管理工作。
江洪波,E-mail:hbjiang@ecust.edu.cn。
