肝炎后肝硬化性脾动脉瘤的CT表现与手术方式选择的相关研究
2014-08-28,,,,
, ,, ,
(第三军医大学西南医院放射科,重庆 400038)
脾动脉瘤(Splenic artery aneurysm,SAA) 是继腹主动脉和髂动脉之后的第三位内脏动脉瘤,肝硬化门脉高压是SAA主要原因之一,其发病率为7.0%~13.1%,其自发破裂的致死率高达36%~65%[1]。因此,脾动脉瘤破裂也是肝硬化患者突然死亡的原因之一。虽然CT对脾动脉瘤的诊断价值已经多有报道[2-4],但是在肝硬化患者的诊治实践中,脾动脉瘤的诊断和治疗常被忽视。因此,本文就肝硬化性脾动脉瘤的CT表现与手术方式选择的关系进行探讨。
1 资料与方法
1.1 临床资料
连续纳入我院2012年1月1日至2013年12月31日乙型肝炎后肝硬化性脾动脉瘤患者61例(女35例,男26例),不同手术方式患者的年龄、性别、体重指数和乙肝病史有统计学差异(P<0.05),见表1。CT/CTA检查和诊断扫描范围从膈顶至肝下角或胰腺钩突水平,平扫的条件为:层厚10 mm,间隔10 mm,螺距1.375,管电压120 KV,电流220 mA 增强扫描参数为120 kV、140 mAs、准直2.5 mm、层厚7.5 mm和螺距5,数据重建层厚2.5 mm、间隔1.25 mm。由高压注射器将非离子造影剂(优维显或欧乃振克,300 mgI/mL)以注射速度为3.0~4.0mL/s流量90m1 经前臂静脉注入。于注射对比剂后20~25 s、50~60 s和70 s扫描获得动脉期、门脉期和平衡期影像,薄层图像进行最大密度投影、容积再现和多平面重组重建。有2名影像医生就SAA部位、数量、大小、门静脉改变(变细、增宽及海绵样变)、曲张静脉团位置和数量、门体分流血管网(位置和数量)和脾脏改变(大小及梗死)分别进行评估,意见一致纳入诊断。
1.2 手术方式选择
小于40岁有生育要求的女性和年轻男性,正力型(BMI,19-25 ),乙肝病史5~10年,主瘤体直径在1.0~2.0 cm,伴有脾大和轻度门静脉高压患者行瘤体切除+重建脾动脉连续性以保留脾脏及其功能。乙肝病史5年以上,正力型(BMI,19~25),主瘤体直径大于1.0 cm且合并多个分支小瘤体、门静脉形态改变和门体分流的患者行主瘤体栓塞+分支小动脉瘤分期栓塞术。大于40岁女性(10~15年病史)或男性(乙肝病史大于15年),正力型(BMI,19~25),主瘤体位于脾门(无法分离瘤体与邻近结构),且存在脾肾分流和脾大的患者行主瘤体旷置+分支小动脉瘤分期栓塞。大于40岁女性和年龄稍小的男性、乙肝病史15年以上,超重(BMI,25~30 ),主瘤体位于脾动脉近端,瘤体直径约1.0~2.0cm,有食管静脉曲张及脾大患者行瘤体切除+分支小动脉瘤分期栓塞。大于50岁大多数男性,超重(BMI,30~39)乙肝病史15年以上,主瘤体位于脾动脉中远段,直径大于1.0cm,合并门静脉海绵样变、脾胃/肾分流、食管胃底静脉曲张、巨脾和脾梗死患者行瘤体切除+脾脏切除+曲张血管团离断术。
1.3 统计方法
采用SPSS 15.0软件对数据进行统计学处理,定量资料均数±标准差,不同手术组临床指标比较采用One-way analysis,P<0.05为差异有统计学意义。定性指标采用百分比,不同手术方式脾动脉瘤CT表现发生率比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
61例SAA中,31例(50.8%)行主瘤体栓塞+分支小动脉瘤分期栓术,4(6.6%)行主瘤体旷置+分支小动脉分期栓塞术,15(24.6%)行瘤体切除+脾脏切除+曲张血管团离术,7(11.5%)瘤体切除+分支小动脉瘤分期栓塞术,4(6.6%)行瘤体切除+重建脾动脉连续性术χ2/P(183/.000)。肝硬化性SAA的CT表现与手方式选择具体关系详见表2和图1~图5。
3 讨论
3.1 SAA临床特点
肝硬化患者SAA的发生率为7.0%~13.1%[1],其发生机制可能与门静脉高压导致的脾血流量增加有关。未破裂的SAA本身无症状,大部分患者只表现肝硬化、门脉高压和脾功能亢进的症状和特征;在门静脉压力突然降低,脾动脉血流量突然增加时,SAA会突然破裂,患者会因胃肠道或腹腔大出血而死亡,死亡率约56%[5]。因此,对于肝硬化门脉高压患者在进行门静脉高压治疗前筛查并处理脾动脉瘤是非常必要的。
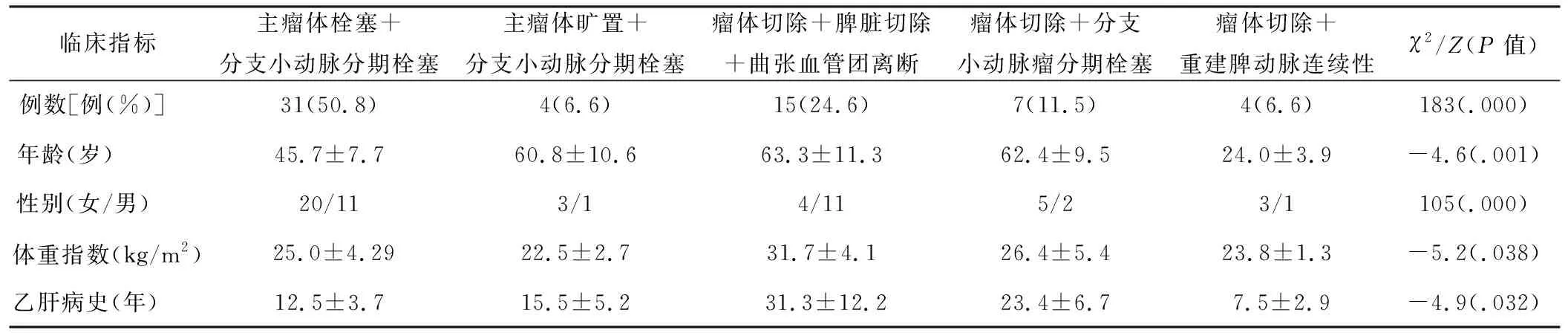
表1 不同手术方式的脾动脉瘤患者的临床指标对比(n=61)

患者,男,56岁,乙型肝炎5年,CT示:脾动脉起始段瘤,远段小SAA(红箭头)和一级分支小SAA(黄箭头),左肾静脉(蓝星)、脾静脉(黑星)和粗脾肾分流(黄箭头);最终行主瘤体栓塞、分支小动脉分期栓塞术
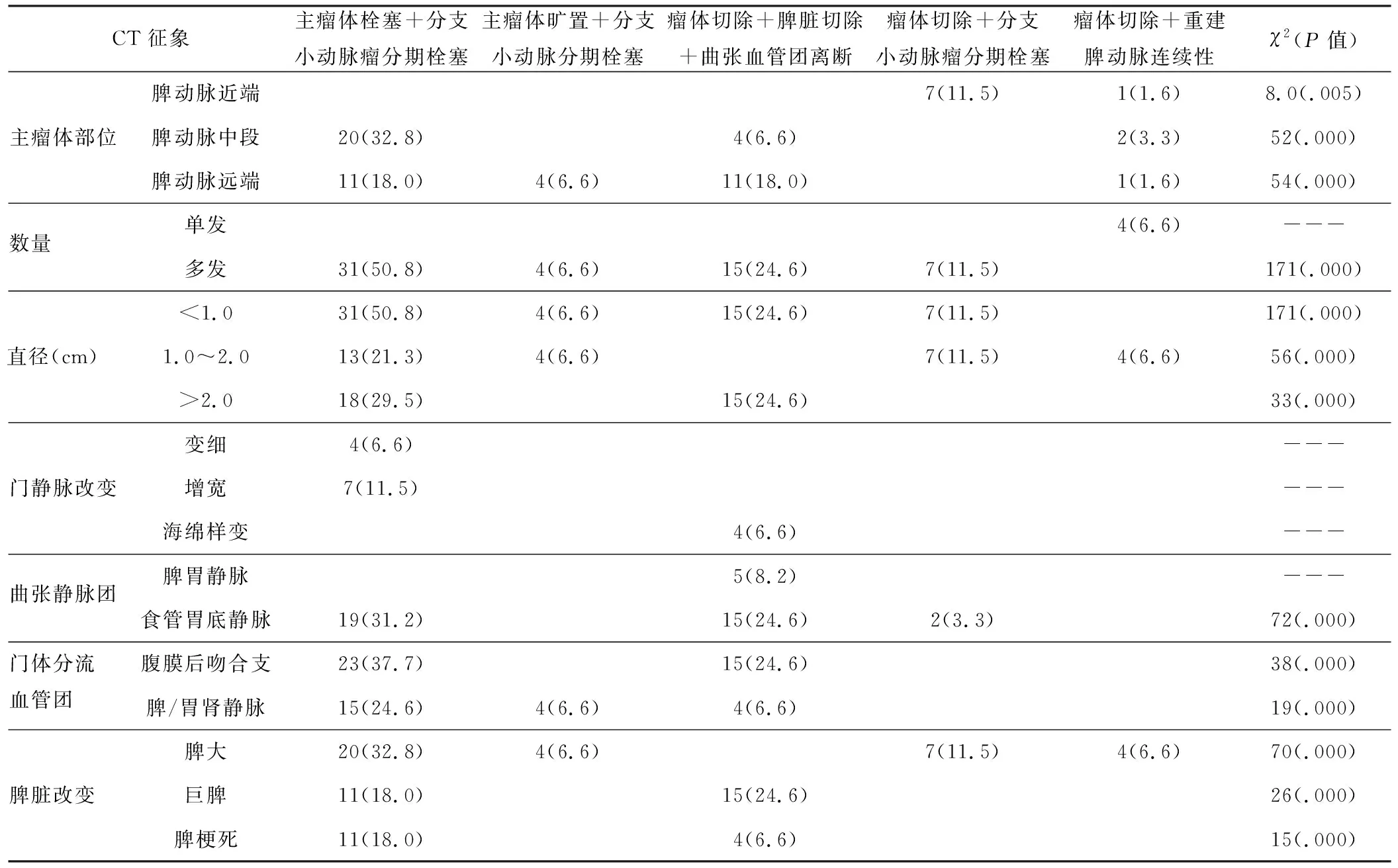
图1 典型病例1
患者,女,41岁,乙型肝炎12年,CT示:脾动脉中段巨大脾动脉瘤(16.7 cm×11.6 cm×15.2 cm)(黑星),多支脾动脉分支多发小动脉瘤(黄箭头);巨脾(黑三角)、脾梗死(蓝星),脾静脉、肠系膜上静脉、门静脉曲张;最终行脾切除+脾动脉瘤切除+曲张血管团离断术
图2典型病例2
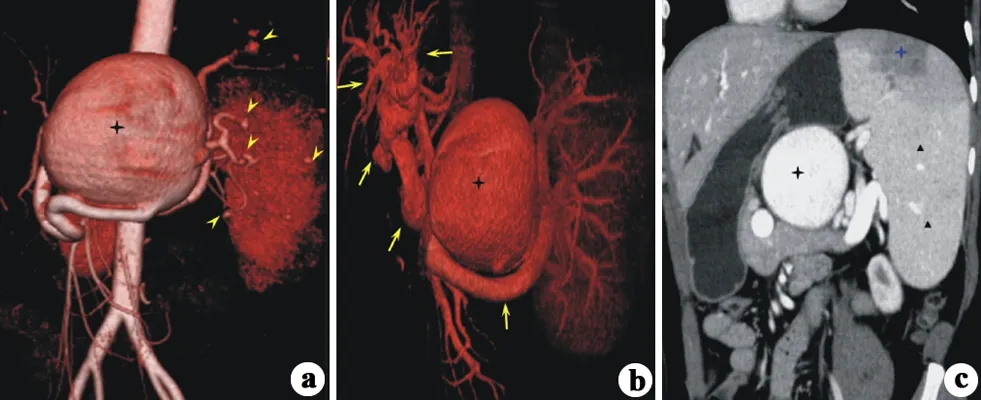
患者,女,48岁,乙型肝炎肝硬化病史16年,CT示脾门处主瘤体(红箭头),脾动脉近段小SAA(黄箭头),一级分支小SAA(黄箭头),巨脾(黑星),脾梗死(黄星),脾静脉和门静脉增粗(黄箭头);最终行主瘤体栓塞+小SAA分期栓塞术
图3典型病例3

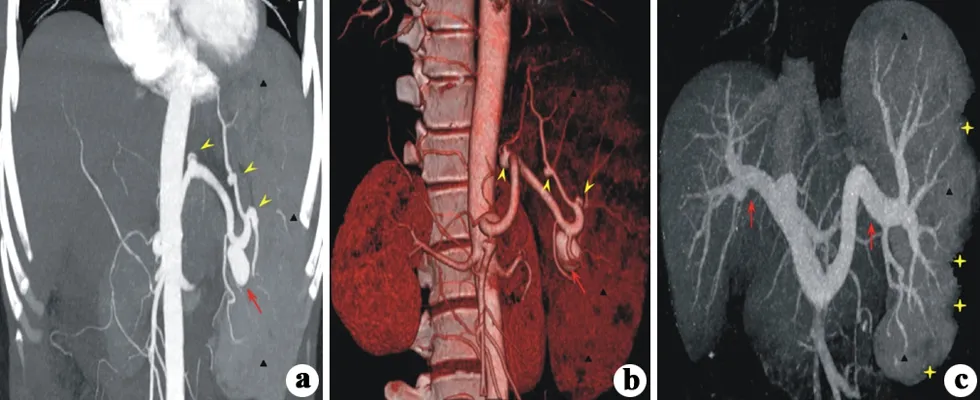
患者,男,63岁,乙型肝炎肝硬化9年,CT示:脾动脉中段单发小于2.0 cmSAA(红箭头),食管胃底静脉曲张团(黑星),脾静脉和门静脉增粗(黑箭头),脾大(黑三角);最终行瘤体切除+重建脾动脉连续性术
图4典型病例4

患者,女,19岁,乙型肝炎后肝硬化11年,CT示:脾动脉远端小于1.0cmSAA(红箭头)+多发分支小SAA(黄箭头),门静脉食管胃底静脉曲张血管团(黑星),巨脾(蓝星);最终行瘤体切除+脾脏切除+曲张血管团离断术
图5典型病例5
肝硬化性SAA的发生及破裂可能性与患者年龄、性别、病史长短及门脉高压程度有关[1-7]。凡是引起门静脉压力改变因素都有可能导致SAA的破裂。年龄小于40岁有生育要求的女性SAA患者在生育前必须处理SAA[1-3,6-7],并且尽可能保留脾脏和保护脾脏功能的完整性,从而避免因妊娠内分泌因素导致门静脉压力改变诱发SAA破裂。男性和大于40岁的女性,乙肝及肝硬化病程长,门静脉高压明显,脾动脉血流量大,SAA常多发,且呈现出脾动脉主干瘤体较大或巨大伴有多发分支小SAA发生,主瘤体破裂风险增高。门静脉压力降低会导致脾动脉血流量增加,进而导致SAA破裂,所以肝硬化门脉高压SAA患者,在处理门脉高压之前必须或同时处理SAA。
3.2 SAA的CT表现和手术方式选择关系
为了降低手术并发症的发生,SAA的手术方式选择依据SAA的CT表现,与SAA的部位、大小、数量、门静脉形态改变、有无曲张静脉团、有无门体分流和脾脏形态及密度改变有密切关系[1-5,8]。单发脾动脉主干SAA、脾大、且无明显门脉高压和门体分流者:直径大于2.0 cm、适合瘤体切除术/旷置+脾动脉连续性重建;直径小于2.0 cm适合瘤体栓塞,肝硬化患者脾脏因有胃短动脉侧枝循环供血、可以不进行脾动脉连续性重建,也不会引发大范围脾梗死,本研究有4例实施了瘤体切除术+脾动脉连续性重建术也证实了这一点。多发SAA手术方式选择比较复杂,要综合考虑主瘤体的部位、大小、主瘤体与周围结构是否容易分离、主瘤体周围是否有难分离的曲张血管团、分支瘤体的数量及脾脏形态及密度改变等因素。主瘤体位于脾门,主瘤体直径1.0~2.0 cm,瘤体容易与胰头分离,脾大、脾脏内有数个分支小SAA,食管胃底曲张团不影响主瘤体的剥离,适合主瘤体切除+分支小动脉栓塞,本研究有7例患者选择这种手术治疗方式;主瘤体位于脾动脉中远段,主瘤体直径大于2.0 cm或巨大与邻近结构(广泛门静脉海绵样变,巨大脾胃静脉及食管胃底静脉团)难于分离,虽然腹膜后吻合支在一定程度缓解门脉高压,但是脾脏严重淤血性肿大和多发梗死灶已无保留必要,且曲张静脉团血管壁薄且缺乏弹性容易破裂出血,适用于瘤体切除+脾脏切除+曲张血管团离断术,本研究有15例患者适用这种治疗方式;主瘤体直径1.0~2.0 cm或稍大于2.0 cm栓塞效果好,门腔分流(腹膜后吻合支网和脾/胃肾静脉分流)广泛存在缓解门脉高压(门静脉稍增宽、轻度淤血性脾肿大和脾脏散在小梗死灶)使得保留脾脏成为可能,另外广泛逆肝血流(Retzius静脉增多和曲张,)致门静脉主干及其分支变细,这类患者应该选择瘤体栓塞保守治疗方式,本研究中有33例患者符合这一点;主瘤体位于脾门处、直径1.0~2.0 cm不容易于脾脏分离者,门腔分流量大、门脉高压症状轻,适用于瘤体旷置术治疗。
本研究显示,肝硬化性SAA手术方式选择存在特殊性。既与患者的个体情况、原发疾病的严重程度有关,又与SAA的CT表现有关。总之,要依据SAA的部位、数量、大小、门静脉改变、曲张静脉团、门体分流血管网和脾脏改变等CT表现结合患者年龄、性别、体重指数及病史选择手术方法。
[参考文献]
[1] 崔玉军. 肝炎后肝硬化合并脾动脉瘤的临床特点与诊治[J].继续医学教育,2010;24(6):76-78.
[2] Sun C,Liu C,Ming XM,et al.The value of MDCT in diagnosis of splenic artery aneurysms [J].Eur J Radiol,2008,65(3):498-502.
[3] 谢 春,沈 文,祁 吉.MSCT血管成像诊断脾动脉瘤伴门静脉高压症的临床价值[J].放射学实践,2009,24(1):54-58.
[4] 范 荣,金中高.16层螺旋CT血管成像诊断脾动脉瘤的价值[J].中国医学影像学杂志,2008,16(4):310-312.
[5] Ohta M,Hashizume M,Ueno K,et al.Hemodynamic study of splenic artery aneurysm in portal hypertension[J].Hepatogastroenterology,1994,41(2):181-184.
[6] Sadat U,Dar O,Walsh S,et al.Splenic artery aneurysms in pregnancy--a systematic review[J].Int J Surg,2008,6(3):261-265.
[7] Phillips C,Bulmer J.Splenic artery aneurysm rupture during pregnancy[J].Nurs Womens Health,2013,17(6):508-517.
[8] Miao YD,Ye B.Intragastric rupture of splenic artery aneurysms:Three case reports and literature review[J].Pak J Med Sci,2013,29(2):656-659.
[9] Sakakibara K,Shindo S,Matsumoto M.Splenic artery aneurysm of the hepatosplenomesenteric trunk[J].Ann Vasc Dis,2013,6(4):730-733.
