机械通气致大鼠肺损伤时肺组织PPARγ表达的变化
2014-08-28,,,,,
,,, ,,
(山东省肿瘤医院麻醉科,山东 济南 250117)
机械通气引起的肺损伤(ventilator-induced lung injury,VILI)是指应用呼吸机过程中由于机械通气诸多因素和肺部原发病共同作用导致的肺组织损伤,发生率占机械通气的0.5%~39%。研究表明,机械通气导致炎性细胞活化并促进细胞因子释放,由此激发肺内或肺外组织的炎症反应,从而导致或加重急性呼吸窘迫综合征或多系统器官衰竭[1-2]。过氧化体增殖物激活受体γ(peroxisome proliferator activated receptor-γ,PPAR-γ)属于核内受体,共有α、β和γ 3个亚型。已发现PPARγ广泛表达于肺泡巨噬细胞和中性粒细胞中,它可以调节胰岛素敏感性,参与体内的新陈代谢,并在炎症过程起主要作用;还参与调节细胞增长、分化、凋亡。PPARγ能够通过干扰趋化因子的表达,调节肺泡巨噬细胞抗炎活性,限制过多伤害性的肺内炎症。近年的研究显示,在内毒素导致的肺损伤中,PPARγ的表达下调且NF-κB p65水平升高[3-4]。PPARγ在通气相关性肺损伤方面的研究尚未见报道。本研究拟从此入手,通过观察PPARγ在通气相关性肺损伤大鼠肺组织中的表达,以期进一步揭示通气相关性肺损伤机制,为临床预防及治疗提供参考。
1 材料与方法
1.1 实验动物与分组
清洁雄性SD大鼠63只,体质量370~390 g(由山东大学医学院动物实验中心提供),随机分为3组(n=21):大潮气量(Tidal volume,VT)组,Vt=12 mL;小潮气量组,Vt=6 mL;自主呼吸组。每组再根据通气时间分为3个亚组(n=7):通气1 h组、4 h组和8 h组。
1.2 方法
各组动物均在适应实验室环境72 h后麻醉,术前夜禁食,自由饮水。20%乌拉坦0.8 mL/100 g腹腔注射麻醉,右颈总动脉穿刺置管,测动脉压;左股静脉插管用于输液和给药,用微量输液泵以10 mL·kg-1·h-1速度输注输林格氏液,大潮气量组、小潮气量组给予肌肉松弛剂阿曲库胺,用生理盐水配制成2 mg/mL,先给负荷量1~2 mg/kg,继而以4~5 mg·kg-1·h-1输注速度维持。用14号BD留置针行气管插管,口腔内填塞无菌纱布以防止漏气。各项操作完毕后稳定20 min,开始实验。机械通气:接小动物呼吸机(浙江大学医学仪器厂,DH150型),呼吸参数设定:Vt按照实验各组要求设置,吸/呼(I∶E)比为1∶1,呼吸频率60~70 次/分,呼气末CO2分压维持在35~45 mmHg,呼气末正压(PEEP)为0,吸入室内空气(氧浓度为21%)。各组分别于通气1 h、4 h和8 h末颈总动脉放血处死动物。
测定肺灌洗液中蛋白总量、白细胞计数,测定肺组织湿/干重比(W/D) ,取颈动脉血4 mL后处死大鼠。立即开胸取出肺,左肺用4 ℃生理盐水行支气管肺泡灌洗。收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),低温离心(1 200 rpm,4 ℃,10 min),待上清液等分后置于-70 ℃保存,用于测定总蛋白(TP)含量,沉淀物用磷酸缓冲液稀释后光镜下行白细胞(WBC)计数;右上叶肺组织用于病理学检查,右中叶肺组织称湿重后置于烤箱中,70 ℃烘烤至恒重后称干重。计算肺W/D。剩余右肺迅速放液氮中冻实,留做RNA提取备用。Tripure法提取肺组织总RNA,紫外分光光度计测定D(260),计算RNA浓度。RTPCR:按试剂盒说明配置反应体系,在PCR仪中进行反应。先逆转录合成第1条cDNA,以此为模板进行扩增:94 ℃变性45 s;58 ℃退火45 s;72 ℃延伸45 s;共35个循环,最后72 ℃延伸7 min。PCR反应体系(cDNA 2 μl,10×PCR buffer 5 μl,MgCl24 μl,dNTP 0.5 μl)。所用引物均源自GenBank中大鼠PPARγ和GAPDH全长cDNA序列,经Primer 5.0软件设计,由日本TaKaRa Biotech公司合成。扩增产物置于2%琼脂糖凝胶中电泳,经凝胶成像系统分析成像,western blot检测PPARγ蛋白的变化,引物序列及反应条件见表1。

表1 PPARγ扩增反应条件
1.3 统计学处理
2 结果
2.1 肺组织病理改变
大潮气量组通气4 h、8 h后肺组织病理改变明显,肺泡间隔明显增厚,肺泡腔内可见较多的炎性细胞,部分肺泡腔内有渗出液;小潮气量组肺组织病理改变不明显,仅在8 h后有少量白细胞浸润;而自主呼吸组自主呼吸,肺组织无显著病理改变,见图1。
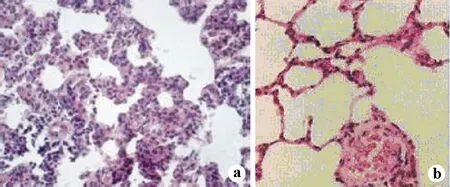
a:大潮起量组;b:小潮起量组
2.2 各组大鼠肺W/D和BALF中WBC、总蛋白的比较
大潮气量组通气4 h、8 h后肺W/D和BALF中WBC、总蛋白量明显增多,与其他组比较差异显著(P<0.01),而通气1 h后各组比较无显著差异(P>0.05),见表2。
2.3 PPARγ mRNA和PPARγ蛋白表达的比较
N组通气4 h、8 h后肺组织PPARγ mRNA和PPARγ蛋白表达下降,与其他组比较差异显著(P<0.01),而通气1 h后各组比较无显著差异(P>0.05),见表3、图2。
大潮气量机械通气4 h、8 h后,RT-PCR电泳结果显示PPARγ mRNA表达下调,与对照组相比,显著下降(P<0.01),见图2。

1:小潮气量通气8 h;2:大潮气量通气1 h;3:大潮气量通气4 h;4:大潮气量通气8 h
图2PPARγ mRNA表达变化
3 讨论
机械通气是临床救治呼吸衰竭患者的重要方法,也是全身麻醉患者必用的方法。但是,其引起的并发症尤其在ICU中,越来越受到重视。由此引起的肺损伤称为通气相关性肺损伤,发生机制主要在:容积伤(或称容量伤)、剪切力伤和生物性损伤。肺保护性的通气策略既是针对此而提出的,以小潮气量、容许性高CO2血症和适度PEEP为主[5]。研究发现,机械通气导致或加重肺血管通透性增加、炎性细胞积聚和细胞因子释放[6]。Tremblay等[7]研究发现,机械通气在肺内炎症因子(包括TNFα、IL,MIP等)的产生和释放以及导致肺损伤加重的过程中起着重要的作用,其机制目前并不十分清楚容积伤或称生物性损伤被认为在VILI中起主要作用[8-9],过大的潮气量导致肺泡反复张开与关闭,产生剪切力伤,并最终导致VILI。PPARγ属于核激素受体超家族,在调控脂肪细胞分化、脂质和糖类代谢以及炎症控制等方面具有重要作用,已有多个研究认为PPARγ参与肺损伤过程[10-11]。通常情况下,PPARγ与视黄醛X受体形成异源二聚体,并与辅抑制因子结合成复合物,处于失活状态。当PPARγ与特异性配体结合后,导致PPARγ与视黄醛X受体形成的异源二聚体的空间构象发生改变,与辅抑制因子脱离,再通过与相应靶基因启动子上的过氧化物酶体增殖物反应元件结合,激活靶基因转录[12-13]。已有研究表明内皮细胞PPARγ能够抵抗内毒素导致的肺损伤[14],而CO2在治疗急性肺损伤时PPARγ蛋白表达上升[15]。这些都说明PPARγ在肺损伤机制中起着重要作用。
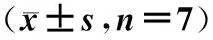
表2 大鼠肺W/D和BALF中WBC、TP的比较
*:与大潮气量组相应时间比较,P<0.01
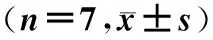
表3 PPARγmRNA和PPARγ蛋白表达的比较
*:与大潮气量组相应时间比较,P<0.01
本研究中用自主呼吸作为对照,不同潮气量进行比较。肺组织W/D和BALF中TP的变化可较好地反映肺间质及肺泡血管通透性改变,以及肺受损的程度;WBC计数可反映白细胞的浸润及炎症反应的水平。潮气量是机械通气最基本的参数,过大易引起通气过度、气压伤、循环功能紊乱等并发症,Vt过小易引起通气不足、肺泡萎陷、肺内分流增加等并发症。本试验选用常规大Vt(10~12 mL/kg)和低Vt(6~8 mL/kg),并以正常自主呼吸作为对照,实验结果显示:大潮气量组(即N组)在通气4 h后即出现肺组织损伤,表现为W/D增加,BALF中TP和WBC含量升高;肺组织病理改变明显,肺泡间隔明显增厚,肺泡腔内可见较多的炎性细胞,部分肺泡腔内有渗出液。通气8 h后,损伤继续;与小潮气量组即C组和自主呼吸R组比较,差异显著。N组4 h和8 h相比,无显著差异,说明大潮气量长时间机械通气导致VILI,而C组在长时间通气4~8 h后,较1 h相比,肺间质有水肿,BALF中TP和WBC含量也增高,但差异无显著意义。可能是非生理性的机械通气使肺泡反复萎陷产生剪切力, 引起上皮细胞和肺泡细胞的牵拉和肺泡巨噬细胞活化,激活肺部炎症级联反应和化学介质的产生等机制,进一步导致VILI。不同的研究显示潮气量在20 mL/kg和15 mL/kg通气2 h就能导致大鼠肺损伤。本实验中,潮气量设为12 mL/kg,但通气时间延长,也导致大鼠的肺损伤。本实验结果显示,N组通气4~8 h后,PPARγmRNA和PPARγ蛋白减少,而通气1 h无显著变化。小潮起量组及自主呼吸组无肺损伤,PPARγmRNA和PPARγ蛋白未见明显下降。可能是长时间大潮气量机械通气后,机体抗炎物质减少,而损伤持续,导致VILI。
本研究结果表明,大潮气量(12 mL/kg)持续4 h以上机械通气对大鼠造成肺损伤,同时伴有PPARγmRNA和PPARγ蛋白的减低,说明PPARγ在通气相关性肺损伤的发生机制中起了重要作用。应用PPARγ的激活剂或抑制剂能否抑制或促进通气相关性肺损伤,以及PPARγ通过何种途径参与肺损伤值得继续研究。
[参考文献]
[1] Halbertsma FJ,Vaneker M,Scheffer GJ,et al.Cytokines and biotrauma in ventilator-induced lung injury:a critical review of the literature[J].Neth J Med,2005,63(10):382-392.
[2] Wolthuis EK,Choi G,Dessing MC,et al.Mechanical ventilation with lower tidal volumes and positive end-expiratory pressure prevents pulmonary inflammation in patients without preexisting lung injury[J].Anesthesiology,2008,108(1):46-54.
[3] Raju C.Reddy.Immunomodulatory role of PPARγ in alveolar macrophages[J].Journal of Invertigative Medicine,2008,56(2):522-527.
[4] Virender K,Rehan Reiko S,Julia C,et al.Antenatally administered PPARγ agonist rosiglitazone prevents hyperoxia-induced neonatal rat lung injury[J].Am J Physiol Lung Cell Mol Physiol,2010,299(6):672-680.
[5] Michelet P,D′Journo XB,Roch A,et al.Protective ventilation influences systemic inflammation after esophagectomy:a randomized controlled study.Anesthesiology,2007,107(1):176-177.
[6] Bhatta Charya S,Sen N,Yiming MT,et al.High tidal volume ventilation induces proinflammatory signaling in rat lung endothelium[J].Am J Respir Cell Mol Biol,2003,28(2):218-224.
[7] Tremblay L,Valenza F,Ribeiro S,et al.Injurious ventilatory stratrgies increase cytokines and c-fos m-RNA expression in an isolated rat lung model[J].J Clin Invest,1997,99(5):944-952.
[8] Gattinoni L,Carlesso E,Langer T.Towards ultraprotective mechanical ventilation[J].Curr Opin Anaesthesiol,2012,25(1):141-147.
[9] Ngiam N,Kavanagh BP.Ventilator-induced lung injury: the role of gene activation[J].Curr Opin Crit Care,2012,18(1):16-22.
[10] Basilia Z,Paul W H,Michael O’C,et al.Lung injury after hemorrhage is age dependent:role of peroxisome proliferator-activated receptor [J].Crit Care Med,2009,37(6):1978-1987.
[11] Theodore JS,Venkateshwar GK,Raju CR.Peroxisome proliferator-activated receptor-γas a regulator of lung inflammation and repair [J].Proc Am Thorac Soc,2005,(2):226-231.
[12] Chinetti G,Fruchart JC,Staels B.Peroxisome proliferator activated receptors (PPARs):nuclear receptors at the crossroads between lipid metabolism and inflammation[J].Inflamm Res,2000,49(10):497-505.
[13] Bull AW.The role of peroxisome proliferator activated receptorγ in colon cancer and inflammatory bowel disease[J].Arch Pathol Lab Med,2003,127(9):1121-1123.
[14] Reddy AT,Lakshmi SP,Kleinhenz JM,et al.Endothelial cell peroxisome proliferator-activated receptor γ reduces endotoxemic pulmonary inflammation and injury[J].J Immunol,2012,189(11):5411-5420.
[15] Kawanishi S,Takahashi T,Morimatsu H,et al.Inhalation of carbon monoxide following resuscitation ameliorates hemorrhagic shock-induced lung injury[J].Mol Med Rep,2013,79(1):3-10.
