铁柱撑蒙脱石非均相UV/Fenton反应对模拟橙黄G染料废水的脱色机理研究
2014-08-28刘一帆成思敏吴宏海管玉峰蒋芬芬舒月红
刘一帆, 成思敏, 吴宏海, 管玉峰, 蒋芬芬, 舒月红
(华南师范大学化学与环境学院,广州 510006)
染料废水色度大、毒性高、排放量大、可生化性差,常规的废水生物处理方法难以确保其出水达到规定的排放标准[1].传统的均相Fenton反应体系(Fe2+/H2O2)因其强催化氧化能力广泛用于染料废水的处理,但均相反应体系中铁离子的末端分离和重复使用等方面仍存在的一些不足.因此需要选择某些合适的载体对铁离子加以固定,以改善Fenton反应体系的工艺性能.因此应用前景好的非均相UV/Fenton反应体系受到广泛关注.例如,Chen 等[2]研究以铁柱撑蛭石为催化剂的光助非均相Fenton反应体系及其对偶氮染料活性艳橙X-GN的氧化降解性能;Ai等[3]对比研究暗/光助非均相Fenton反应工艺对偶氮染料的降解性能.由于蒙脱石可以作为载体材料负载多种金属离子,所以本文拟开展铁柱撑蒙脱石催化非均相UV/Fenton反应体系对橙黄G的氧化降解机理研究,着重考察铁柱撑蒙脱石(Fe-Mt)催化剂投加量、溶液pH值、橙黄G初始质量浓度和反应温度等工艺因素对橙黄G废水脱色效果的影响.研究结果可为相关的染料废水处理和环境修复工程应用提供理论与实践依据.
1 材料与方法
1.1 试剂与仪器
本实验所采用的试剂均为分析纯,主要包括:Fe(NO3)3·9H2O (天津市大茂化学试剂厂);Na2CO3(天津市大茂化学试剂厂);NaOH(天津市大茂化学试剂厂);H2SO4(广州化学试剂厂);30% H2O2(天津市大茂化学试剂厂);橙黄G(简称OG)(上海阿拉丁试剂厂)以及去离子水.
蒙脱石为钠基蒙脱石(内蒙古).HWS-28电热恒温水浴锅(上海优浦科学仪器有限公司)、F-101型集热式恒温加热磁力搅拌器(河南巩义市英峪博研仪器厂)、紫外-可见光光光度计(UV-3802)型(尤尼克上海仪器有限公司)、X射线衍射分析仪(Bruker D8 Advance)型(德国布鲁克公司)、全自动快速比表面积及孔径分布测定仪(ASAP2020)型(美国麦克仪器公司)、傅立叶变换红外光谱仪(IR-prespige-21)型(日本岛津公司).
1.2 实验方法
1.2.1 催化剂的制备 铁柱撑蒙脱石的制备[4]:高速搅拌条件下,将适量Na2CO3固体粉末缓慢加入0.2 mol/L的硝酸铁溶液中,控制好碱/铁比(OH/Fe 摩尔比)为1.0,然后将所得到的红褐色半透明铁柱撑准备液在室温下陈化24 h.之后将适量蒙脱石加入去离子水中制成2%的粘土浆液.在保持60 ℃恒温的水浴锅中又缓慢滴入上述已陈化好的铁柱撑准备液 (按1 g蒙脱石滴加10 mmol Fe3+),持续搅拌2 h.将所得的混浊液于室温下陈化24 h,获得的陈化产物经多次(通常12次)离心-洗涤后在105 ℃下干燥至恒质量为止,再经研磨过61 μm筛便制得Fe-Mt样品,密封备用.
1.2.2 表征方法
(1)X射线衍射(XRD)分析 采用管电压40 kV、管电流为40 mA的发射源,扫描范围为2~10°、10~30°,扫描速度0.01/s.所有测试样品均为粉末样品.
(2)红外光谱(IR) 采用KBr压片法制样,将样品粉末与已烘干的KBr混合并置于玛瑙研钵中充分研磨,将其压成透明薄片用于红外光谱测试.扫描范围:4000~450 cm-1,扫描16次.
(3)材料的比表面积(BET)测定 样品在100 ℃脱气10 h脱去水分和物理吸附的其他物质,N2吸附和脱附试验的相对压力范围分别为10-3~0.995和0.995~0.010.
(4)紫外-可见光吸收分光光度法 OG溶液置于石英比色皿中,在200~600 nm范围内扫描,并记录一定吸收波长处吸收值.
1.2.3 催化氧化脱色实验 配制400 mL一定质量浓度的OG染料模拟废水置于玻璃瓶中,调节溶液pH于规定范围,加入适量的Fe-Mt催化剂.将上述溶液置于在暗箱内,避光条件下,保持一定温度磁力搅拌0.5 h,OG吸附达到平衡后再加入适量的H2O2,立即打开紫外灯并开始反应计时.间隔一定时间取样并过0.45 μm水系滤膜,并在最大吸收波长478 nm处测定OG废水的吸光度,以确定OG的残余浓度Ct.建立了OG废水的标准曲线:y=0.0296x-0.0127,其相关系数R2达到0.999 9.按下列公式(1)计算OG的去除脱色率:
E%= (C0-Ct)/C0×100,
(1)
式中,C0为染料废水中OG的初始浓度(吸光度);Ct为反应一定时间后废水中OG的残余浓度.
2 结果与讨论
2.1 铁柱撑蒙脱石的表征
2种蒙脱石在5°~7°之间都有一个衍射峰(图1),Na-Mt中d=1.25 nm和Fe-Mt中d=1.57 nm的衍射峰分别是钠基蒙脱石和铁柱撑蒙脱石的典型(001)衍射峰.蒙脱石经铁柱撑石后其d(001)值从1.25 nm增大至1.57 nm,说明铁离子的初级水解产生的较大聚合铁阳离子已进入带负电的蒙脱石层间域,导致蒙脱石层间距增大.由于铁离子水解产物为大小分布不均匀的聚合铁阳离子,造成插层不均匀,导致衍射峰的变宽[5].其他衍射峰不变,但强度有所降低,整体结构并未发生明显变化.

a:Na-Mt; b:Fe-Mt


a:Na-Mt; b:Fe-Mt
Na-Mt、Fe-Mt 样品的N2-吸/脱附等温线分别对应Brunauer吸附等温线分类中的Ⅲ、Ⅳ型.由图3、图4可以看出,Fe-Mt在低分压段(P/P0<0.2),由于N2在孔表面发生单分子层吸附,N2的吸附量随P/P0的升高呈线性增加.在0.2
0.8曲线有明显突跃,N2的吸附量突增.另外P/P0>0.5时Fe-Mt具有一个大的脱附滞后环,源于N2在孔道中的毛细凝聚,表明样品孔道较大,处于介孔范围之内[8].此外,Na-Mt 样品的孔径分布较窄,说明样品的规整程度高,而Fe-Mt的孔径分布较宽,说明铁羟基氧化物插入层的不均匀性,与前面 XRD 分析相一致.

图3 钠基蒙脱石及铁柱撑蒙脱石的N2-吸/脱附等温线
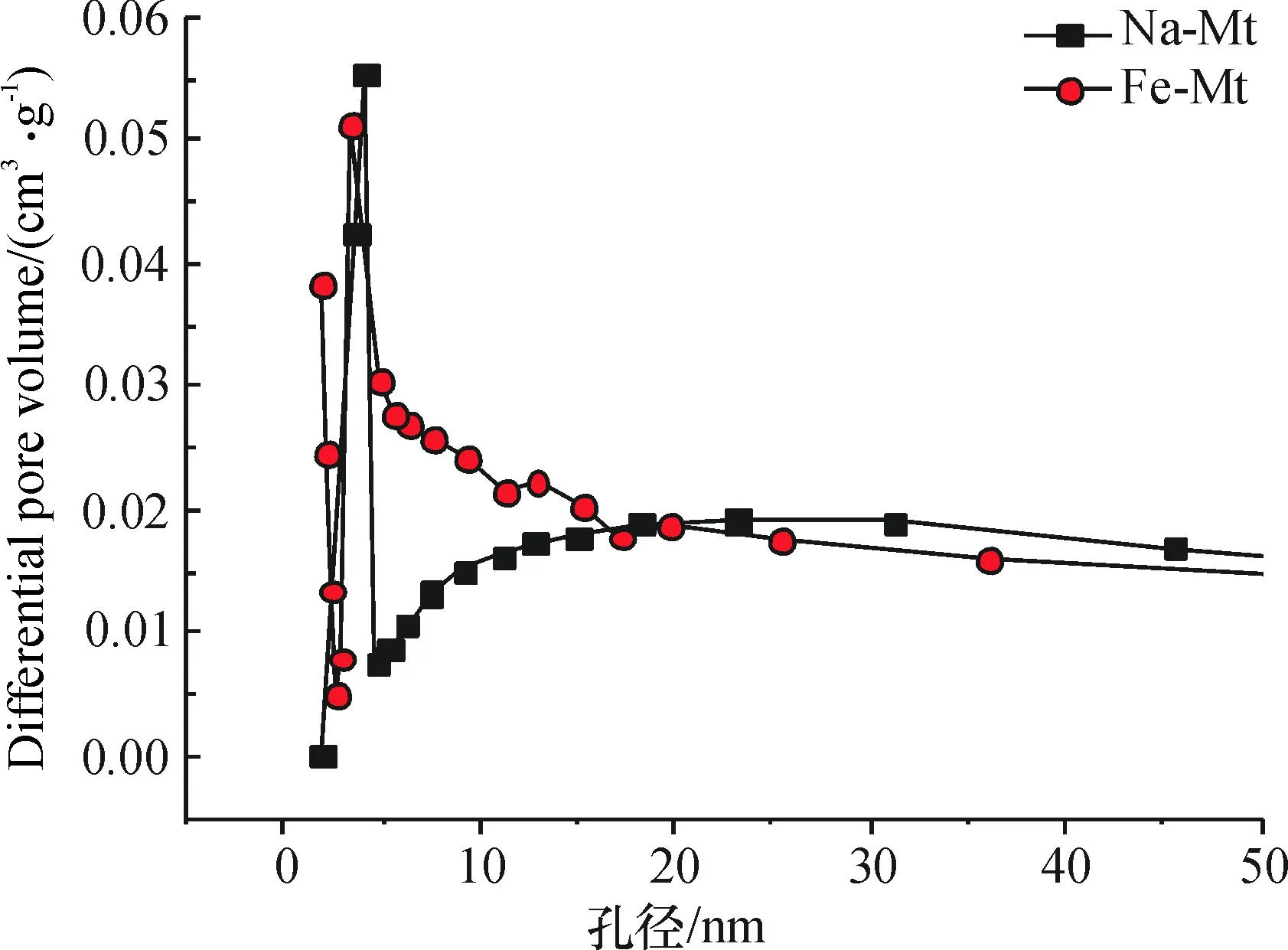
图4 Na-Mt和Fe-Mt样品的孔径大小分布曲线图
Na-Mt比表面积为10.1 cm2/g(表1),而铁柱撑蒙脱石的高达112.3 cm2/g,较之蒙脱石增大了10余倍.但蒙脱石柱撑后的孔径有所缩小.这是因为,经过负载后,聚合铁阳离子吸附在蒙脱石的孔道壁上,从而增加了孔壁厚度并阻塞了部分孔道,也造成孔径有所减小[9].

表1 Na-Mt及Fe-Mt样品的结构特性
2.2 不同工艺体系对OG模拟废水脱色的影响
考察了单独UV、UV/H2O2、UV/Fe-Mt、H2O2/Fe-Mt 和UV/H2O2/Fe-Mt 等5种情况下,各反应体系中OG脱色去除效率的差异(图5).单独紫外光的照射对OG几乎不发生脱色,表明OG在水中的稳定性好并难于挥发;在Fe-Mt和UV共存情况下的反应对OG的去除也非常有限,只是依靠 Fe-Mt 的吸附作用,20 min内可达到吸附平衡,180 min后去除率仅为2%;存在H2O2和UV情况下的工艺对OG的脱色效果也不理想,去除率为9.5%,这是因为在此条件下H2O2难以被激发,·OH的产量有限,从而使得OG的脱色率不高;而以Fe-Mt 作为催化剂,紫外光和H2O2共存时,就构成了高效的非均相UV/Fenton反应体系,因能够产生较多的·OH自由基,故对OG的脱色效果明显增强,如150 min后脱色率可达99.4%;但在无紫外光照射时,暗反应条件下非均相Fenton工艺对OG的脱色速率相对较慢,180 min后OG脱色率为89.1%.可见,铁柱撑蒙脱石催化UV/H2O2的Fenton体系是一种非常有效的光助非均相催化Fenton氧化脱色工艺,具有很理想的氧化脱色反应性能.

图5 不同体系对OG模拟废水的脱色效果
2.3 不同影响因素对OG模拟废水脱色的影响
2.3.1 初始pH对脱色的影响 图6表示OG初始质量浓度50 mg/L、Fe-Mt投加量1.0 g/L、H2O2浓度20 mmol/L和温度30 ℃等条件下,pH(3.0、4.0、5.0、6.5、8.0)对OG模拟废水氧化脱色的影响.可以看出,脱色率随pH的升高而降低,最佳初始 pH为3.0,150 min后脱色率可达到99.4%.当pH为6.5时脱色率仅为36.3%,甚至在pH为8.0时的弱碱性条件下,180 min时降解率仅为23.0%,可见,pH较高时,非均相 Fenton对OG模拟废水的脱色受到强烈抑制.因为 pH 较低值时,H2O2产生含量较高的高活性·OH[10].所以,本实验选用溶液的初始pH条件为3.0进一步深入考察Fenton反应的工艺性能.

图6 不同pH对OG模拟废水的降解效果
2.3.2 H2O2初始浓度对脱色的影响 图7表示OG的模拟废水初始质量浓度为50 mg/L、pH为3.0、Fe-Mt 投加量1.0 g/L、反应温度为30 ℃等条件下,H2O2浓度(3.0、5.0、10.0、20.0、30.0 mmol/L)对OG脱色效果的影响.当H2O2浓度从3.0 mmol/L增加至20.0 mmol/L 时,脱色率随H2O2浓度逐步增大而增加,180 min 时脱色率相应的从75.7%升至99.7%.这是因为:H2O2浓度升高使得·OH 产量增加,有利于脱色反应.但H2O2浓度若继续升至30 mmol/L,脱色率反而降低.这是因为当H2O2过量时会与·OH 反应生成·HO2活性中间体,·HO2不仅氧化性能较弱,同时又会消耗部分·OH,反应方程式如下[11]:
H2O2+ ·OH → H2O +·HO2,
(2)
·HO2+ ·OH → H2O + O2.
(3)
因此,H2O2在产生与消耗 ·OH存在一个动态平衡,只有当两者处于平衡时,才能实现催化剂的最佳催化效果.本试验确定的适宜 H2O2浓度为20.0 mmol/L.

图7 不同 H2O2 浓度对OG模拟废水的降解效果
2.3.3 Fe-Mt质量浓度对脱色的影响 图8表示OG模拟废水的初始质量浓度为50 mg/L、pH 3.0、H2O2浓度20 mmol/L和温度30 ℃等条件下,铁柱撑蒙脱石催化剂的质量浓度(0.1、0.3、0.5、1.0、1.5、2.0 g/L)对OG 脱色效果的影响.Fe-Mt质量浓度在0.1~1.0 g/L范围内OG脱色率随催化剂的用量增加而增加,因为Fe-Mt质量浓度的增加可以为H2O2提供更多的活性位点,并有利于增加·OH产量,从而提高脱色效率[12].当质量浓度高于1.0 g/L时,Fe-Mt投加量的再提高则对OG脱色不利,造成去除率反而有所降低.一方面,Fe-Mt 投加量的过多导致活性位点过量,H2O2直接发生分解产生O2, 或·OH被捕捉[13-14];另一方面,投加量过高增大光辐射的衰减速度,减少催化剂及溶液对紫外光的吸收,进而抑制·OH生成并最终影响脱色.本实验确定催化剂的适宜质量浓度为1.0 g/L.
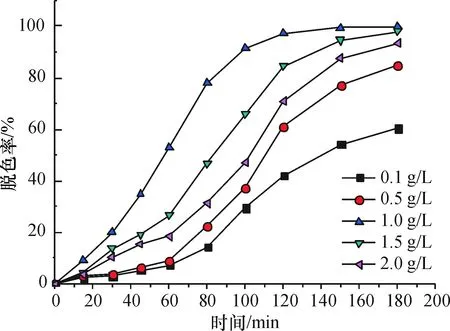
图8 不同Fe-Mt投加量对OG模拟废水的脱色率影响
2.3.4 温度对脱色的影响 图9表示OG初始质量浓度为50 mg/L、pH为3.0、H2O2浓度20.0 mmol/L和Fe-Mt 投加量为1.0 g/L等条件下,反应温度(25、30、40、50 ℃)对OG 脱色效果的影响.由图9可看出,温度对OG脱色率影响很大,随着反应温度升高,OG的脱色率明显增大.从25 ℃升高到50 ℃时,OG去除脱色率为99%的所需时间从150 min缩短至60 min.在非均相 Fenton 反应体系中,OG从液相扩散吸附到催化剂表面,才会受到·OH攻击,反应中间产物也需由表面析出,扩散到溶液中,温度升高可加促进上述吸附和解吸微界面过程[15],提高OG的脱色率.此外,Fe的溶出实验研究结果表明(数据未列出),温度在25~30 ℃,Fe溶出量很低,然而温度升高至40 ℃以上时 Fe溶出量则有明显增大,均相Fenton反应脱色贡献也就得到明显加强.

图9 不同温度对OG模拟废水溶液的脱色影响
2.4 铁柱撑蒙脱石对OG模拟废水的催化脱色性能


图10 橙黄G氧化脱色的UV-Vis光谱变化
2.5 OG模拟废水脱色的动力学
采用准一级动力学方程对脱色过程进行动力学拟合计算.图11为在温度为30 ℃、OG模拟废水初始质量浓度为50 mg/L、pH 3.0、H2O2初始浓度20.0 mmol/L、Fe-Mt投加量1.0 g/L等条件下非均相UV/Fenton反应催化氧化动力学.可以看出,光助Fe-Mt催化非均相Fenton反应对橙黄G的去除脱色遵循两阶段的准一级反应动力学,即由最初的缓慢阶段(第一阶段)和之后的快速阶段(第二阶段)构成[18-19].因为在初始阶段,Fe-Mt催化剂对OG吸附低,且有高浓度的过氧化氢存在,所以大多数产生的·OH自由基被H2O2捕获迅速消耗,而溶液相中OG周围缺少可以利用的羟自由基,从而导致OG脱色缓慢[20].但当部分过量的过氧化氢在第一阶段消耗时,之后产生的·OH不会迅速为消耗而转向攻击被吸附的OG分子,同时促进铁离子的溶出,从而实现橙黄G染料废水的第二阶段快速脱色(R2>0.95).

图11 OG非均相Fenton脱色的动力学拟合曲线
将不同工艺条件下获得的OG模拟废水的脱色率试验数据按照准一级动力学方程拟合,便得到一系列的反应常数k和相应关系数R2(表2),可以看出,铁柱撑蒙脱石能有效地催化Fenton反应对橙黄G进行氧化脱色.反应缓慢启动之后,除了自由基有效攻击OG外,中间产物则会促进铁离子的快速析出进入溶液相,导致均相作用部分的增强,从而明显提高橙黄G的脱色速率.溶液pH为3.0时可以实现铁离子的溶出,脱色表现为两阶段的准一级反应动力学过程.溶液pH高于4.0的Fenton反应对脱色减缓,除了OG的吸附减弱不利于促进氧化脱色外,铁离子几乎不能有效溶出,造成不能发挥均相Fenton作用的贡献.由此可说明Fe-Mt催化剂表面初期发生的氧化脱色的启动可对后期的快速脱色起到关键作用.

表2 不同条件下Fenton脱色动力学拟合结果Table 2 Kinetics fitting to the OG Fenton decolorization under different conditions
3 结论
铁柱撑蒙脱石具有很好的催化Fenton反应活性,故其所构成的光助非均相UV/Fenton反应体系具有很理想的氧化脱色性能;该脱色性能受到pH、H2O2浓度、催化剂投加量、反应温度以及染料橙黄G本身浓度的影响.优化条件下,即当Fe-Mt投加量为1.0 g/L、H2O2浓度为20 mmol/L、pH为3.0和反应温度为30 ℃时,该反应体系的处理脱色效果最佳,如OG浓度为50 mg/L的废水经处理180 min后脱色率可达99.7%.特别是在溶液pH较低(pH3.0)下,Fe-Mt非均相UV/Fenton反应对橙黄G废水的脱色遵循两阶段的准一级反应动力学,亦即,由最初的缓慢阶段和之后的快速阶段2部分所构成.因此,该材料可以作为一种具有很好开发前景的废水处理与环境修复材料.
参考文献:
[1] Malik P K, Saha S K. Oxidation of direct dyes with hydrogen peroxide using Ferrous ion as catalyst[J]. Separation and Purification Technology, 2003, 31(3): 241-250.
[2] Chen Q, Wu P X, Dang Z. Iron pillared vermiculite as a heterogeneous photo-Fenton catalyst for photocatalytic degradation of azo dye reactive brilliant orange X-GN[J]. Separation and Purification Technology,2010, 71(3): 315-323.
[3] Ai Ni S, Hameed B H. Heterogeneous catalytic treatment of synthetic dyes in aqueous media using Fenton and pHoto-assisted Fenton process[J]. Desalination, 2011, 269(1/2/3): 1-16.
[4] Rightor E G, Tzou M S, Pinnavaia T J. Iron oxide pillared clay with large gallery height: Synthesis and properties as a Fischer-Tropsch catalyst[J]. Journal of Catalysis, 1991, 130(1): 29-40.
[5] 袁鹏,王辅亚,肖万生, 等. 铁层离-柱撑蒙脱石的结构初探[J]. 矿物岩石,2005, 25(3): 37-40.
Yuan P, Wang F Y, Xiao W S, et al. Study on the structure of Iron-pillared montmorillonite[J]. Journal of Mineralogy and Petrology, 2005, 25(3): 37-40.
[6] 吴平霄, 张慧芬, 肖丁文, 等. 柱撑蒙脱石制备与表征[J]. 矿物学报, 1997, 17(2): 200-207.
Wu P X, Zhang H F, Xiao D W, et al. Synthesis and characterization of Pillared Montmorillonite[J]. Acta Mineralogica Sinica, 1997, 17(2): 200-207.
[7] Yuan P, Annabi-Bergayq F, Qi T,et al.A combined study by XRD, FTIR, TG and HRTEM on the structure of delaminated Fe-intercalated/pillared clay[J].Journal of Colloid and Interface Science,2008, 324(1/2): 142-149.
[8] 邴吉帅. 铈、钛改性MCM-41催化臭氧氧化水中难降解有机污染物的效能与机理[D]. 广州:华南师范大学,2012.
[9] Li L, Ye W, Zhang Q, et al. Catalytic ozonation of phenolic over cerium supported on activated carbon[J]. Journal of Hazardous Materials, 2009, 170(1): 411-416.
[10] Feng J Y, Hu X J, Polock Y. Effect of initial solution pH on the degradation of Orange II using clay-based Fe nanocomposites as heterogeneous photo-Fenton catalyst[J]. Waster Research, 2006, 40(4): 641-646.
[11] Fernandez J, Bandara J, Lopez A, et al. Photo assisted Fenton degradation of nonbiodegradable azo dye(Orange II) in Fe-free solutions mediated by cation transfer membranes[J]. Langmuir, 1995, 5: 185-192.
[12] 何立平, 杨迎春, 徐成华. 针铁矿催化降解废水中的罗丹明B[J]. 化工环保, 2008, 28(5): 369-400.
HE L P, Yang Y C, XU C H. Catalytic degradation of Rhodamine B in wastewater by goethite[J]. Environmental Protection of Chemical Industry, 2008, 28(5): 369-400.
[13] Zhang H, Fu H, Zhang D B. Degradation of C.I.Acid orange 7 by ultrasound enhanced heterogeneous Fenton-like process[J]. Journal of Hazardous Materials, 2009, 172(2/3): 654-660.
[14] Neppolian B, Park J S, Choi H. Effect of Fenton-like oxidation on enhanced oxidative degradation of para-chlorobenzoic acid by ultrasonic irradiation[J]. Ultrasonic Sonochemistry, 2004, 11(5): 273-279.
[15] Wu F, Deng N S, Hua H L. Degradation mechanism of azo dye C.I.reactive red 2 by iron powder reduction and photo oxidation in aqueous solutions[J]. Chemosphere,2000, 41(8): 1233-1238.
[16] Dulman V, Cucy-man S M, Olariu R I, et al. A new heterogeneous catalytic system for decolorization and mineralization of Orange G acid dye based on hydrogen peroxide and a macroporous chelating polymer[J]. Dyes and Pigments, 2012, 95(1): 79-88.
[17] Chen J X, Zhu L Z. Catalytic degradation of orange II by UV-Fenton with hydroxyl-Fe-pillared bentonite in water[J]. Chemosphere, 2006, 65(7): 1249-1255.
[18] Zhou T, Li Y Z, Ji J, et al. Oxidation of 4-chlorophenol in a heterogeneous zero valent iron/H2O2Fenton-like system: Kinetic, pathway and effect factors[J]. Separation and Purification Technology,2008, 62(3): 551-558.
[19] Xu L J, Wang J L. A heterogeneous Fenton-like system with nanoparticulate zero-valent iron for removal of 4-chloro-3-methyl phenol[J]. Journal of Hazardous Materials, 2011, 186(1): 256-264.
[20] Liang X L, Zhong Y H, He H P, et al. The application of chromium substituted magnetite as heterogeneous Fenton catalyst for the degradation of aqueous cationic and anionic dyes[J]. Chemical Engineering Journal, 2012, 191: 177-184.
