脐带间充质干细胞对脑梗死大鼠行为学及胆碱能的影响
2014-08-25贾芙蓉张贯石潘洪涛丁冬梅
贾芙蓉,张贯石,王 辉,潘洪涛,何 欣,张 东,丁冬梅
(1.解放军第二〇八医院 检验科,吉林 长春130062;2.吉林大学 白求恩医学部基础医学院,吉林 长春130021;3.解放军第65316部队医院;4.解放军第65571部队 卫生队)
脑梗死导致的脑部血液供应障碍、缺血、缺氧可引起脑组织坏死,会出现相应的神经功能障碍,导致行为学的改变。全部的运动神经都属于胆碱能神经。乙酰胆碱(Ach)是乙酰胆碱能神经元系统的神经递质,与胆碱能系统功能的损害程度密切相关[1]。Ach由乙酰胆碱酯酶(TChE)分解,通过Ach受体发挥生物效应。黑质多巴胺能神经元的树突或胞体含有大量TChE,能够将TChE分泌到细胞外液中。TChE直接参与植物神经功能调节、肌肉运动、大脑思维、记忆等重要功能。TChE活力有改变时,以上各组织器官功能也会改变。TChE参与细胞的发育和成熟,能促进神经元发育和神经再生。通过测定TChE和Ach的活性可反映脑内胆碱能系统的功能。
我们在体外成功培养出人脐带间充质干细胞(umbilical cord-derived mesenchymal stem cells,UC-MSCs)的基础上[2],将UC-MSCs经尾静脉注入脑梗死大鼠体内,观察大鼠行为学、脑2,3,5-氧化三苯基四氮唑(TTC)染色及胆碱能的变化。
1 材料与方法
1.1 主要试剂与仪器
2,3,5—氯化三苯基四氮唑(TTC),美国Sigma公司。乙酰胆碱酯酶(TChE)试剂盒,南京建成生物化学试剂有限公司生产,批号:2010727。乙酰胆碱(Ach)试剂盒,南京建成生物工程研究所产品,批号:20120808。考马斯亮蓝蛋白,南京建成生物化学试剂有限公司生产,批号:20100520。CO2恒温培养箱,上海申工。 YJ-1450超净工作台,苏州洁诺公司。101-1-BS-Ⅱ电热恒温鼓风干燥箱,上海跃进。4℃冰箱,星星公司。DL-5000冷冻离心机,上海菲恰尔公司。R450型酶标仪,Bio-Rad公司。天池鱼线,日本横滨产,直径0.28 mm,栓线的头端用酒精灯火焰烧,使之成球形。
1.2 实验动物
SPF级雄性SD大鼠,2-3月龄,体重250-350 g,购于吉林大学动物实验中心。实验用鼠均饲养于解放军第二〇八医院动物实验中心级洁净空调实验动物室。在(22±2)℃,湿度为(50±5)%的环境下标准鼠食喂养,饮用水为自来水。12 h光照,12 h黑暗。
1.3 实验动物的分组及模型复制
1.3.1 SD大鼠54只,随机分为3组,即脐带间充质干细胞(UC-MSCs)移植组(以下简称UC-MSCs组)、模型组、假手术组,每组18只大鼠。
1.3.2 UC-MSCs组及模型组的复制模型参照Longa等[3]方法,并改进陈佳俊等[4]的方法,栓塞大鼠右侧大脑中动脉。假手术组:仅分离颈总及颈外动脉,结扎大脑中动脉,不插入鱼线。
1.4 MCAO模型大鼠标准检测
于大鼠造模清醒后30 min,根据Persson[5]的方法对大鼠进行神经病学分级,分级标准如下:0级:正常;Ⅰ级:对侧前肢屈曲;Ⅱ级:提尾时,对侧前肢抓力减弱;Ⅲ级:自主运动无方向性,提尾时向对侧旋转;Ⅳ级:自主运动时,向对侧旋转。选择Ⅲ级及以上模型大鼠进行治疗。各组大鼠在移植后第10天进行行为功能检查。
1.5 方法
1.5.1 UC-MSCs的原代培养、传代、收集细胞 按照本实验室实验方法进行[2]。
1.5.2 细胞移植 MCAO模型建立后24 h,将UC-MSCs组制成单细胞悬液,经大鼠尾静脉UC-MSCs组缓慢注入含有细胞1×106/ml生理盐水溶液1 ml,脑梗死组注入生理盐水1 ml。
1.5.3 移植后脑梗死模型大鼠的行为学与运动功能观察 各组大鼠于造模后24 h、尾静脉注射后第10天以平衡木实验检测大鼠的运动功能。采用平横木行走实验(Beam walking Test,BWT)[6],即大鼠于200 cm×10 cm×1 cm横木。距地面高40 cm,以10°角度向下爬行,在造模前训练3 d,连续3次评分达9分方进入本试验。
评分标准如下:在30 s内爬过横木,左侧后肢少于2次内滑倒计9分;在30-90 s内爬过横木,左侧后肢少于2次滑倒计8分;在90s内爬过横木,长于50%距离正确用左侧后肢爬行计7分;短于50%距离正确用左侧后肢爬行计6分;左侧后肢能置于横木上,向前爬行时均下滑计5分;在90 s内爬过横木,左侧后肢不能置于横木上计4分;90 s内爬过30%横木计3分;90 s内爬过30%横木,不能在横木上停留90 s计2分;爬过短于30%横木,能在横木上停留90 s计1分;爬过短于30%横木,不能在横木上停留90 s计0分。
1.5.4 TTC染色观察脑组织变化 分别在移植术后第20天每组随机抽取一只处死,全部动物均按规定断头,脑组织取出后即置于-20℃低温冰箱快速冷冻后,从前脑额级开始行冠状切片,由前向后间隔切取组织片5片,每片约2 mm,置2%TTC生理盐水中37℃孵育30分钟,待显色完全,取出中间脑片在自然光线下数码相机照相。
1.5.5 TChE活力的测定和Ach含量的测定 尾静脉注射UC-MSCs第10天,行为学检测结束后,每组每次取9只大鼠腹主动脉采血并断头取其治疗前、后脑组织。血液经肝素抗凝(每亳升血液含20单位肝素),离心分离血浆。断头处死大鼠,在冰台上取出大鼠海马,快速分离双侧海马结构制备匀浆,TChE试剂盒、Ach试剂盒分别测定脑组织和血浆中乙酰胆碱含量和乙酰胆碱酯酶活性,蛋白测定采用考马斯亮蓝法。
1.6 统计学处理

2 结果
2.1 行为学,术后动物行为表现
大鼠造模清醒后30 min,模型组大鼠头偏向患侧,患侧眼裂变窄,患侧肢体无力,提尾时向对侧旋转。假手术组未见行为异常。移植第10天,除假手术组外,各组大鼠神经功能评分逐渐增高,第10天MSC组与模型组的评分比较差异有统计学意义(P<0.05)。三组比较结果见表1。
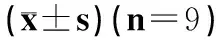
表1 各组大鼠平衡木实验运动功能评分结果
注:与假手术组相比,*P<0.01;与模型组相比,▲P<0.05
2.2 TTC染色
TTC染色大鼠正常脑组织染色呈红色,梗死区呈白色。用AutoCAD软件计算和测定脑组织梗死面积和总脑片面积,以脑梗死面积占总脑片面积百分数(%)表示,见图1、图2。梗死面积比较采用t检验,治疗后20天UC-MSCs组与造模后24 h模型组相比,P<0.01,结果见表2。

注:箭头所指位置为脑梗死区域
2.3 TChE和Ach测定
UC-MSCs移植对脑梗死大鼠海马区和血浆中TChE和Ach均有影响。结果见表3,UC-MSCs组与模型组相比,海马TChE活性明显增高,P<0.05;UC-MSCs组与模型组相比,海马Ach活性明显增高,P<0.05。

图2 UC-MSCs治疗20天后脑梗死大鼠脑组织TTC染色,×200

组别脑梗死面积模型组24 h25.30±7.6UC-MSCs组治疗20天0.55±0.36*
注:与模型组24 h脑梗死面积相比,*P<0.01


分组乙酰胆碱酯酶(TChE)乙酰胆碱(Ach)假手术组1.42±0.15 20.58±1.81模型组1.00±0.17*16.67±1.75*UC-MSCs组1.38±0.20▲ 20.06±1.78▲
注:与假手术组相比,*P<0.05;与模型组相比,▲P<0.05
表4表明,UC-MSCs组与模型组相比,血浆TChE活性明显增高,P<0.05;UC-MSCs组与假手术组相比,P>0.05 ;UC-MSCs组与模型组相比,血浆Ach活性明显增高,P<0.05。


分组乙酰胆碱酯酶(TChE) 乙酰胆碱(Ach)假手术组6.74±0.52 11.31±1.31模型组5.62±0.56* 8.02±1.35*UC-MSCs组7.03±0.69▲ 12.06±1.65▲
注:与假手术组相比,*P<0.05;与模型组相比,▲P<0.05
3 讨论
外周神经和中枢神经组织有一定的再生能力,这些神经纤维或细胞体内部都含有高水平的TChE。神经损伤早期TChE在神经元胞体和近端轴突内的活性增强。TChE可能参与胆碱能神经递质的传递,还具有调节和促进神经组织的发育和神经再生的神经营养因子样作用。
神经细胞死亡导致的神经功能缺陷,至今尚无有效的治疗方法。间充质干细胞是一类起源于中胚层的成体干细胞,可以从骨髓、脂肪、胎盘、脐带血以及脐带中分离出来,具有自我更新、高度增殖和多向分化的潜能。人脐带间充质干细胞比来源于骨髓、胎盘及其他组织的MSCs更具有优势,如脐带的来源不受伦理争议,成本较低;UC-MSCs具有低免疫原性、免疫调节、基质支持、旁分泌、迁移和基因稳定性,故具有良好的临床治疗潜能。目前,已有多种方法成功地将UC-MSCs诱导为神经元和胶质细胞,还可分化为特定类型的神经元细胞[7-10]。这种潜能,使其具有作为种子细胞应用于修复或替代受伤和病变的神经组织,从而为脑梗死等一些神经系统难治性疾病的治疗提供了一个新的途径。
本研究结果显示,脑梗死大鼠海马、血浆内TChE和Ach活性下降,提示存在胆碱能系统异常。UC-MSCs经静脉移植后20天,可改善脑梗死大鼠行为功能,增强海马TChE和Ach活性,说明UC-MSCs移植能明显改善胆碱能系统的功能和行为能力,达到治疗脑梗死的目的,这可能与其提高胆碱能神经系统的活性和UC-MSCs在脑内存活并分化为新生的神经元有关。有报道,bFGF治疗血管性痴呆大鼠,痴呆组大鼠海马TChE活性较假手术组明显升高,治疗组大鼠海马TChE活性较痴呆组降低[11]。大鼠血管性痴呆与脑梗死模型同样引起神经元受损,但TChE变化不同,相关机理待进一步研究。
有研究发现体外培养的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够分泌多种白细胞介素、巨噬细胞克隆刺激因子、Flt-3配体及干细胞因子等[12],这些细胞因子可促进鼠类海马神经前体细胞的生存、生长及分化[13]。体内实验研究显示BMSCs还可增加脑源性神经营养因子(BDNF)、神经生长因子(NGF)、血管内皮生长因子(VEGF)的分泌[14]。这些营养因子促使宿主内源性的神经干细胞或神经前体细胞向成熟神经元分化,其中包括胆碱能神经元,从而使Ach水平增加, TChE活性上调。因此,BMSCs移植改善胆碱能神经系统功能的原因可能与这些因子的分泌有关,UC-MSCs移植是否有相同作用,其有关机理有待进一步研究。
参考文献:
[1]邢宏义,孙圣刚.Alzheimer 病的胆碱能系统研究进展[J].国外医学 神经病学神经外科学分册,2000,27(5):262.
[2]贾芙蓉,何 欣,王 辉,等.脐带间充质干细胞的培养及生物学特性[J].中国实验诊断学,2012,16(11):1984.
[3]Longa EZ,W einstein PR,Carlson S,et a1.Reversible middle cerebral artery occlusion without craniotomy in rats [J].Stroke,1989,20(1):84.
[4]陈佳俊,石岩殊,韩雪梅,等.线栓法大鼠局灶性脑缺血模型(PMCAO)的实验研究[J].吉林医学,2004,25(10):16.
[5]Burt RK,Traynor AE.SLE-hematopoietic stem cell transplantation for systemic lupus erythematosus[J].Ar.thritis Res Ther,2003,5(5):207.
[6]Feeney DM,Gonzalez A,Law WA.Amphetaminc,haloperidol,and expefience interatc to affect rate of recovery after motor codex injury [J].Science,1982,217:855.
[7]Weiss ML,Medicetty S,Biedsoe AR,et al.Human umbillcal cord matrix stem cells:preliminary characterization and effect of transplantation in a rodentmodel of Parkinsonp's disease[J].Stem Cells,2006,24(3):781.
[8]Ma L,Feng XY,Cui BL,et al.Human umbilical cord Wharton's Jelly-derived mesenchymal stem cells differentiation into nerve like cells[J].Chin Med,2005,118(23):1987.
[9]Koh SH,Kim KS,Choi MR,et al.Imp lantation of human umbilical cord-derived mesenchymal stem cells as a neuroprotective therapy for ischemic stroke in rats[J].Brain Res,2008,12(29):233.
[10]Fu YS,Cheng YC,Lin MY,et al.Conversion of human umbilical cord mesenchymal stem cells in Wharton's jelly to dopaminergic neurons in vitro:potential therapeutic app lication for Parkinsonism[J].Stem Cells,2006,24(1):115.
[11]林 航,叶建新,穆军山,等.bFGF对血管性痴呆大鼠海马乙酰胆碱含量及胆碱酯酶活性的影响[J].脑与神经疾病杂志,2009,17(5):359.
[12]Majumdar MK,Thiede MA,Mosca JD,et a1.Phenotyplc and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells[J].J Cell Physiol,1998,176(1):57.
[13]Suzumura A.The cytokines and their functions on neural cells[J].Tanpakushitsu Kakusan Koso,1995,40(6):691.
[14]Li Y,Chen J,Chen XG,et a1.Human marrow stromal cell therapy for stroke in rat:Neurotrophins and functional recovery[J].Neurology,2002,59(4);514.
