鞘内注射右美托咪定对瑞芬太尼诱发的大鼠术后痛觉过敏的影响
2014-08-15张粒子徐世元
张粒子,张 婧,徐世元
0 引言
瑞芬太尼是一种人工合成的新型超短效阿片类药物,具有起效快、镇痛作用强、消除半衰期短等优点,通过血浆和组织中非特异性酯酶代谢而不依赖于肝肾,在临床麻醉中得到广泛应用。在近年来临床应用中发现,瑞芬太尼在停药后可出现阿片类药物诱发的痛觉过敏(Opioid-induced hyperalgesia,OIH)[1-3],加重术后疼痛程度,影响术后急性疼痛的治疗效果。目前OIH发生机制尚未完全明了,临床亦尚未制定安全有效的防治方案。
右美托咪定(Dexmedetomidine,DEX)为高选择性α2肾上腺素受体激动剂,有良好的镇静、镇痛作用,已广泛用于ICU内话不着的镇静。有研究报道,DEX可增强阿片类药物的镇痛作用,但关于其鞘内注射是否可防治瑞芬太尼诱发的术后痛觉过敏的研究为数不多。本研究拟建立瑞芬太尼致大鼠切口痛痛觉过敏模型,探索鞘内预先给予DEX对术后痛觉过敏的影响。
1 材料与方法
1.1 实验动物及分组 健康雄性Sprague Dawley大鼠,体重200~250 g,清洁级,由南方医科大学实验动物中心提供(SCXK2011-0015)。实验前适应性饲养1周,室温(24±2)℃,光照时间为8∶00~20∶00,自由摄取食物和饮水。随机将大鼠分为5组,每组12只。各组操作及药物泵注在3%七氟醚麻醉下进行。对照组(C组)鞘内注射生理盐水10 μL,30 min后尾静脉泵注生理盐水0.1 mL/(kg·min)持续2 h,余不做任何处理;单纯切口组(I组)及瑞芬太尼+切口痛组(R组)行右后足切开,术前1 h鞘内注射生理盐水10 μL,术前30 min分别开始尾静脉泵入生理盐水0.1 mL/(kg·min)或瑞芬太尼1 μg/(kg·min)持续2 h;DEX(0.1 μg/kg)+瑞芬太尼+切口痛组(D1组)及DEX(1 μg/kg)+瑞芬太尼+切口痛组(D2组)在术前1 h鞘内注射10 μL相应剂量的DEX,其余处理与R组相同。各处理组实验大鼠模型成功建立后,随机分成2组,分别测定并计算出术前24 h及停药后1、3、6、24、48 h(T0~T5时点)右后足的机械缩足阈值(Paw withdrawal mechanical threshold,PMWT)及热缩足反射潜伏期(Paw withdrawal latency,PWL)。
1.2 试剂及器械 七氟醚(上海恒瑞医药公司,批号:H20070172),盐酸右美托咪定注射液(江苏恒瑞医药股份有限公司,批号:H20090248,0.1 μg/kg及1 μg/kg根据大鼠体重生理盐水稀释至10 μL),注射用盐酸瑞芬太尼(宜昌人福药业有限责任公司,批号:H20030197,溶于生理盐水至10 μg/mL)。微量进液器,微量注射泵,von Frey filaments(Stoelting公司),热辐射刺激仪(Model390,IITC公司)。
1.3 大鼠切口痛模型的制备 按Brennan法[4]建立大鼠切口痛模型。3%七氟醚麻醉大鼠,右后足碘伏消毒,于足底近足跟0.5 cm处向趾部纵行切开一个长约1 cm的切口,用眼科镊挑起足底肌肉纵向切开,保持肌肉起止及附着完整,按压止血后用5-0丝线缝合皮肤。术后每日伤口涂抹金霉素软膏预防感染,剔除出现切口感染或行为学明显异常的大鼠。大鼠鞘内注射方法:背部备皮后常规消毒,以L4~5间隙为穿刺点。用30 G微量进液器从间隙正中穿刺,当针尖进入蛛网膜下腔时,可观察到明显的快速甩尾反应,缓慢注入相应药物或生理盐水。进液器在原位固定数秒后缓慢移除,以防止药液外漏。
1.4 行为学检测 测量前3 d每日将大鼠置于有机透明玻璃箱中适应2 h,所有测量于8∶00至18∶00间完成。
使用von Frey filaments(0.4~15 g)测量PMWT,于术前24 h及瑞芬太尼停药后各时点测定。实验前使之于箱中适应20 min,当大鼠自主活动停止、较安静时,以不同力度的von Frey filaments垂直刺激大鼠足底切口周围,持续6~8 s。大鼠在刺激时间内快速缩足、舔舐或喊叫记为阳性,自主活动引起的缩足反应除外。首先从2 g开始,如该力度刺激为阴性反应时,给予相邻递增力度刺激;如出现阳性反应,则给予相邻递减力度刺激。如此反复进行,直至出现第一次阴性与阳性(反之亦可)反应的交叉,再继续测定4次,每次刺激至少间隔15 s。最大力度为15 g,超过此值记为15 g,以up-down法[5]计算PMWT。
按照Hargreaves法[6]进行热痛阈测定,于术前24 h及瑞芬太尼停药后各时间点使用热辐射刺激仪测定右足热痛觉阈值。测量前将大鼠置于透明玻璃箱中适应20 min,待大鼠安静后使用热辐射刺激仪照射大鼠右后足底紧贴玻璃板部位。调节光照强度,使基础PWL为12~15 s,固定该光照强度进行后续测量。记录照射开始至大鼠出现明显缩足或舔足的时间,截止时间为20 s以防止损伤。各时点每只大鼠测定3次,取其平均值,每次测定间隔5 min。

2 结果
2.1 各组大鼠PMWT变化 术前各组大鼠PMWT差异无统计学意义(P>0.05)。I组的PMWT在T1~T4时点较术前均显著降低,在T1点由术前(14.50±1.23)g降至(4.41±0.95)g,且低于C组相应的时点,差异有统计学意义(P<0.001),至T5时点恢复术前水平。R组在T2~T5时点PMWT均显著低于I组,于T3降至最低(3.46±0.71)g,在T5点(停药后48 h)仍低于术前。D1、D2组在T1、T2时点显著高于I组,而D2组在T3时点亦显著高于I组,差异均有统计学意义(P<0.05);在T4、T5时点,D1、D2组与I组间无显著差异。D1、D2组在T1~T5时点的PMWT值较R组均明显升高,差异有统计学意义(P<0.05)。D2组大鼠的PMWT在T1~T3时点均显著高于D1组,差异有统计学意义(P<0.01),其余时点无显著差异。
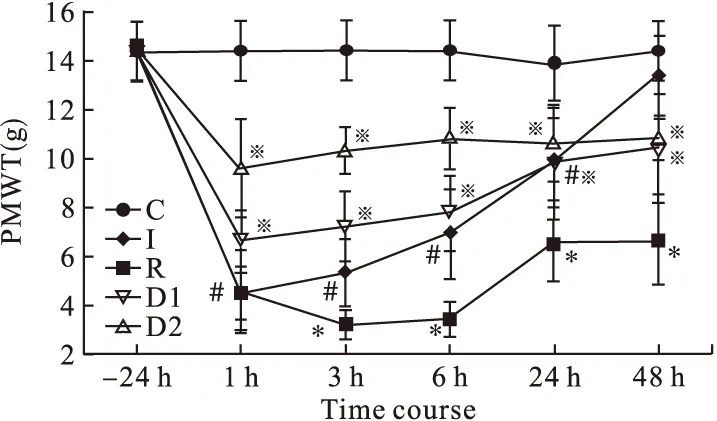
图1 各组大鼠不同时点右后足PMWT(n=6)

图2 各组大鼠不同时点右后足PWL(n=6)
2.2 各组大鼠PWL变化 术前各组大鼠PWL差异无统计学意义。I组停药后大鼠右后足的PWL均比术前降低,在T3时点降至最低(9.62±1.17)s,且在T1~T5各时点均显著低于C组,差异有统计学意义(P<0.05);R组在T1~T4各时点PWL均显著低于I组,差异有统计学意义(P<0.05),在T3时点降至最低值(5.21±0.58)s,至停药后48 h仍低于术前;D1、D2组大鼠的PWL在T1~T5各时点均高于R组,差异有统计学意义(P<0.05);D2组大鼠在T1、T2时点的PWL显著高于I组,差异有统计学意义(P<0.05);且在T2~T4时点,D2组大鼠的PWL较D1组显著增高,差异有统计学意义(P<0.05),而在T1、T5时点,D1、D2组比较差异无统计学意义。
3 讨论
近十年来,镇痛药物及技术在不断地发展进步,然而术后急性疼痛的治疗效果,尤其是患者对治疗的满意度并未随之而提高,其中术后痛觉过敏是影响术后镇痛治疗的主要原因之一。术后痛觉过敏包含神经病理性、炎性痛觉过敏及OIH等成分,其不同于一般生理性疼痛,表现为患者的痛觉阈值下降,亦可出现疼痛过敏的范围扩大,增加术后镇痛药的消耗量及患者心理、生理应激,影响术后恢复。阿片类药物为疼痛治疗中的经典药物,而人类及动物实验研究均发现,阿片类药物可反常性地引起痛觉敏感性的增高及疼痛区域的扩大[7-8]。OIH的产生与阿片类药物的药代动力学特点、使用剂量及疗程有关,大剂量、短时间使用短效阿片类药物为易发因素[9-10]。瑞芬太尼为超短效的阿片类药物,因而停药后可引起痛觉过敏加重术后疼痛。而脊髓是痛觉过敏形成的关键部位[11],故本研究采用鞘内注射的方式,观察DEX在脊髓水平对瑞芬太尼引起大鼠术后疼痛的作用。
大鼠足底切口痛模型为研究术后疼痛的经典模型,术后大鼠出现自发性疼痛和痛阈的降低,痛觉敏感性增高,与临床上术后疼痛的表现相似。本研究采用此模型,并在七氟醚吸入麻醉下予以瑞芬太尼尾静脉持续泵注,与临床手术过程相类似。参考同类研究[8],本实验瑞芬太尼静脉输注剂量为1 μg/(kg·min),相对应于人的剂量为0.16 μg/(kg·min),持续泵药2 h,与临床使用情况相近。本研究结果表明,单纯切口组大鼠在停药后1 h及3 h时,机械性痛阈及热痛阈分别降至最低,停药后24 h仍低于术前。而瑞芬太尼组大鼠停药后的机械性痛阈及热痛阈较单纯右足切口组进一步降低,且最低值出现在停药后3 h,持续至停药后48 h,表明持续输注瑞芬太尼后,可引起较强的术后痛觉过敏,加重单纯切口引起的痛觉过敏,且延长术后疼痛持续的时间,此结果与其他研究结果一致[12]。
NMDA受体拮抗剂是研究最多的防治OIH的药物,多数动物实验及临床研究表明可减轻OIH[13-14]。但NMDA受体拮抗剂如氯胺酮有幻觉、躁动、拟精神病症状、认知功能障碍等不良反应。亦有研究发现,钙通道阻断剂可防治术后痛觉过敏[15],但其药理作用较宽泛,不适合临床用于痛觉过敏的防治。DEX是一种新型的高选择性α2肾上腺素受体激动剂,具起效快、作用时间短、无呼吸抑制等优点,并可维持术中的血流动力学稳定[16-17]。DEX与阿片类药物合用可产生协同的抗伤害效应[18],可减少围术期阿片类药物的使用量,对于OIH亦有显著的抑制作用[19-21]。与氯胺酮比较,DEX在有效抑制痛觉过敏的同时,术后不良反应的发生率较低[19]。多数临床研究在麻醉诱导前后静脉注射DEX[20,22-23],亦有学者选择手术结束前给药[24],剂量于0.2~1.0 μg/kg范围内对瑞芬太尼诱发的痛觉过敏均有良好的抑制作用。动物实验中,DEX在静脉、腹腔、皮下等多种给药方式下均表现出良好的预防痛觉过敏的作用[7],但鲜有报道鞘内注射DEX对OIH的作用。有学者发现,鞘内注射0.75 μg/kg及1.5 μg/kg的DEX,对单纯切口引起的急性疼痛有良好效果,但两个剂量间差异无统计学意义[25]。当与氟烷联合应用时,鞘内注射1~3 μg的DEX可完全抑制术后疼痛大鼠脊髓浅层的Fos蛋白生成[26]。参考以上研究及结合预实验结果,本研究选择0.1 μg/kg及1 μg/kg两个剂量鞘内注射,观察DEX对瑞芬太尼诱发的术后痛觉过敏的作用。
本研究结果表明,鞘内注射DEX可减轻瑞芬太尼诱发的术后切口旁组织痛觉过敏程度,高剂量DEX效果明显优于低剂量组,至停药后48 h机械痛阈及热痛阈均高于瑞芬太尼组。DEX的消除半衰期约为2 h,而本研究结果显示,鞘内注射2 h后,机械痛阈及热痛阈依然高于瑞芬太尼组,表明DEX减轻痛觉过敏的作用并非单纯的镇痛作用,而与其对OIH的预防和缓解作用有关。预先给予DEX的大鼠在停药48 h时PMWT虽高于R组,但仍低于I组,而相同时点PWL与I组无明显差异,表明大鼠机械性痛阈的恢复滞后于热痛阈的恢复。原因可能为机械性痛及热痛分别通过不同通路上传至中枢,亦可能说明DEX虽可缓解痛觉过敏的程度,无法加快痛觉过敏的消退。
DEX防治术后痛觉过敏的机制尚未完全明确。Liu等[27]认为,DEX可抑制传入突触末端释放谷氨酸、P物质、降钙素基因相关肽等兴奋性神经递质,从而发挥抗伤害性刺激效应。Faber等[28]发现,DEX可选择性抑制NMDA受体介导的高强度兴奋性突触后电位及低强度突触后电位,从而抑制A和C初级传入纤维介导的突触传递,产生抗伤害性作用。DEX亦被证实可通过抑制脊髓NMDA受体NR2B亚基的磷酸化[7]抑制OIH。此外,多个研究尚发现α2-AR激动剂具有神经保护作用[29-30],可能经此减少手术刺激导致的神经细胞凋亡或死亡,从而减轻痛觉过敏程度。
综上所述,本研究结果表明,静脉输注瑞芬太尼可引起大鼠术后痛觉过敏,增加疼痛程度并延长疼痛持续的时间。预先鞘内注射DEX可有效缓解瑞芬太尼诱发的大鼠术后痛觉过敏,对热痛觉过敏的抑制程度稍优于机械性痛觉过敏,且与剂量有相关性。
参考文献:
[1] Angst MS,Koppert W,Pahl I,et al.Short-term infusion of the μ-opioid agonist remifentanil in humans causes hyperalgesia during withdrawal[J].Pain,2003,106(1):49-57.
[2] 吴廷丽,雷洪伊,张庆国,等.瑞芬太尼对切口痛大鼠术后步态的影响[J].实用医学杂志,2012,28(9):1429-1431.
[3] 麻姗姗.帕瑞昔布钠预防瑞芬太尼痛觉过敏的临床观察[J].中国医师杂志,2012,14(4):549-551.
[4] Brennan TJ,Vandermeulen EP,Gebhart GF.Characterization of a rat model of incisional pain[J].Pain,1996,64(3):493-502.
[5] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods,1994,53(1):55-63.
[6] Hargreaves K,Dubner R,Brown F,et al.A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77-88.
[7] Zheng Y,Cui S,Liu Y,et al.Dexmedetomidine prevents remifentanil-induced postoperative hyperalgesia and decreases spinal tyrosine phosphorylation of N-methyl-d-aspartate receptor 2B subunit[J].Brain Res Bull,2012,87(4-5):427-431.
[8] 雷洪伊,蔡清香,张鸿飞,等.静脉输注瑞芬太尼对大鼠术后机械性痛阈的影响[J].实用医学杂志,2010,(7):1134-1136.
[9] Ishida R,Nikai T,Hashimoto T,et al.Intravenous infusion of remifentanil induces transient withdrawal hyperalgesia depending on administration duration in rats[J].Anesthe Anal,2012,114(1):224-229.
[10]黄辉,刘德昭.术前应用普瑞巴林对瑞芬太尼致术后痛觉过敏的影响[J].实用医学杂志,2012,28(5):801-804.
[11]Chu LF,Angst MS,Clark D.Opioid-induced hyperalgesia in humans:molecular mechanisms and clinical considerations[J].Clin J Pain,2008,24(6):479-496.

[13]吴晓丽,马正良,顾小萍.氯胺酮预防瑞芬太尼痛觉过敏的实验研究[J].国际麻醉学与复苏杂志,2010,31(2):115-122.
[14]Gu X,Wu X,Liu Y,et al.Tyrosine phosphorylation of the N-Methyl-D-Aspartate receptor 2B subunit in spinal cord contributes to remifentanil-induced postoperative hyperalgesia:the preventive effect of ketamine[J].Mol Pain,2009,5:76.
[15]Wang YX,Pettus M,Gao D.Effects of intrathecal administration of ziconotide,a selective neuronal N-type calcium channel blocker,on mechanical allodynia and heat hyperalgesia in a rat model of postoperative pain[J].Pain,2000,84:151-158.
[16]Yang B,Kang H,Si Y,et al.Perioperative applications of dexmedetomidine:from bench to bedside[J].J Clin Anesthesiol,2011,27(10):1034-1040.
[17]王雄伟,陈晖.瑞芬太尼复合右美托咪定在心脏手术中的麻醉效果及对患者血流动力学的影响[J].实用药物与临床,2013,16(9):799-801.
[18]Fairbanks CA,Stone LS,Wilcox GL.Pharmacological profiles of alpha 2 adrenergic receptor agonists identified using genetically altered mice and isobolographic analysis[J].Pharmacol Ther,2009,123(2):224-238.
[19]Belgrade M,Hall S.Dexmedetomidine infusion for the management of opioid-induced hyperalgesia[J].Pain Med,2010,11(12):1819-1826.
[20]Lee C,Kim YD,Kim JN.Antihyperalgesic effects of dexmedetomidine on high-dose remifentanil-induced hyperalgesia[J].Korean J Anesthesiol,2013,64(4):301-307.
[21]王小慧,王俊.瑞芬太尼诱发痛觉过敏的定量感觉测定及右美托咪定的预防作用[J].实用药物与临床,2012,15(11):701-703.
[22]张卫,周立君,阚全程.不同剂量右美托咪定与小剂量氯胺酮预防瑞芬太尼复合麻醉后痛觉过敏的效果比较[J].临床麻醉学杂志,2013,29(5):435-438.
[23]孙静,吴斌,胡衍辉,等.右美托咪定对瑞芬太尼诱发痛觉过敏的影响[J].临床麻醉学杂志,2013,29(4):356-358.
[24]涂祈国,伍小敏,吴跃.右美托咪定对全麻后瑞芬太尼急性痛觉过敏的影响[J].全科医学临床与教育,2012,10(3):265-266,270.
[25]李雄娟,黄焕森,陈海铭.右美托咪定鞘内注射对大鼠急性疼痛行为及脊髓GIRK2表达的影响[J].广东医学,2013,34(12):1816-1818.
[26]Shimode N,Fukuoka T,Tanimoto M,et al.The effects of dexmedetomidine and halothane on Fos expression in the spinal dorsal horn using a rat postoperative pain model[J].Neurosci Lett,2003,343(1):45-48.
[27]Liu L,Ji F,Liang J,et al.Inhibition by dexmedetomidine of the activation of spinal dorsal horn glias and the intracellular ERK signaling pathway induced by nerve injury[J].Brain Res,2012,1427:1-9.
[28]Faber ESL,Chambers JP,Evans RH.Depression of NMDA receptor-mediated synaptic transmission by four a2 adrenoceptor agonists on the in vitro rat spinal cord preparation[J].Br J Pharmaco,1998,124:507-512.
[29]Sanders RD,Sun P,Patel S,et al.Dexmedetomidine provides cortical neuroprotection:impact on anaesthetic‐induced neuroapoptosis in the rat developing brain[J].Acta Anaesthesiol Scand,2010,54(6):710-716.
[30]Dahmani S,Rouelle D,Gressens P,et al.Characterization of the postconditioning effect of dexmedetomidine in mouse organotypic hippocampal slice cultures exposed to oxygen and glucose deprivation[J].Anesthesiology,2010,112(2):373-383.
