FH/Wjd大鼠酒精性肝损伤模型探讨
2014-08-15张彦芬秘尧何奇龙王宏涛
张彦芬,秘尧,何奇龙,王宏涛
(河北以岭医药研究院,石家庄 050035)
FH/Wjd大鼠是纽约卫生中心 W.Jean Dodds 教授将远交系Wistar大鼠近亲繁殖了 19 代得到的,这个品系的大鼠具有遗传性5-HT功能低下和大量自主饮酒的特点[1]。北京大学中国药物依赖性研究所于2007年将FH/Wjd大鼠引入我国并成功繁殖,是我国第一个先天嗜酒的大鼠模型,同时也是一个先天抑郁症的模型。目前主要用于精神依赖物质及其戒断的研究。我们根据其嗜酒特性,观察了长期饮酒后FH/Wjd肝脏病变相关指标,探讨其作为肝脏损伤动物模型的可行性。
1 材料和方法
1.1 材料
1.1.1 动物
SPF级FH/W jd大鼠36只,雌雄各半,12~16周龄。雄性体重280~320 g,雌性体重160~200 g。来源于北京大学医学部实验动物科学部[SCXK(京)2011-0012]。动物饲养于河北省中西医结合医药研究院新药评价中心[SYXK(冀)2009-0033],光照12h/d,温度20~25℃,相对湿度40%~70%。
1.1.2 主要试剂
无水乙醇购自天津市大茂化学试剂厂。丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、甘油三酯(TG)、总胆固醇(CHO)生化检测试剂盒购自北京九强。组织TG试剂盒购自北京普利莱基因技术有限公司。组织谷胱甘肽(GSH)试剂盒购自南京建成生物工程研究所。PPARα一抗购自Abcam美国公司。
1.2 方法
1.2.1 造模方法[2]
将36只大鼠单笼饲养,按体重随即分为2组,即饮水组和饮酒组。饮水组每日自由摄取无菌水,饮酒组自由饮用15%乙醇溶液,持续16周。每周2次监测饮酒组大鼠乙醇摄入量,计算公式如下(ME为纯乙醇摄入量,mE为乙醇溶液摄入量,CE为乙醇浓度,ρE为乙醇密度,ρW为水密度,BW为体重):
1.2.2 指标检测
10%水合氯醛麻醉,腹主动脉取血,4℃、3000 r/min转离心10 min,分离血清,全自动生化分析仪检测血清ALT、AST、TBIL、TG、CHO。取肝脏组织约100 mg,70%乙醇固定,制成单细胞悬液,碘化丙啶染色,Epics XL流式细胞仪检测,用cxp Analysis软件分析细胞凋亡率。取肝脏组织200 mg,制备组织匀浆,检测肝脏匀浆中TG、GSH。取肝脏组织约100 mg,Western法检测肝脏组织过氧化物酶体增殖物激活受体α[3,4](peroxisome proliferator-activated receptor alpha, PPARα)蛋白表达。留取部分肝脏甲醛固定,石蜡包埋,HE染色,观察肝脏病理组织学改变。
1.2.3 统计方法

2 结果
2.1 血清生化
雄性大鼠饮酒组与饮水组相比,TBIL与TG明显升高,且有统计学差异(P<0.05或P<0.01);转氨酶及CHO略有降低,但无统计学差异。雌性大鼠饮酒组与饮水组相比,除TBIL与TG明显升高外(P<0.05或P<0.01),ALT、CHO降低更为明显,且有统计学差异(P<0.05)。见表1、表2。

表1 酒精摄入对雄性FH/Wjd大鼠血清生化指标的影响±s,n=9)

表2 酒精摄入对雌性FH/Wjd大鼠血清生化指标的影响±s,n=9)
2.2 肝组织生化
雌、雄大鼠饮酒组与饮水组相比,肝组织匀浆液中TG含量均明显升高,且有统计学差异(P<0.01);GSH含量有降低趋势,但未见统计学差异。见表3、表4。

表3 酒精摄入对雄性FH/Wjd大鼠肝组织生化指标的影响±s,n=9)

表4 酒精摄入对雌性FH/Wjd大鼠肝组织生化指标的影响±s,n=9)
2.3 肝细胞凋亡
雌、雄大鼠饮酒组与饮水组相比,肝细胞凋亡率有升高趋势,但未见统计学差异。见表5。

表5 酒精摄入对FH/Wjd大鼠肝脏细胞凋亡的影响±s,n=9)
2.4 肝PPARα蛋白表达
饮酒组与饮水组相比,肝脏组织PPARα蛋白表达明显降低,且有统计学差异(P<0.05)。见图1、图2。
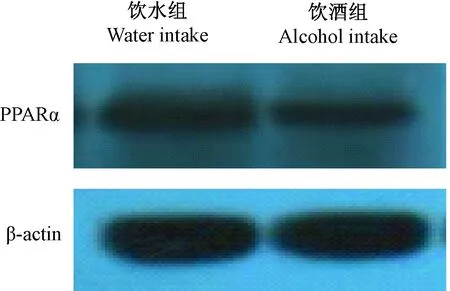
图1 肝脏组织PPARα的蛋白表达

注:与饮水组相比,*P<0.05
2.5 组织病理学
饮水组肝组织结构正常,肝小叶结构完整,肝细胞以中央静脉为中心呈放射状排列,肝细胞索、肝血窦排列规则,未见炎细胞浸润、肝细胞变性、坏死等病理变化。饮酒组可见肝细胞空泡变性(符合小泡性脂肪变的病理特点)、小灶性,多发,偶见坏死。见图3(彩插4)。
3 讨论
酒精性肝病(alcoholic liver disease,ALD)是由于长期大量饮酒导致的肝中毒性损害,包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和肝硬化[5]。为了研究ALD的发病机制,筛选有效的治疗药物,建立相应的动物模型是非常有必要的。
关于酒精性肝损伤的动物模型主要有强制灌酒、自由摄入酒精食料(Lieber-Decarli)[6-8],前者乙醇溶液浓度过大或体积过大都会严重损伤消化道,长期灌胃酒精大鼠死亡率高,短期则造成乙醇摄入量低;后者由于大鼠厌酒,也会导致乙醇摄入量受限。为控制厌酒的大鼠的酒精摄入,以保证血液中长期维持高浓度的酒精,1984年Tsukamato-French等[9]给SD大鼠手术植入胃管,持续注入含酒精的液体食料。但该模型中酒精是强制注入的,不符合正常摄入过程,并且制作此模型需要一些技术上的特别训练,不易复制。FH/W jd大鼠先天嗜酒特性使其在自然状态下可以自由饮用大量酒精,与人类饮酒行为非常相似,实验操作简便易行。
从本次实验数据可以看出,FH/Wjd大鼠自由饮酒16周后,血清TG和TBIL变化较大,从GSH可以推测肝脏可能出现了氧化损伤,而病理改变则以小泡性脂肪变性为主,这与肝脏TG含量升高吻合。与脂代谢密切相关的PPARα的蛋白表达受到了明显影响,并且肝细胞凋亡率有升高趋势。饮酒组大鼠血清CHO有所降低,雌性动物降低程度尤为明显,可能是由于肝细胞受损,胆固醇酯生成减少,导致血清胆固醇总量降低。饮酒组大鼠血清AST、ALT均呈现降低趋势,同时血清TBIL水平升高,其中雌性大鼠ALT降低较为明显,与饮水组出现了显著统计学差异。临床上这种胆酶分离的现象是由于肝细胞大量坏死,对胆红素的处理能力进行性下降,同时转氨酶进行性耗竭造成的,所以我们推测FH/Wjd大鼠这种血清生化指标的改变与肝细胞受损或坏死有关。
本模型采用了两种性别的动物,从数据来看,雌雄动物各数据的变化趋势是一致的,但变化程度有一定差异,雌性动物变动幅度较雄性动物略大。在乙醇摄入量监测时发现,雌性动物乙醇摄入量高于雄性动物,故推测病变程度性别差异可能与此有关。本研究对FH/Wjd大鼠作为酒精性肝损伤动物模型的可行性进行了初步探讨,此模型仍然有待我们进一步深入研究。
(本文图3见彩插4。)
[1] 李雨玲, 梁建辉.FH/Wjd大鼠的生物学特性及其在药理学研究中的应用 [J].中国药理学通报, 2012, 28(7):893-897.
[2] 景丽, 张振华, 王卫平, 等.先天性嗜酒大鼠的饮酒行为特性 [J].中国药理学与毒理学杂志, 2009, 23(1):65-69.
[3] 尉明晓, 秦超, 陈威, 等.PPARα转基因小鼠在药物评价中的应用研究 [J].中国比较医学杂志, 2013, 23(1):18-22.
[4] 石巧娟, 刘月环, 楼琦, 等.非酒精性脂肪肝大鼠PPARα基因表达及脂代谢和胰岛素水平的变化 [J].中国比较医学杂志, 2009, 19(8):26-30.
[5] 陈灏珠, 林果为, 廖履坦, 等.实用内科学 [M].第13版.北京: 人民卫生出版社, 2009:2098.
[6] 吴京燕, 潘玉英, 杨云峰, 等.牛初乳冻干粉对酒精性肝损伤的预防作用 [J].中国比较医学杂志, 2007, 17(1):33-34.
[7] 刘莉, 管小琴, 李芬, 等.茶多酚对酒精性肝病大鼠核因子κB及环氧合酶2表达的影响[J].中国实验动物学报, 2008, 16(3):209-213.
[8] Lieber CS, Jones DP, Dearli LM.Effects of prolonged alcohol intake: production of fatty liver despite adequate diets [J].J Clin Invest,1965, 44(10):1009.
[9] Tsukamoto H, Reidelberger RD, French SW, et al.Long term cannulation model for blood sampling and intragastric infusion in the rat [J].Am J Physiol, 1984, 247(6):R595.
