广西巴马小型猪PGC-1α基因克隆与组织表达分析
2014-08-15严雪瑜敖秋桅严小东蒋钦杨郭亚芬兰干球
严雪瑜,敖秋桅,严小东,蒋钦杨, 郭亚芬,兰干球
(1.广西大学动物科学技术学院,南宁 530004;2.广西防城港市畜牧站,广西 防城港 538021)
过氧化物酶体增殖活化受体γ(PPAR-γ)辅助活化因子1α(peroxisome proliferator-activated receptor-gama coactivator-1 alpha,PGC-1α)是近年来备受关注的辅激活因子。PGC-1α主要参与线粒体生物合成、调节适应性产热、脂肪酸β氧化、肝糖异生等代谢调节。PGC-1α基因具有组织表达特异性,主要分布于有高能量需求或适应性产热作用的组织中[1]。数量性状遗传研究表明,人PGC-1α所在染色体区域与许多代谢性指标存在连锁关系;遗传学以及分子流行病学研究发现,PGC-1α突变可能与糖尿病、肥胖等代谢性疾病发生有关联[2]。资料显示,2型糖尿病(T2DM)患者肝脏中的PGC-1α水平较高[3],其在肝脏中过表达会导致肝糖元输出增加,血糖升高[4]。肌肉组织是胰岛素刺激的葡萄糖摄取的主要器官,2型糖尿病则最早表现出骨骼肌的胰岛素抵抗(IR)。PGC-1α在骨骼肌中表达丰富,研究其对骨骼肌IR发生的调控作用,是了解2型糖尿病致病机制的重要方面。
与小鼠相比,猪的基因组与人的大小相似(3×109bp)、复杂程度和染色体组成较为一致[5]。研究表明,猪是最接近人类的模式动物,小型猪与人类在某些生理结构、功能及生化指标上具有相似性[6],其血糖和血清胰岛素的正常值与人类接近,糖耐量试验过程与人类基本一致[7, 8],使小型猪成为人类肥胖、糖尿病、心血管疾病和营养代谢研究的理想的动物模型[9]。
猪PGC-1α基因位于染色体的8p21区域,包含13个外显子和12个内含子,编码796个氨基酸的蛋白质[10]。在基础水平对猪的PGC-1α组织分布情况的研究发现,PGC-1α基因在多种组织中均有广泛表达,尤其在耗氧量高、富含线粒体的组织中,如在骨骼肌、肝脏,心脏及肾脏中表达最高[11]。而目前尚没有关于广西巴马小型猪PGC-1α基因克隆和组织表达分析方面的文献报道。本研究拟通过克隆分析广西巴马小型猪PGC-1α基因编码区序列,定量检测该基因在小型猪心、肝、肾、胰、皮下脂肪、背最长肌中的表达情况,为后续研究PGC-1α在小型猪2型糖尿病模型制作过程中作用打下基础。
1 材料与方法
1.1 实验材料
实验所需广西巴马小型猪来自广西大学巴马小型猪繁育场封闭群【SCXK(桂)2013-0003】。采集3头15月龄、体重45 kg左右实验普通级广西巴马小型猪新鲜组织样品(心、肝、肾、胰、皮下脂肪、背最长肌),装入灭菌的冻存管中立即置于液氮中冷冻,而后迅速转入-80℃冰箱备用。
1.2 引物的设计与合成
参考NCBI上GenBank报道的猪PGC-1α基因序列(序列号AB106108),设计特异性引物,并在上下游引物5’端分别添加Sal I和BamH I酶切位点,PGC-1α-F1:5’-GAATTCTGCAGTCGACATGGCGTGGGACATGTGC-3’,PGC-1α-R1:5’-TAGATCCGGTGGATCCTTACCTGCGCAAGCTTCTCT-3’。
18S rRNA基因实时荧光定量PCR(QRT-PCR)引物序列参照单体中[12]设计合成,PGC-1α基因QRT-PCR引物序列参照姚国佳[13]设计合成,定量引物序列如表1所示。上述引物均由上海生工生物工程技术服务有限公司合成。
1.3 RNA提取及RT-PCR
采用Trizol法提取广西巴马小型猪的组织总RNA,并以其为模板,用PrimeScriptTMRT reagent kit with gDNA Eraser试剂盒(TaKaRa,日本)反转录合成cDNA。
PCR扩增体系(15.0 μL):cDNA 1.0 μL,PGC-1α-F1(10 μmol/L)0.5 μL,PGC-1α-R1(10 μmol/L)0.5μL,Ex Taq 酶(TaKaRa,日本)7.5 μL, ddH2O补足至15.0 μL。反应程序:98℃预变性3 min;98℃ 30 s、60℃ 30 s、72℃ 2 min 30 s,进行35个循环;72℃延伸10 min;4℃保存。
1.4 克隆及序列测定
PCR扩增产物利用胶回收纯化试剂盒(BioFlux,中国)进行纯化,回收后与pEASY-T5克隆载体(TransGen,中国)连接,转化至Trans-T1感受态细胞(TransGen,中国)中,扩大培养细菌。经鉴定的阳性菌液分别送至上海英骏生物技术有限公司和北京六合华大基因科技股份有限公司进行测序。测序结果用Lasergene7.0软件进行序列分析及同源性比对。

表1 定量PCR引物
1.5 实时荧光定量PCR反应
采用SYBR green I染料法,以18S rRNA为内参基因,目的基因、内参基因的质粒标准品作为阳性对照,ddH2O作为阴性对照,目的基因相对表达量采用2-△△Ct法计算目的基因相对定量结果,在Roche Light Cycler 480实时荧光定量PCR仪上进行PCR扩增和数据分析。
实时荧光定量PCR体系(20.0 μL):SYBR Premix Ex Taq(Roche,美国)10.0 μL,Prime-F(10 μmol/L)0.5 μL,Prime-R(10 μmol/L)0.5 μL,模板5.0 μL,ddH2O 补足至20.0 μL。反应程序:95℃预变性5 min;95℃ 10 s、60℃ 10 s、72℃ 20 s,进行40个循环。
2 结果与分析
2.1 目的基因PCR扩增
以广西巴马小型猪背最长肌总RNA反转录产物为模板,PGC-1α基因CDS序列PCR扩增产物的凝胶电泳结果如图1所示,其片段大小在2000~3000 bp,与预期序列长度相近。
注:1~4.目的基因PCR产物;M.DNA相对分子量标准DL5000。
2.2 pEASY- T5-PGC-1α重组质粒鉴定
对转化有pEASY-T5-PGC-1α的细菌,进行菌液PCR扩增电泳检测以及提取质粒进行Sal I、BamH I双酶切鉴定,结果如图2、图3所示。结果显示,菌液PCR产物位置与阳性对照结果一致,并符合预期大小;重组质粒双酶切产物大小分别与目的片段及pEASY-T5载体大小相符。

注:1.阳性对照;2~5.菌液PCR产物;M.DNA相对分子量标准DL8000。

注:1~4.双酶切产物;M.DNA相对分子量标准DL 5000。
2.3 PGC-1α基因序列测定与分析
将阳性菌液分别送两家测序公司的测序结果完全一致。广西巴马小型猪PGC-1α基因CDS序列全长2391 bp,编码796个氨基酸,与参考序列(AB106108)进行比较,同源性达99.9%,两处碱基发生同义突变,分别为+1105位的碱基由C→A,+1524位的碱基由G→A。
广西巴马小型猪PGC-1α基因与Genbank上发表多个物种序列进行比较,构建系统进化树,如图4所示,小型猪PGC-1α基因与普通猪(Sussrofa, No.AB106108)的序列同源性最高,先聚在一枝,其次是与牛(Bostaurus, No.NM177945)和羊(Ovisaries, No.JF449960)聚为一枝,再与人(Homosapiens, No.NM013261)聚类,最后与小鼠(Musmusculus, No.AF049330)、大鼠(Rattusnorvegicus, No.NM031347)聚类。
2.4 PGC-1α基因组织表达分析
采用QRT-PCR相对定量的方法,检测3头15月龄广西巴马小型猪PGC-1α基因mRNA在多个组织中的表达情况。结果发现,PGC-1α基因在小型猪心脏、肝脏、肾脏、背最长肌、皮下脂肪等组织中均有表达,其中,在心脏和肾脏中的表达丰度最高,其次是肝脏、皮下脂肪和背最长肌,而在胰腺中未检测到其表达。实验结果如图5所示。
通过RT-PCR半定量的方法,验证广西巴马小型猪PGC-1α基因mRNA在不同组织中的表达情况。结果如图6所示,PGC-1α基因在小型猪的心脏、肝脏、肾脏、背最长肌以及皮下脂肪组织具有表达,而胰脏中没有检测到PGC-1α基因表达。

图4 PGC-1α基因进化树
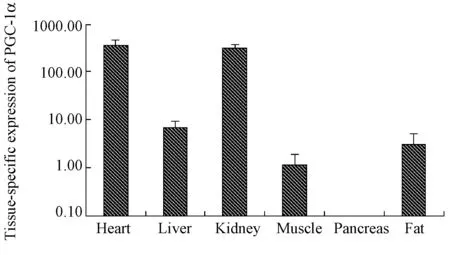
图5 广西巴马小型猪不同组织PGC-1α基因表达情况
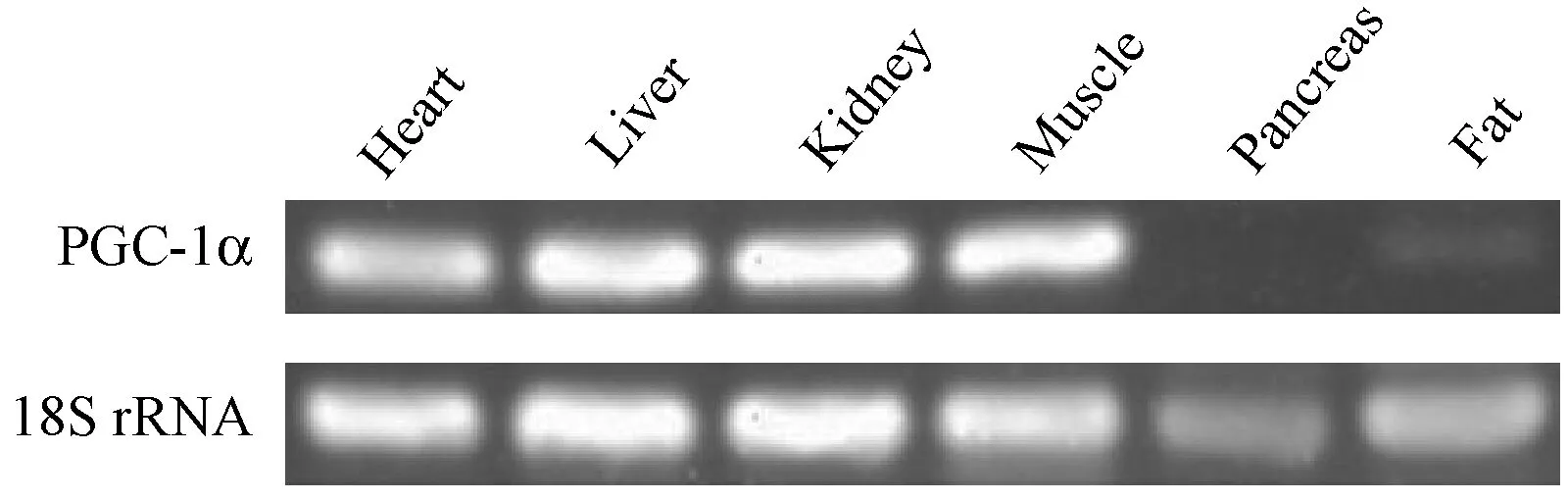
图6 广西巴马小型猪不同组织PGC-1α基因RT-PCR检测
3 讨论
本研究成功克隆获得了广西巴马小型猪PGC-1α基因的cDNA序列,其与普通猪的基因同源性高达99.9%,仅存在两处碱基的同义突变。同源性对比、构建系统进化树表明,小型猪PGC-1α基因与其他动物的基因序列同源性较高,进一步表明不同物种间PGC-1α基因具有高度的保守性[14]。
文献报道表明,在机体中,PGC-1α基因主要在心、肾、棕色脂肪、骨骼肌等有高能量需求或适应性产热作用的组织中表达,而在大肠、小肠及白色脂肪组织中的表达水平较低[15]。本研究发现,广西巴马小型猪PGC-1α基因在心脏和肾脏中的高表达,其次是肝脏、皮下脂肪和背最长肌,而胰腺中未检测到其表达。研究结果与前人的文献报道相似。Norrbom等[16]发现PGC-1α mRNA在棕色脂肪组织、骨骼肌等部位大量表达,而在白色脂肪组织、胰腺及大脑中的分布较少或几乎没有。Larrouy等[17]则发现人的PGC-1α mRNA在心脏、肾脏、肝脏和骨骼肌中表达较高,在白色脂肪组织和肠道中的表达水平较低。Esterbauer等[18]用Northem杂交显示,PGC-1α在人的心脏、骨骼肌、肾脏都有表达,在肝脏、脑、胰腺等组织中表达较低。Jacobs等[19]检测到PGC-1α基因在猪脂肪、肌肉、肾脏、肝脏、和心等与机体适应性产热相关的组织中存在表达。文旭辉[11]利用RT-PCR的方法检测基础水平4月龄八眉猪PGC-1α基因组织表达差异,发现其在肝脏、肌肉、皮下脂肪、肾脏、脾脏、内脏脂肪中均有表达,在肺中没有检测到表达,其中肝脏、心脏和肌肉的表达丰度最高,内脏脂肪中的表达量最低。闵小红[20]利用荧光定量探针的方法检测了PGC-1α基因在长白猪肾脏、肝脏、十二指肠、肠淋巴结、脾脏、心脏、背膘、股四头肌、腰大肌和背最长肌中的表达情况,以肾中的表达量最高,且极显著高于其他组织,三个不同部位肌肉中的表达最低。PGC-1α基因在猪的多个组织均有表达,其中以耗氧量高和富含线粒体的组织中表达丰富。
克隆获得广西巴马小型猪PGC-1α基因CDS序列,长2391 bp;PGC-1α基因在广西巴马小型猪心脏和肾脏中的表达水平最高,其次是肝脏、皮下脂肪和背最长肌,而在胰腺中未检测到其表达。
[1] Knutti D, Kaul A, Kralli A.A tissue-specific coactivator of steroid receptors, identified in a functional genetic screen [J].Mol Cell Biol, 2000, 20(7):2411-2422.
[2] 孙亮, 朱小泉, 王沥, 等.核辅激活因子PGC-1表达的分子调控机制 [J].中国生物化学与分子生物学报, 2005, 21(4):431-439.
[3] Kakuma T, Wang ZW, Pan W, et al.Role of leptin in peroxisome proliferator-activated receptor gamma coactivator-1 expression [J].Endocrinology, 2000, 141(12):4576-4582.
[4] Koo SH, Satoh H, Herzig S, et al.PGC-1 promotes insulin resistance in liver through PPAR-alpha-dependent induction of TRB-3 [J].Nat Med, 2004,10(5):530-534.
[5] Ellegren H, Chowdhary BP, Johansson M, et al.A primary linkage map of the porcine genome reveals a low rate of genetic recombination [J].Genetics, 1994, 137(4):1089-1100.
[6] 赵玉琼, 姚春涛, 刘亚千, 等.我国特有三个小型猪品系PPARα基因的多态性分析 [J].中国比较医学杂志, 2008, 18(10):41-44.
[7] Vodicka P, Smetana KJ, Dvorankova B, et al.The miniature pig as an animal model in biomedical research [J].Ann N Y Acad Sci, 2005, 1049:161-171.
[8] Bellinger DA, Merricks EP, Nichols TC.Swine models of type 2 diabetes mellitus:insulin resistance, glucose tolerance, and cardiovascular complications [J].ILAR J, 2006, 47(3):243-258.
[9] KT L.Swine as animal models in cardiovascular research [M].In: Tumbleson ME, ed.Swine in Biomedical Research.New York: Plenum Publishing Corp, 1986.
[10] 赵玉琼, 陈华.PGC-1基因与Ⅱ型糖尿病 [J].实验动物科学, 2008, 25(6):45-47.
[11] 文旭辉.猪PGC-1α、线粒体相关基因组织表达及Leptin对PGC-1α、UCPs mRNA表达的影响 [D].西北农林科技大学, 2007.
[12] 单体中.Sirt1基因表达对猪脂肪分解的影响及其分子机制研究 [D].浙江大学, 2008.
[13] 姚国佳.PPARδ和Myoglobin基因表达对猪肉色的影响及机制研究 [D].浙江大学, 2010.
[14] 马燕, 常荣, 祁玉娟, 等.藏羚羊PGC-1α基因编码区的克隆与分析 [J].动物学杂志, 2012, 47(1):25-35.
[15] Melloul D, Stoffel M.Regulation of transcriptional coactivator PGC-1alpha [J].Sci Aging Knowledge Environ, 2004, 2004(9):e9.
[16] Norrbom J, Sundberg CJ, Ameln H, et al.PGC-1alpha mRNA expression is influenced by metabolic perturbation in exercising human skeletal muscle [J].J Appl Physiol (1985), 2004, 96(1):189-194.
[17] Larrouy D, Vidal H, Andreelli F, et al.Cloning and mRNA tissue distribution of human PPARgamma coactivator-1 [J].Int J Obes Relat Metab Disord, 1999, 23(12):1327-1332.
[18] Esterbauer H, Oberkofler H, Krempler F, et al.Human peroxisome proliferator activated receptor gamma coactivator 1 (PPARGC1) gene: cDNA sequence, genomic organization, chromosomal localization, and tissue expression [J].Genomics, 1999, 62(1):98-102.
[19] Jacobs K, Rohrer G, Van Poucke M, et al.Porcine PPARGC1A (peroxisome proliferative activated receptor gamma coactivator 1A): coding sequence, genomic organization, polymorphisms and mapping [J].Cytogenet Genome Res, 2006, 112(1-2):106-113.
[20] 闵小红.猪PPARGC1A基因在不同组织和生长发育阶段中的差异表达[D].四川农业大学, 2008.
