胃肠道间质瘤分子靶向治疗继发性耐药基因突变的研究
2014-08-10史炼钢马驰王东
史炼钢,马驰,王东
论著·临床
胃肠道间质瘤分子靶向治疗继发性耐药基因突变的研究
史炼钢,马驰,王东
目的探讨胃肠道间质瘤(GIST)患者酪氨酸激酶受体(KIT)和血小板源性生长受体(PDGFRA)基因突变的特点,以及伊马替尼的继发耐药机制。方法对98例GIST患者肿瘤组织进行DNA抽提、聚合酶链反应(PCR)扩增和直接测序,检测KIT基因外显子9、11、13、17和PDGFRA基因12、18外显子突变;并对伊马替尼继发耐药的65例患者进行2次检测。结果98例患者中,KIT突变79例 (80.6%),其中外显子11突变61例(62.2%),外显子9突变18例(18.4%);PDGFRA突变3例(3.1%)。不同性别、年龄以及晚期GIST患者和潜在恶性的GIST患者间突变比较差异无统计学意义(P>0.05);而不同部位GIST的KIT外显子11突变发生率差异有统计学意义(P<0.05)。65例继发耐药病例中,4例患者发生二次突变,表现为KIT基因第17外显子密码子第2467位点的T为G所替换(T2467G),导致823密码子编码氨基酸由酪氨酸转变为天冬氨酸。结论KIT基因突变在GIST患者中常见,不同部位间KIT外显子11突变发生率差异有统计学意义。伊马替尼继发耐药可能与KIT基因第17外显子密码子第2467位点T为G所替换(T2467G)相关。
胃肠道间质瘤;伊马替尼;基因突变;耐药性
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)起源于Cajal间质细胞,是消化道最常见的间叶源性肿瘤,可发生在全消化道,其中以胃和小肠最多见,95%的GIST患者KIT基因(CD117)呈阳性表达。对于病变局限、可手术切除的GIST,外科手术是治疗首选,但是许多患者术后仍然面临肿瘤复发及转移的风险[1~3]。伊马替尼是一种选择性酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),通过阻断酪氨酸激酶受体的功能来抑制GIST细胞的增殖并诱导其凋亡。伊马替尼的出现为GIST的靶向治疗带来革命性的改变,极大地降低了GIST复发转移的风险,从而有效地改善了患者预后[4]。
然而部分GIST患者对伊马替尼存在耐药现象,可分为原发耐药和继发耐药,其中40%~50%的GIST患者在用药2年内会发生继发耐药[5,6]。Balachandran等[7]研究显示,11%的患者对伊马替尼产生原发性耐药,绝大多数患者服用伊马替尼后会出现继发性耐药。约23%的野生型kit/PDGFRA、16 % c-kit第9外显子突变和c-kit第11外显子突变发生原发性耐药。约67%的继发性耐药是由c-kit第13 外显子或第17 外显子发生了继发性突变所致[8]。因此,从基因水平探讨耐药机制可以指导治疗方案的制定,对出现耐药性患者及时调整治疗方案,选择合适的药物治疗。本文对98例GIST患者进行了突变检测,同时针对靶向药物伊马替尼治疗耐药的部分病例进行了耐药病灶的检测,以了解耐药与基因突变的关系。
1 资料与方法
1.1 一般资料 收集我院2008年9月—2012年9月接受伊马替尼治疗的GIST患者98例,均经病理切片证实。其中男58例,女40例,年龄23~90岁。记录详细的服药信息, 并进行随访。其中对伊马替尼耐药的65例晚期GIST患者接受了手术切除或对耐药病灶穿刺活检而取得组织进行二次检测, 留取手术标本。所有标本行病理学检查及KIT和PDGFRA基因测序。
1.2 免疫组织化学 患者标本经4%甲醛溶液固定石蜡包埋,以免疫组织化学抗体进行标记以进一步诊断: CD117 (A4502,多抗1∶200)购自Dako公司。CD117抗体用EnVision两步法检测。CD117以肿瘤细胞胞膜呈棕黄色为阳性,以黏膜内的肥大细胞作为阳性内对照。
1.3 恶性危险度分级标准 依据参考文献[9]分级,即肿瘤直径<2 cm和核分裂相<5/50HPF为极低度侵袭危险性;肿瘤直径2~5cm和核分裂相<5/50HPF为低度侵袭危险性;肿瘤直径5~10cm和核分裂相<5/50HPF或肿瘤直径<5cm和核分裂相6~10/50HPF为中度侵袭危险性;肿瘤直径>5cm和核分裂相>5/50HPF或肿瘤直径>10cm或核分裂相>10/50HPF为高度侵袭危险性。
1.4 KIT和PDGFRA基因序列分析 采用标准的酚—氯仿法从保存于-70e液氮中的冰冻肿瘤组织或石蜡包埋组织中提取DNA。将提取获得的1 μg左右的基因组DNA用于PCR扩增。PCR扩增产物应用2%的MetaPhor琼脂糖凝胶(BioWhittaker公司产品)电泳进行检测。根据文献[7~9]的方法,应用基因内引物将KIT基因第9、11、13和17外显子以及PDGFRA基因第12和18外显子进行PCR扩增。KIT基因扩增引物见表1。应用MicroSpin column (Amersham公司产品)纯化PCR产物。采用BigDyeTerminator Cycle Sequencing Ready Reaction Kit(Applied Biosystems公司产品)进行测序反应。使用3 mol/L的醋酸钠将循环测序产物沉淀出来, 然后应用ABI PRISM3730毛细管电泳系统(Applied Biosystems公司产品)对整个外显子和相应的外显子内含子交界区进行双向DNA测序[10]。

表1 KTT/PDGFRα基因PCR扩增引物序列
注:F.正向序列;R.反向序列
1.5 统计学方法 采用SPSS 15.0统计软件分析。计数数据用率(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 GIST患者临床资料及肿瘤特点 98例GIST中男58例,女40例,男∶女=1.45∶1,发病的中位年龄为55岁(23~90)岁,年龄分布:40~60岁 12例(12.2%),<40岁 19例(19.4%),≥60岁 67例(68.4%)。8例GIST是在食管癌或直肠癌手术时被偶然发现。肿瘤位于胃部31例 (31.6%),空回肠50例 (51.0%),十二指肠9例 (9.2%),直肠6例(6.1%),食管2例(2.0%)。经检测所有标本CD117均为阳性。倒置显微镜下观察,62例(63.3%)为梭形细胞型, 17例(17.3%)为上皮细胞型, 19例(19.4%)为混合细胞型。根据恶性危险度分级:极低度侵袭危险性2例(2.0%),低度侵袭危险性12例(12.3%),中度侵袭危险性23例(23.5%)和高度侵袭危险性61例(62.2%)。
2.2 KIT和PDGFRA基因的原发突变 98例患者中共检出突变82例:KIT突变79例(80.6%),其中外显子11突变61例 (62.2%),外显子9突变18例 (18.4%);PDGFRA外显子18突变3例 (3.1%)。KIT和PDGFRA各外显子均未检测到突变者16例(16.3%)。本组患者检出KIT外显子11突变形式主要为缺失突变,共61 例,突变主要集中在近5’端,缺失3~61个碱基不等,同时以密码子557-558缺失最常见(11例,18.0%),导致6个核苷酸TGGAAG缺失,编码色氨酸(Trp)和赖氨酸(Lys)。其次,点突变18例(29.5%),其突变主要发生于密码子557、558和576。经检测,KIT外显子9突变的18例患者中,均为插入/串联重复,其中16例为密码子502~503的6个编码丙氨酸(Ala)和酪氨酸(Tyr)的核苷酸GCCTAT插入重复,而另外2例为罕见的密码子501~502插入重复,重复的6个核苷酸为TCTGCC,编码丝氨酸(Ser)和丙氨酸 (Ala)。
本组患者检出PDGFRA突变均为第18号外显子的基因突变,其中2例为常见的D842V点突变形式,1例为一个新的突变形式:氨基酸843~846处IMHD的框内缺失,随后伴有一个S847T的点突变。3例均为高度侵袭危险性,所有患者未检出PDGFRA第12号外显子的突变。
根据不同性别、年龄及明确恶性和潜在恶性的GIST患者分组,分别比较总突变检出率、KIT外显子11、外显子9及PDGFRA外显子18突变发生率,差异均无统计学意义(P>0.05);而不同原发部位GIST基因突变差异有统计学意义(P<0.05),见表2。胃和直肠患者GIST KIT外显子11突变发生率显著高于小肠(包括十二指肠,P<0.05);小肠GIST外显子9和野生型的发生率高于胃和直肠GIST,但差异无统计学意义(P>0.05)。
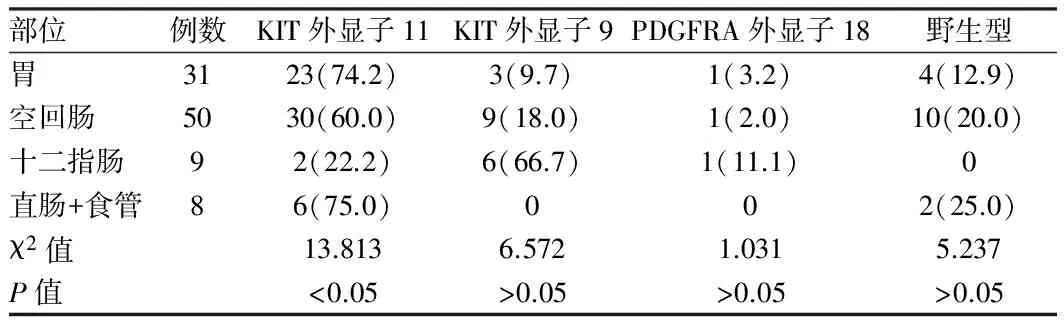
表2 不同原发部位GIST突变检测结果比较 [例(%)]
2.3 KIT和PDGFRA基因的二次突变 本研究组发现65例伊马替尼继发耐药患者,经过基因检测,KIT基因发生二次突变4例,突变表现为同一种类型,即在KIT基因第17外显子同一处碱基发生替换突变,表现为密码子第2467位点的T为G所替换(T2467G),可导致第823密码子编码氨基酸由酪氨酸转变为天冬氨酸(Y823D)。在所有被检测的患者中,未发现KIT基因第9、11、13号外显子及PDGFRA基因第12、18外显子二次突变。
3 讨 论
GIST发病率相对较低,国内关于GIST患者突变情况的大宗病例报道仍然较少。国外研究显示,GIST患者KIT基因突变发生率为75%~80%,主要发生于近膜区结构域(外显子11);外显子11突变率约为67%,外显子9突变率约为10%,而PDGFRA基因突变率为5%~8%[10]。国内超过100例患者的报道显示了KIT总突变率和外显子11突变率与国外报道类似,而外显子9和PDGFRA突变率相对较低,分别为5%~7%和3%~4%。而我院KIT总突变发生率为80.6%,外显子11突变率62.2%,PDGFRA突变率为3.1%,与文献报道相近;但外显子9突变率为18.4%。目前GIST突变检测尚未形成统一标准,变性高效液相色谱法和直接测序等不同检测方法的突变检出率可能存在一定差异[11]。
KIT不同突变类型发生频率由高到低的是:缺失突变、点突变、重复突变以及插入突变。多数缺失突变集中在KIT外显子11的5’端,而重复突变常发生在KIT外显子11的3’端。 本组患者KIT突变的总体情况和文献报道相近。点突变主要累及557、558和576几个位点。本组外显子9突变发生率与西方报道接近,也主要发生在小肠GIST,较胃GIST发生率高,尽管差异无统计学意义;但本组新发现2例密码子501和502重复,尚鲜见报道。本组患者检出PDGFRA的突变均为第18号外显子的基因突变,其中2例为常见的D842V点突变形式[11,12]。另1例是一个新突变形式:氨基酸843~846处IMHD的框内缺失,随后伴有一个S847T的点突变。3例具有PDGFRA突变者均为高度侵袭危险性,未检出PDGFRA第12号外显子的突变,这也与西方报道相类似。
本次研究的结果表明, KIT基因原发突变发生在第11外显子的患者,对伊马替尼的疗效要比其他KIT基因突变亚组的好,发生二次突变的风险却比KIT基因第13号外显子突变的患者高。因此, 在严密监测伊马替尼耐药肿瘤时发现的KIT基因新的二次突变, 可以为二者之间的因果联系提供令人信服的证据。由于本次研究的病例数较少, KIT基因第9、13、17号外显子及PDGFRA基因第12、18外显子原发突变的继发耐药患者发生二次突变的概率还有待进一步研究。
综上所述, 在使用伊马替尼治疗GIST以前, 除了确定CD117检测结果外, 同时行基因检测了解患者的基因突变情况,有助于预测伊马替尼的疗效与耐药情况,可以为患者制定治疗方案提供依据。
1 祝燕军,钱立勇,黄燕凤.DOG1蛋白在胃肠道间质瘤诊断中的价值研究[J].中国全科医学,2012,15(9):3025.
2 李金鹏,宋金龙.甲磺酸伊马替尼联合肝动脉化疗栓塞术治疗胃肠间质瘤肝转移的疗效观察[J].疑难病杂志,2012,11(6):430.
3 邵天松,伍冀湘.胃肠道间质瘤20例诊治体会[J].中国医药,2009,4(10):776.
4 Joensuu H, DeMatteo RP. The management of gastrointestinal stromal tumors: a model for targeted and multidisciplinary therapy of malignancy[J].Annu Rev Med,2012,63:247-258.
5 Rossi S, Miceli R, Messerini L, et al. Natural history of imatinib-naive GISTs: a retrospective analysis of 929cases with long-term follow-up and development of a survival nomogram based on mitotic index and size as continuous variables[J].Am J Surg Pathol,2011,35(11):1646-1656.
6 Delahaye NF, Rusakiewicz S, Martins I, et al. Alternatively spliced NKp30isoforms affect the prognosis of gastrointestinal stromal tumors[J].Nat Med,2011,115(17):700-706.
7 Balachandran VP, Cavnar MJ, Zeng S, et al. Imatinib potentiates antitumor T cell responses in gastrointestinal stromal tumor through the inhibition of Ido[J].Nat Med,2011,17(9):94-100.
8 Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST). Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1 640patients[J].J Clin Oncol,2010,28(1):47-53.
9 Perez D, Hauswirth F, Jager D, et al. Protein expression of cancer testis antigens predicts tumor recurrence and treatment response to imatinib in gastrointestinal stromal tumors[J].Int J Cancer,2011,128(Suppl 1):47-52.
10 Souto JC, Vila L, Bru A. Polymorphonuclear neutrophils and cancer: intense and sustained neutrophilia as a treatment against solid tumors[J].Med Res Rev,2011,31(1):31-63.
11 Dematteo RP, Ballman KV, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial[J].Lancet,2009,373(9658):97-104.
12 Yamanaka T, Matsumoto S, Teramukai S,et al.The baseline ratio of neutrophils to lymphocytes is associated with patient prognosis in advanced gastric cancer[J].Oncology,2007,73(1-2):15-20.
13 王春萌,师英强,董锐增,等.伊马替尼耐药胃肠间质瘤的免疫组织化学和基因特征[J].肿瘤,2008,28(12): 1064-1068.
Gastrointestinalstromaltumormoleculartargetedtreatmentforsecondaryresistancemutations
SHILiangang,MAChi,WANGDong.
DepartmentofGeneralSurgery,DalianCentralHospital,Dalian116033,China
ObjectiveTo investiate the gastrointestinal stromal tumor (GIST) patients with tyrosine kinase receptor (KIT) and platelet-derived growth factor receptor (PDGFRA) gene mutation characteristics, as well as secondary imatinib resistance mechanisms.Methods98 cases of patients with GIST tumor were examed with tissue for DNA extraction, polyme-rase chain reaction (PCR) amplification and direct sequencing to detect KIT exon 9,11,13,17 and PDGFRA gene mutation in exon 12, 18; and secondary second test were performed in 65imatinib-resistant patients.ResultsIn the 98 patients, KIT mutations were found in 79cases (80.6%), of which exon 11 mutations in 61 cases (62.2%), exon 9mutations in 18 cases (18.4%); PDGFRA mutations in 3 cases (3.1%). Gender, age, and among patients with advanced GIST GIST patients and potentially malignant mutation was with no significant difference (P>0.05); while different parts of GIST KIT exon 11 mutation incidence was significantly (P<0.05). In 65cases of secondary resistant cases, four patients developed a secondary mutation, gene expression of KIT exon 17 codon 2467 point T is replaced by G (T2467G), resulting in 823 amino acids encoded by the codons casein converted to aspartic acid.ConclusionIt demonstrated that the KIT mutations are common in GIST patients, between different parts of the KIT exon 11 mutation rate difference was statistically significant. Secondary imatinib resistance may be associated with KIT exon 17 of the gene codon 2467 point T is replaced by G (T2467G) related.
Gastrointestinal stromal tumor; Imatinib; Gene mutation; Drug resistance
116033 大连市中心医院普外一科
10.3969/ j.issn.1671-6450.2014.02.021
2013-08-01)
