电解法在废旧锂电池浸出过程中的应用
2014-08-10赵鹏飞尹晓莹满瑞林
赵鹏飞, 尹晓莹, 满瑞林
(1.中国恩菲工程技术有限公司, 北京 100038;2.中国石油化工股份有限公司抚顺石油化工研究院, 辽宁 抚顺 113001;3.中南大学化学化工学院, 湖南 长沙 410083)
试验研究
电解法在废旧锂电池浸出过程中的应用
赵鹏飞1, 尹晓莹2, 满瑞林3
(1.中国恩菲工程技术有限公司, 北京 100038;2.中国石油化工股份有限公司抚顺石油化工研究院, 辽宁 抚顺 113001;3.中南大学化学化工学院, 湖南 长沙 410083)
本文以废旧锂电池正极材料为原料研究电解法在浸出过程中的应用。通过对电解浸出过程热力学基础及电化学性能研究,确定反应进行的条件范围及电极反应式,同时对电解浸出的反应条件进行优化实验。研究结果表明,控制浸出体系的电位E>-0.277+0.029 6log[Co2+]且pH>2.636-0.33log[Al3+]时,可以实现钴的选择性浸出,在反应条件为电流密度15.63 mA/cm2、硫酸浓度40 g/L、温度45 ℃、反应时间120 min的情况下,钴的一次电解浸出率可达91.85%,而铝溶解率仅有6.28%。
钴酸锂; 热力学; 电化学; 电解; 浸出
随着钴资源的紧缺和电池的广泛应用,废旧锂电池的回收成为资源循环利用的有效途径,废旧锂电池中钴及其他有价金属的合理回收工艺成为研究热点。现行的主要回收工艺为:采用碱浸和有机溶剂溶解法将正极材料和铝集流体分开,铝以铝盐或者金属铝箔形式回收,再将剥离的正极粉料进行浸出、萃取、沉淀得到钴盐[1-2]。工艺中存在很多问题:正极材料难剥离、成本高、毒性大,铝回收不完全给后续工艺增加负荷,整体工艺流程长、经济性差,导致很难实现工业化生产等。在原有的研究基础上,根据电池正极材料的特性,本文作者主要对电解浸出行为过程进行深入研究,探讨电解浸出的可行性[3-5],拟采用电解浸出法将正极材料一步浸出,并使铝箔完整回收,这种工艺不仅缩短了传统工艺流程,而且使工艺更具环保性、经济性。
1 电解浸出热力学基础探讨
电池正极材料的主要成分为LiCoO2,电解法能否实现对其的浸出与LiCoO2和集流体铝箔在水溶液中的电化学性质有直接关系。本文通过正极材料中LiCoO2和Al的E-pH图,研究了LiCoO2与Al在溶液中发生的电化学反应,为正极材料的选择性浸出提供热力学理论指导。
在298 K、101.325 kPa条件下,根据Co-H2O系、Li-Co-H2O系和Al-H2O系中存在的组分及其标准生成自由能[6-7],各体系中发生的反应方程式以及热力学反应平衡方程式绘制LiCoO2-H2O系和Al-H2O系的E-pH图[8-9]。
1.1Li-Co-H2O系E-pH图
在298 K、101.325 kPa下,当[M]=0.001、1 mol/L,P[H2] =101.325 kPa,P[O2]=101.325 kPa时,计算并绘制出Li-Co-H2O系的E-pH图,如图1所示。
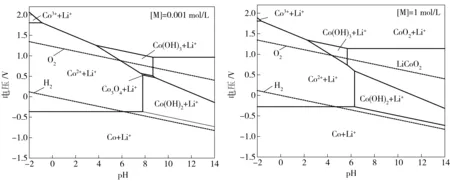
图1 Li-Co-H2O系E-pH图([M]=0.001、1 mol/L)
由图1可以看出,LiCoO2在水溶液中可以稳定存在且稳定区域较大,若要将LiCoO2浸出,需要控制pH值和溶液电位将其稳定区域从LiCoO2区域转移到Co2++Li+区域,从图1中可知,LiCoO2浸出有以下几种途径:
(1) 控制体系的电位一定,通过降低体系的pH值,将LiCoO2先转化为中间产物CoO2+ Li+或Co(OH)3+ Li+的形式,然后再将其转化为Co2++ Li+的形式完成LiCoO2的浸出。
(2) 同时降低体系的电位及pH值到Co2+的稳定区,将 LiCoO2直接转化为Co2++ Li+的形式进入溶液。
(3) 控制体系pH值一定,先降低体系的电位,将LiCoO2转化为Co(OH)2+ Li+的形式,然后再使溶液的pH值降低,使Co(OH)2溶解并以Co2+的形式进入溶液。
由图1可知,途径(1)需要将电位控制0.75 V以上,即需要给体系提供较高电位,从能量消耗角度来讲,此途径并不经济。同时,CoO2+Li+和Co(OH)3+Li+的区域pH值跨度较大,在实际生产中不容易实现。途径(2)虽可以直接进入Co2++ Li+稳定区域,但是对比不同浓度的电位-pH值可知,随着浸出的进行,LiCoO2和Co2++ Li+稳定区域之间会逐渐生出Co3O4+ Li+稳定区域,并且原有稳定区域衔接处范围较小,条件不容易控制,容易导致浸出不完全或者浸出条件大幅度波动,给浸出过程带来不便。相比较而言,途径(3)只需要控制一定的电位,降低pH值就可以实现浸出行为,临界pH值为所在条件下Co2+水解pH值。根据Li-Co-H2O系的电位-pH图,电解浸出过程则可选择控制溶液的pH值和电位值将 LiCoO2转化为Co2++ Li+的形式进入溶液。
1.2Al-H2O系E-pH图
在298 K、101.325 kPa下,当[M]=0.001、1 mol/L,P[H2]=101.325 kPa,P[O2]=101.325 kPa时,计算并绘制出Al-H2O系的E-pH图,如图2所示。
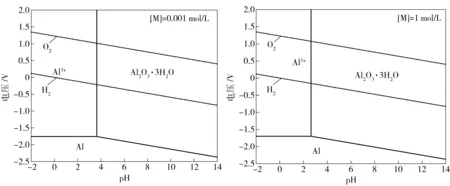
图2 Al-H2O系E-pH图([M]=0.001、1 mol/L)
由图2可以看出,金属铝在水溶液中存在的稳定区域很低,远低于水的稳定区。在低pH值下,也就是酸性溶液中,铝易于以Al3+存在溶液中。当溶液中离子浓度增大时,Al3+存在的稳定区域减小,向低pH区移动。当溶液pH>2.636-0.33log[Al3+]且E>-1.543-0.059 1 pH时,铝表面因生成氧化铝而发生钝化,可以表现出良好的耐腐蚀性能。
综合上述,通过Li-Co-H2O系E-pH图与Al-H2O系E-pH图可知,如能控制浸出体系的电位E>-0.277 + 0.029 6log[Co2+]且pH>2.636-0.33log[Al3+]时,就能在浸出钴的同时使铝进入钝化状态,从而实现LiCoO2的选择性浸出,选择电解浸出还需要保持浸出稳定区域位于H2线以上,从而抑制氢气析出。
2 电解浸出反应原理研究
通过对Li-Co-H2O系和Al-H2O系的E-pH图进行分析,提出了正极材料选择性浸出的途径,即通过控制溶液的pH值和电位,一方面保证LiCoO2的还原浸出,另一方面使金属铝进入钝化状态而得到保护,为钴浸出过程提供了理论基础。在此基础上本文采用线性扫描伏安法对LiCoO2阴极还原行为进行研究,并对电解浸出的反应原理及反应过程进行推测及验证[10]。
2.1LiCoO2阴极还原的行为
试验采用的是自制的三电极体系,将试样制成暴露面积为1 cm2的工作电极,辅助电极为铂片电极,饱和甘汞电极为参比电极,其电位为0.241 5 V(vs.SCE),分别用正极片、剥离掉活性物质后的铝箔作为工作电极,在30 g/L H2SO4+28.9 g/L Na2SO4溶液体系中进行线性扫描伏安测试[11-12]。扫描速率为5 mV/S,采样间隔为0.001 V,电流参考方向取阴极电流为正,如未经特殊说明,文中所述的电位值均指相对于饱和甘汞电极,结果如图3所示。
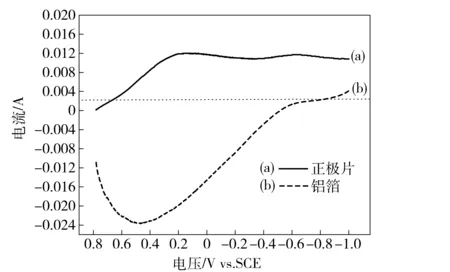
图3 不同工作电极的线性扫描伏安曲线
图3中,曲线(a)为以正极片做工作电极的线性扫描伏安曲线,随电极电位负移,电流指数先增大,后趋于平缓。由于正极片是由钴锂膜和铝箔两个部分粘结而成,而两个部分分别存在电极反应,故该曲线叠加曲线。曲线(b)为铝箔做工作电极的线性扫描伏安曲线,在电极电位0.48 V左右出现了一个明显的氧化峰,此峰为析氧峰。当阴极电位扫描至-0.53 V时,腐蚀电流为0,铝箔在此电位下可以得到完全保护。电位继续负移则开始出现还原电流,此时H2开始在铝箔表面析出。
为了研究LiCoO2电化学还原行为,依据图3曲线(a)与曲线(b)得到未叠加时钴酸锂的电化学行为曲线如图4所示。

图4 钴锂膜电极的模拟线性扫描伏安曲线
由图4可看出,在电极电位0.30 V显现出一明显的还原峰,峰电流为0.032 A,依据上节所述LiCoO2还原的热力学行为,根据相应的电位与体系的pH值(pH=0.67),可知此处为LiCoO2被还原为Co2+,即此峰是LiCoO2还原为Co2+的特征峰,并且峰比较尖锐,因此证明LiCoO2能够通过阴极电解进行浸出。由图4还可看出,当阴极电位接近-0.58 V时,电流的下降趋势变缓,这是由于铝箔表面由原来的析氧反应转变为析氢反应且析氢程度相对微弱,与图3所示的-0.53 V基本吻合。
综上所述得到电化学还原工艺的电极反应如下:
阴极:
LiCoO2+ 4H++ e = Co2++ Li++ 2H2O
(1)
2H++2e=H2↑
(2)
阳极:
2H2O-4e=O2↑+4H+
(3)
3 电解浸出工艺参数优化试验
由以上理论计算和试验研究得出,一步完成LiCoO2的选择性浸出和正极粉同铝箔的最大限度分离是可行的,并且分析得到在浸出过程中最重要的因素为电位控制和pH值控制,因此本文研究了电解工艺中电流密度、硫酸浓度、温度和电解时间对钴和铝浸出率的影响,并优化电解浸出的工艺条件。该法工艺流程简单,可控性高,且“电子”作为清洁的还原剂[13-14],能有效避免二次污染,绿色环保。
3.1 电流密度对钴铝浸出率及电流效率的影响
在H2SO4浓度为40 g/L,反应温度为25 ℃,反应时间为120 min的条件下,研究电流密度对钴铝浸出率及电流效率的影响,结果如图5所示。
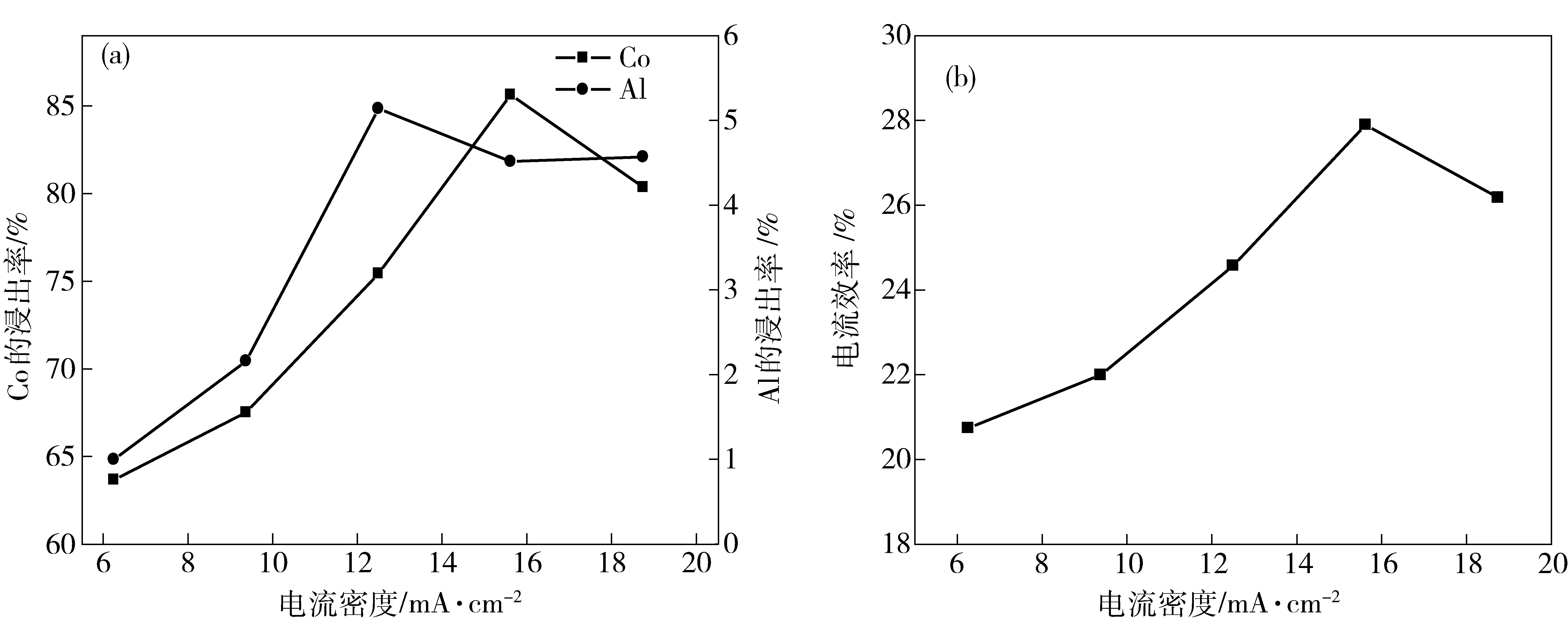
图5 电流密度对钴铝浸出率及电流效率的影响
电流密度对钴铝浸出率的影响如图5(a)所示。可见,电流密度增加,Co2+浸出率先随之增加,当电流密度大于15.63 mA/cm2时,Co2+浸出率出现下降,这一结果主要是由LiCoO2和H+在阴极还原时相互竞争、此消彼长所引起的。电流密度偏小时,随电流密度的增加,LiCoO2的氧化作用加强,因为LiCoO2比H+更容易得电子,其中LiCoO2/Co2+的标准电极电位为1.337 V,H+/H2的标准电极电位为0 V。当电流密度大于15.63 mA/cm2时,在较高的过电位下,H+阴极放电的竞争优势加大,LiCoO2的还原则受到抑制。电流效率与钴浸出率随电流密度的变化趋势基本一致(见图5(b))。电流效率是评价电解浸出工艺经济效益的重要参数,析氢、沉钴等副反应以及热效应对电流造成损耗,其中以析氢反应的负面影响最大。从图5(a)中还可以看出,铝的溶解率随电流密度的增加基本呈上升趋势,但在ic=12.5 mA/cm2后略有下降。因此,电流密度的最佳值选取15.63 mA/cm2。
3.2 硫酸浓度对钴铝浸出率及电流效率的影响
固定电流密度为15.63 mA/cm2,反应温度为25 ℃,反应时间为120 min,考察硫酸浓度对钴铝浸出率及电流效率的影响,结果如图6所示。

图6 硫酸浓度对钴铝浸出率及电流效率的影响
硫酸浓度对钴铝浸出率的影响如图6(a)所示。可见,钴浸出率随硫酸浓度的增大先升高再降低,在硫酸浓度40 g/L时,钴浸出率达到最大。硫酸的作用包括两个方面:其一,降低体系的pH值;其二,离解出自由移动的离子担当载流子。维持一定的pH值,使LiCoO2直接还原为Co2+进入溶液,就需要足够高的硫酸浓度,但当硫酸浓度过高,H+阴极还原加剧。大量析氢产生的机械力破坏了电极粉与铝箔的粘结作用,发生阴极剥离,减缓了电解浸出的反应速率,导致钴浸出率偏低。上述解释同样适用于电流效率随硫酸浓度的变化规律(见图6(b))。从图6(a)中还可以看出,随硫酸浓度的增加,铝的溶解率也随之增加,当硫酸浓度达到40 g/L后,铝的溶解率随硫酸浓度变化趋势略微减小。综合分析,硫酸浓度的最优值确定为40 g/L。这与以往研究LiCoO2酸浸所使用的硫酸浓度(200~400 g/L)[2]相比,本工艺中所使用的硫酸浓度较低。
3.3 温度对钴铝浸出率及电流效率的影响
在电流密度为15.63 mA/cm2,硫酸浓度为40 g/L,反应时间为120 min的条件下,研究温度对钴铝浸出率及电流效率的影响,结果如图7所示。
温度对钴铝浸出率的影响如图7(a)所示。可见,温度对钴、铝浸出率的都有一定的影响。随温度的升高,钴浸出率缓慢增大,当温度达到45 ℃后钴浸出率随温度的变化趋于平缓。从图7(b)可看出,电流效率随温度的变化呈现相同趋势。升高温度可同时促进LiCoO2和H+的阴极还原,但对LiCoO2的促进作用比对H+的促进作用明显。同时,铝溶解率随温度的升高增加比较明显。因此选取温度45 ℃为最佳值。这一温度远低于以往酸浸研究中所选用的温度[14]。
3.4 电解时间对钴铝浸出率及电流效率的影响
在电流密度为15.63 mA/cm2,硫酸浓度为40 g/L,反应温度为45 ℃的条件下,研究反应时间对钴铝浸出率及电流效率的影响,结果如图8所示。
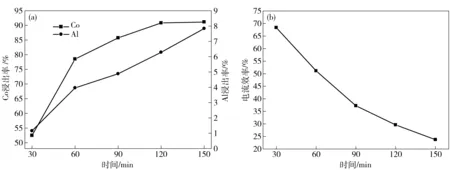
图8 电解时间对钴铝浸出率及电流效率的影响
电解时间对钴浸出率的影响如图8(a)所示。可见,钴浸出率随时间的延长明显增大,且增大的速率越来越慢,大于120 min后则变化不明显。这主要是由于在电解过程中正极极片的表面状态是改变的,进而影响其表面的阴极反应。电解初期,电极粉颗粒间以面接触为主,有利于电子的传递,LiCoO2的还原较为剧烈,即LiCoO2还原占优;但随着电解时间的延长,析氢副反应逐渐加剧,一方面是LiCoO2脱开钴锂膜造成空位,电子传递的通道部分中断,使得LiCoO2进一步还原的速率减慢;另一方面是电解后期,钴锂膜阴极剥离严重,由于集流体上的活性物质导电性远不如金属铝,电荷转移受到阻滞,LiCoO2浸出阻力变大。与之相应的是,电流效率随时间单调下降(见图8(b))。从图8(a)还可以看出,铝溶解率随着电解时间的延长呈现逐渐升高的趋势。因此可得出电解时间的最佳值为120 min。
4 结论:
本文以废旧锂电池正极材料为原料研究电解法在浸出过程中的应用,利用热力学基础数据计算论证了电解浸出的可能性,并确定了选择性浸出钴的热力学范围为体系的电位E>-0.277+0.029 6log[Co2+],体系pH>2.636-0.33log[Al3+]。采用线性扫描伏安法确定了LiCoO2阴极还原的可行性以及电极反应的详细过程,并确定LiCoO2电还原的特征电位为0.30 V(vs.SCE)。试验分别考察了电流密度、硫酸浓度、温度和电解时间对钴和铝浸出率的影响,并得出电解浸出的最佳条件。试验证明电解浸出法在一般氧化还原浸出过程中有一定的应用空间,为以后工艺发展提供思路和部分基础数据。
[1]Dorella G, Mansur M B. A study of the separation of cobalt from spent Li-ion battery residues[J]. Journal of Power Sources, 2007, 170(1): 210-215.
[2]张阳, 满瑞林, 王辉等. 综合回收废旧锂电池中有价金属的研究[J]. 稀有金属, 2009, 33(6): 931-935.
[3]Contestabile M, Panero S, Scrosati B. A laboratory-scale lithium-ion battery recycling process[J]. Journal of Power Sources, 2001, 92(1): 65-69.
[4]郭炳焜, 徐徽, 王先友. 锂离子电池[M]. 长沙: 中南大学出版社, 2002.
[5]吴宇平, 万春荣, 姜长印. 锂离子二次电池[M]. 北京: 化学工业出版社, 2002.
[6]梁英教, 车荫昌, 刘晓霞等. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社, 1993.
[7]马荣骏. 湿法冶金原理[M]. 北京: 冶金工业出版社, 2007.
[8]文士美, 赵中伟, 霍广生. Li-Co-H2O系热力学分析及E-pH图[J]. 电源技术, 2005, 29(7): 423-426.
[9]Yokokawa H, Sakai N, Yamaji K, et al. Thermodynamic determining factors of the positive electrode potential of lithium batteries[J]. Solid state ionics, 1998, 113:1-9.
[10]王常青, 丁毅, 马立群等. 不锈钢阴极保护方法和分类探讨[J]. 石油化工腐蚀与防护, 2008, 25(5): 32-36.
[11]杨铁军, 李国明, 陈珊等. 船用铝合金点蚀及阴极保护研究[J]. 装备环境工程, 2010, 7(2): 88-91.
[12]胡建军, 刘侦德, 李宇明等. 聚合物锂离子电池正极集流体材料的研制与应用[J]. 湖南有色金属, 2008, 24(5): 40-42.
[13]吕东生, 李伟善, 周震涛. 锂离子蓄电池铝集流体腐蚀的研究进展[J]. 电源技术, 2007, 31(10): 830-832.
[14]Chen L, Tang X, Zhang Y, et al. Process for the recovery of cobalt oxalate from spent lithium-ion batteries[J]. Hydrometallurgy, 2011, 108(1): 80-86.
[15]Müller B. Citric acid as corrosion inhibitor for aluminium pigment[J]. Corrosion science, 2004, 46(1): 159-167.
ApplicationofelectrolyticmethodinspentLi-Ionbatteryleachingprocess
ZHAO Peng-fei, YIN Xiao-ying, MAN Rui-lin
Taking the spent cathode material of Li-Ion battery as raw material, the application of electrolytic method in leaching process was studied. Based on the study of thermodynamic basis and electrochemical performance during the electrolytic leaching process, the conditions and electrode reaction were determined, and the optimization experiments of reaction conditions of electrolytic leaching was performed. The study results showed that under the conditions ofE>-0.277+0.029 6log[Co2+] and pH>2.636-0.33log[Al3+], the selective leaching of cobalt can be realized. When the current density is 15.63 mA/cm2, sulfuric acid concentration is 40 g/L, temperature is 45 ℃ and reaction time is 120 min, the electrolytic leaching rate of cobalt reaches 91.85% in one go, while the dissolving rate of aluminum is just 6.28%.
lithium cobalt oxide; thermodynamics; electrochemical; electrolysis; leaching
赵鹏飞(1986—),男,河北石家庄人,硕士,主要从事有色冶金设计研究工作。
TF111.52
B

