直肠癌保肛术后吻合口漏发生的影响因素
2014-08-08廖茂平
廖茂平
直肠癌保肛术后吻合口漏发生的影响因素
廖茂平
目的 探讨直肠癌保肛术后吻合口漏发生的影响因素。方法 对312例患者行直肠癌保肛术,必要的情况下行预防性肠造口。观察记录患者性别、年龄、BMI、ASA评分、糖尿病、术前血红蛋白、术前血清白蛋白、肿瘤位置、肿瘤与肛缘距离、新辅助化疗、肿瘤组织类型、T分期、病理分期、手术方式、预防性肠造口等情况。结果 患者年龄、术前血清白蛋白浓度、肿瘤与肛缘距离、新辅助化疗史是影响吻合口漏发生的因素,差异具有统计学意义(P<0.05)。性别、BMI、ASA评分、糖尿病史、术前血红蛋白浓度、肿瘤位置、肿瘤组织类型、T分期、病理分期、手术方式、预防性肠造口与吻合口漏发生无关(P>0.05)。结论 患者年龄、术前血清白蛋白浓度、肿瘤与肛缘距离、新辅助化疗史是影响吻合口漏发生的因素,临床需根据实际情况,充分考虑影响因素,确保手术顺利实施。
直肠癌保肛术;吻合口漏;影响因素
(ThePracticalJournalofCancer,2014,29:1631~1634)
吻合口漏是结直肠癌术后最严重的并发症之一,会引起腹腔的严重感染,对患者生命造成严重威胁[1]。同时吻合口漏会延迟术后辅助化疗的时间,增加局部复发的可能性,降低了患者的术后生存率。关于直肠癌保肛术后吻合口漏的影响因素,国内外研究略有差异。现对我院在该方面的研究报告如下。
1 资料与方法
1.1 一般资料
选取我院2009年至2014年收治的行直肠癌手术的患者312例为研究对象。患者在手术前均经B超、盆腔MRO检查等,对肿瘤情况进行评估,常规检查,排除心、肝、肺等器质性病变。
纳入标准[2]:①患者在手术之前,经直肠镜检查、病理诊断确诊为直肠癌;②患者完成的手术均为R0切除。
排除标准[3]:①排除术前发现远处脏器转移情况;②排除术中发现腹腔广泛种植转移;③排除大肠多原发癌病变;④排除肿瘤复发行二次手术情况;⑤排除行APR术、经肛门直肠肿物局部切除术等情况。
1.2 方法
1.2.1 术前准备 新辅助放化疗的指征是 T3~4 和(或)N1~2。具体方案如下:采取常规分割放射性治疗,针对“直肠系膜、髂内、闭孔、髂外近端淋巴引流区、骶前软组织”予DT4 500 cGy/25F,然后缩小视野到“直肠肿瘤原发灶”,并追量为 DT5 040 cGy/28F;XELOX同步化疗,时间为2个周期,放疗完成后2周,进行Folfox4化疗1个周期。
密切观察患者的全身营养状况,对于低白蛋白血症和贫血状况要予以纠正。对于血红蛋白<70 g/L的患者,需要输注悬浮红细胞,达到70 g/L及以上;对于血清白蛋白<30.0 g/L的患者,需要纠正为30.0 g/L及以上;稳定血压,使其波动范围在130/80 mmHg左右;控制餐前血糖在8.3 mmol/L及以下。对于进行新辅助放化疗的低位直肠癌女性患者,需要在手术前3天进行阴道冲洗,连续冲洗3 d。手术前1天,进行流质饮食。手术前1天下午1点,口服甲硝唑0.2 g,每2 h一次,4次/d。手术前1天,口服聚乙二醇电解质散,120 g;温开水3 000 ml。对于大便没有排净的患者,手术当天早晨进行洗肠清洁。手术前半小时,静脉头孢二代抗生素预防感染。对于手术时间超过3 h的患者,需要追加一个剂量。
1.2.2 手术方式 手术前向患者家属说明腹腔镜手术和开腹术的利弊后,由患者家属及患者选择手术方式。均签署知情同意书。根据术前病理检查等确定手术范围。对患者进行全麻后,按手术原则进行手术,准确进行手术入路、乙状结肠系膜剪裁、骶前隧道式分离、直肠闭合、直肠吻合等操作。
预防性肠造口指征[4]:患者年龄较高、营养状态差、吻合口距肛缘小于4 cm,术前曾接受过盆腔放疗治疗,或者对吻合不满意,计划行盆腔放疗等。多采用右上腹横结肠袢式造口。对于拒绝行预防性肠造口的患者,可经肛门放置肛管过吻合口减压,留置7天,度过肛内静息压高峰期后拔除。
1.2.3 观察指标 观察记录患者性别、年龄、BMI、ASA评分、糖尿病、术前血红蛋白、术前血清白蛋白、肿瘤位置、肿瘤与肛缘距离、新辅助化疗、肿瘤组织类型、T分期、病理分期、手术方式、预防性肠造口等情况。
1.2.4 吻合口漏诊断标准[5]根据漏口大小和严重程度进行分级。A级:不需要进行干预治疗;B级:需要进行积极的干预治疗;C级:需要进行剖腹探查。
吻合口漏判断:①术后腹部炎症,患者发热、腹痛等;②骶前引流管引流液突然增多,引流液混浊等;③经肛门造影等显示吻合口漏。符合任何一项即可判断为发生吻合口漏。
1.3 统计学方法
2 结果
2.1 直肠癌保肛术后吻合口漏发生情况
312例行直肠癌保肛术患者中,发生术后吻合口漏15例(4.81%),其中,造口组6例,未造口组9例。吻合口漏患者的主要表现为术后反复发热,体温波动较大,部分患者出现腹腔引流液浑浊情况,部分患者腹腔引流液细菌性培养结果为阳性,经肛门造影可见造影剂外漏至腹腔。所有患者平均住院时间为(13.54±5.82)d,吻合口漏患者术后平均住院时间为(23.14±6.27)d。患者未出现死亡病例。
2.2 直肠癌保肛术后发生吻合口漏的单因素分析
从对患者的15项临床资料结果分析后发现,发生吻合口漏的患者BMI为(22.65±4.12)kg/m2,与未发生吻合口漏患者BMI(23.04±2.89)比较,差异无统计学意义(P=0.075);术前血红蛋白含量发生吻合口漏的患者为(129.12±7.31),与未发生吻合口漏患者(128.09±6.22)比较,亦无统计学意义(P=0.925)。患者年龄、术前血清白蛋白浓度、肿瘤与肛缘距离、新辅助化疗史是影响吻合口漏发生的因素,差异具有统计学意义(P<0.05),而性别、BMI、ASA评分、糖尿病史、术前血红蛋白浓度、肿瘤位置、肿瘤组织类型、T分期、病理分期、手术方式、预防性肠造口与吻合口漏发生无关(P>0.05)。见表1。
3 讨论
大肠癌是临床常见的恶性肿瘤之一,分为结肠癌和直肠癌[6]。已有研究表明,大肠癌的发病率从高到低依次为直肠、乙状结肠、盲肠、升结肠、降结肠及横结肠,近年有向近端(右半结肠)发展的趋势[7]。大肠癌的发病多和患者的生活方式、遗传等因素有关,而且发病有趋于老年化发展的趋势[8]。大肠癌在发病早期无明显病症,患者多有不适、消化不良等症状,易被忽视[9]。
行直肠癌保肛术治疗时,发生吻合口漏是最严重的并发症之一[10]。吻合口漏的发生,会造成患者腹腔的严重感染,延长住院时间,增加患者经济压力,还危及生命安全[11]。发生吻合口漏的因素,大致可归纳为个体因素、术中因素和术后因素三大方面[12]。
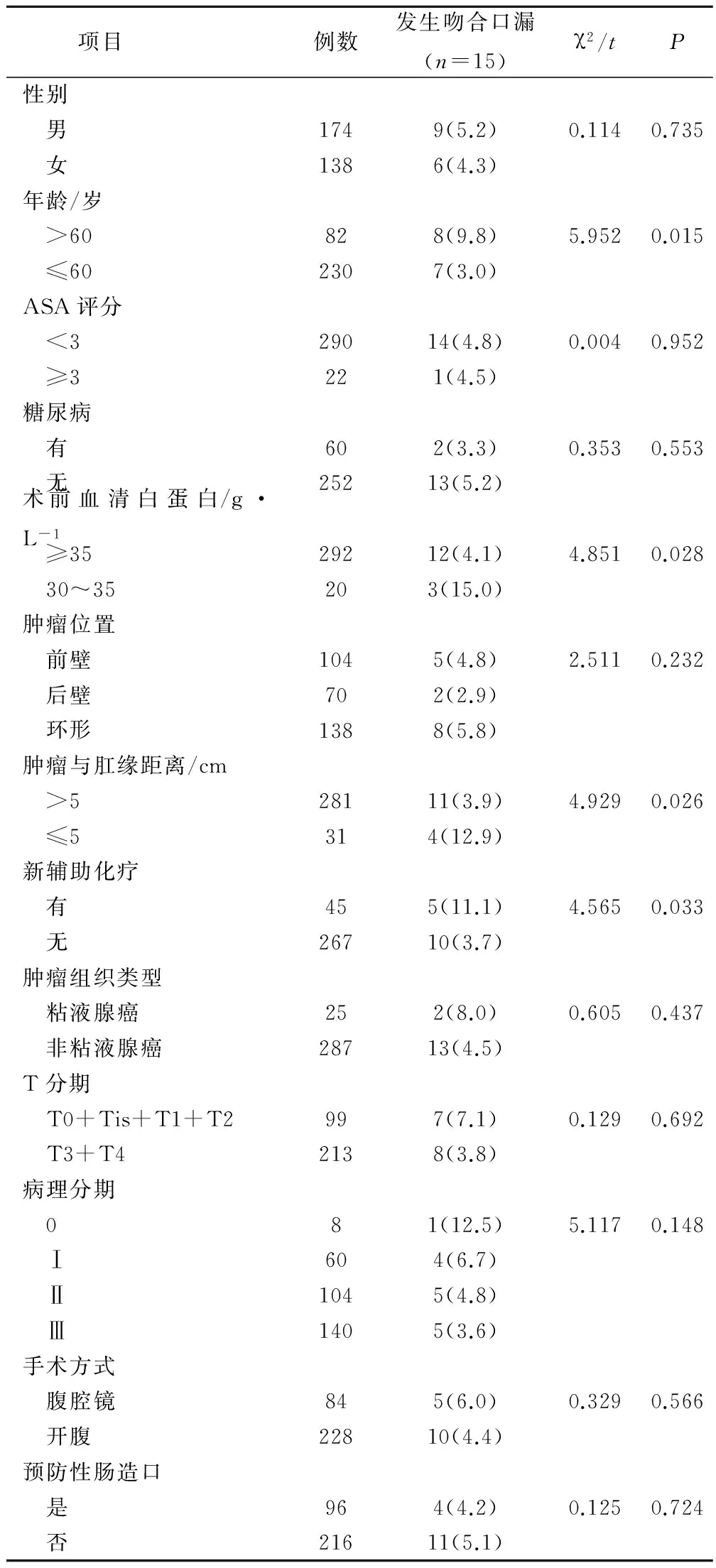
表1 直肠癌保肛术后发生吻合口漏的单因素分析/例
临床进行吻合口漏的检查包括白细胞、中性粒细胞、CT、腹部引流管造影等,直肠镜检查、剖腹探查Krarup等[13]也可。临床上进行吻合口漏的早期诊断有一定的难度,该病症临床表现不典型,一般以低热、便频等为主要表现[14]。一般可通过术后7天内发生早期腹泻进行判断。另外,有资料显示,吻合口漏的检查还可通过细胞因子水平IL-6、IL-10等的变化进行判断[15]。
患者发生吻合口漏后,会出现不同程度的吻合口周围炎症、盆腔感染等,可通过保守治疗和手术治疗进行[16]。保守治疗的原则是进行早期的充分引流和全身营养支持,创伤较小,并发症少,漏口愈合较快。然而,部分患者仍然需要手术干预。
对吻合口漏的影响因素进行分析,有助于积极的预防和治疗。资料显示,患者术前有新辅助化疗史、糖尿病史、吻合口血运不佳、吻合口出血等情况,都会影响到直肠癌保肛术后吻合口漏的发生。本文研究结果显示,患者年龄、术前血清白蛋白浓度、肿瘤与肛缘距离、新辅助化疗史与吻合口漏发生有关(P<0.05),而性别、BMI、ASA评分、糖尿病史、术前血红蛋白浓度、肿瘤位置、肿瘤组织类型、T分期、病理分期、手术方式、预防性肠造口与吻合口漏发生无关(P>0.05)。
总之,患者年龄、术前血清白蛋白浓度、肿瘤与肛缘距离、新辅助化疗史是影响吻合口漏发生的因素,临床需根据实际情况,充分考虑影响因素,确保手术顺利实施。
[1] Lin C,Zhang Z,Wang Y,et al.Continuous negative pressure-flush through extraperitoneal dual tube in the treatment and prevention for rectal cancer patients with anastomotic leakage after low anterior resection〔J〕.Zhonghua Wei Chang Wai Ke Za Zhi,2014,17(5):469-472.
[2] Xu BH,Chi P,Guo JH,et al.Pilot study of intense neoadjuvant chemoradiotherapy for locally advanced rectal cancer:retrospective review of a phase Ⅱ study〔J〕.Tumori,2014,100(2):149-157.
[3] Izumi D,Watanabe M,Nagai Y,et al.T-tube drainage and intercostals muscle flap reinforcement for the management of intrathoracic esophago-gastric anastomotic leakage with pyothorax:a case report〔J〕.Fukuoka Igaku Zasshi,2014,105(1):11-15.
[4] Beaton J,Carey S,Solomon MJ,et al.Preoperative body m- ass index,30-day postoperative morbidity,length of stay and quality of life in patients undergoing pelvic exenteration surgery for recurrent and locally-advanced rectal cancer〔J〕.Ann Coloproctol,2014,30(2):83-87.
[5] Giaccaglia V,Salvi PF,Cunsolo GV,et al.Procalcitonin,as an early biomarker of colorectal anastomotic leak,facilitates enhanced recovery after surgery〔J〕.J Crit Care,2014,pii:S0883-9441(14):136-137.
[6] 罗渊明,黄永安,张 超,等.低位吻合与超低位吻合术对直肠癌的疗效比较〔J〕.实用癌症杂志,2013,28(4):362-364.
[7] Wang G,Han G,Ren Y,et al.Clinical effects of pedicled omentum covering and wrapping the ureteral anastomosis to prevent ureteral anastomotic leakage after surgery of abdominal and pelvic tumors〔J〕.Zhonghua Zhong Liu Za Zhi,2014,36(3):232-235.
[8] Lee NK,Kim DY,Kim SY,et al.Clinical outcomes of local excision following preoperative chemoradiotherapy for locally advanced rectal cancer〔J〕.Cancer Res Treat,2014,46(2):158-614.
[9] Frostberg E,Strm P,Gerke O,et al.Infliximab's influence on anastomotic strength and degree of inflammation in intestinal surgery in a rabbit model〔J〕.BMC Surg,2014,14(1):23.
[10] 孙 宇,赵裕新,徐光明.直肠癌低位保肛术后局部复发的临床分析〔J〕.实用癌症杂志,2013,28(6):700-702.
[11] Vermeer TA,Orsini RG,Daams F,et al.Anastomotic leakage and presacral abscess formation after locally advanced rectal cancer surgery:Incidence,risk factors and treatment〔J〕.Eur J Surg Oncol,2014,pii:S0748-7983(14):381-383.
[12] Kim H,Chie EK,Ahn YC,et al.Impact on loco-regional c- ontrol of radiochemotherapeutic sequence and time to initiation of adjuvant treatment in stage Ⅱ/Ⅲ rectal cancer patients treated with postoperative concurrent radiochemotherapy〔J〕.Cancer Res Treat,2014,46(2):148-157.
[13] Krarup PM,Jorgensen LN,Harling H,et al.Management of anastomotic leakage in a nationwide cohort of colonic cancer patients〔J〕.J Am Coll Surg,2014,218(5):940-949.
[14] 陈海明,陈福佳,王金重,等.腹腔镜辅助结直肠癌手术并发症的临床分析〔J〕.实用癌症杂志,2014,29(1):59-61.
[15] Perez RO,Habr-Gama A,Smith FM,et al.Fragmented pattern of tumor regression and lateral intramural spread may influence margin appropriateness after TEM for rectal cancer following neoadjuvant CRT〔J〕.J Surg Oncol,2014,109(8):853-858.
[16] Lee JA,Yang D,Yoon WS,et al.Tumor volume reduction assessed by planning computed tomography in patients with rectal cancer during preoperative chemoradiation:impact of residual tumor volume on the prediction of pathologic tumor regression〔J〕.Tumori,2014,100(2):158-162.
(编辑:甘 艳)
Factors Affecting Anastomotic Leakage of Rectal Cancer after Anuspreserving Operation
LIAOMaoping.
EnshiCenterHospital,Enshi,445000
Objective To explore the factors affecting anastomotic leakage of rectal cancer after anuspreserving operation.Methods 312 cases of patients with colorectal surgery were researched.The preparatory work were finished,after general anesthesia,the operation were implemented according to the principles of surgery.The sex,age,BMI,the scores of ASA,diabetes,preoperative hemoglobin,preoperative serum albumin,tumor location,tumor and anal edge distance,neoadjuvant chemotherapy,tumor tissue types,T stage,pathological stage,surgery,preventive colostomy were analyzed.Results There were significant differences in age,preoperative serum albumin,tumor and anal edge distance,neoadjuvant chemotherapy and anastomotic leakage(P<0.05).There was no significant difference in sex,BMI,the scores of ASA,diabetes,preoperative hemoglobin,tumor location,tumor tissue types,T stage,pathological stage,surgery,preventive colostomy and anastomotic leakage(P>0.05).Conclusion Age,preoperative serum albumin,tumor and anal edge distance,neoadjuvant chemotherapy are factors affecting anastomotic leakage of rectal cancer after anuspreserving operation,influence factors should be taken into consideration in clinical to insure the smooth implementation of surgery.
Anuspreserving operation for rectal cancer;Anastomotic leakage;Factor
445000 湖北省恩施市中心医院
10.3969/j.issn.1001-5930.2014.12.039
R735.3+7
A
1001-5930(2014)12-1631-04
2014-06-04
2014-07-30)
