EP4在结肠癌细胞株HT29增殖中的作用
2014-08-08孙治国
高 岩 姜 浩 孙治国 高 健
EP4在结肠癌细胞株HT29增殖中的作用
高 岩 姜 浩 孙治国 高 健
目的 探讨PGE2诱导结肠癌细胞株HT29增殖和凋亡的机制,明确以EP4为靶点治疗结肠癌的作用途径。方法 将EP4抑制剂L161982按不同浓度作用于结肠癌细胞系HT29,用MTT(四甲基偶氮唑蓝比色法)法分别于作用12、24、48、72 h时检测细胞增殖状态;流式细胞仪检测细胞凋亡情况,进一步采用Western Blot法检测Caspase-3的表达。结果 EP4抑制剂L161982对结肠癌细胞系HT29呈时间、剂量依赖性方式抑制细胞增殖;流式细胞仪检测结果显示,随着L161982剂量增加,HT29细胞凋亡增强;凋亡蛋白Caspase-3表达水平随L161982剂量增加而升高。结论 PGE2可能通过EP4受体作用于结肠癌细胞,通过Caspase-3途径影响结肠癌细胞HT29的增殖与凋亡,这可能是结肠癌细胞增殖的分子机制。
前列腺素E2;前列腺素E受体4;HT29
(ThePracticalJournalofCancer,2014,29:1518~1521)
4种受体中EP4在人结肠癌细胞HT29存在量最大,EP4 通过与刺激型 G 蛋白(Gs)结合激活腺苷酸环化酶,并且提高细胞内cAMP的水平,能够调节细胞周期及增殖,抑制EP4能够降低结肠肿瘤细胞的增殖[4],但具体作用机制尚不明确。有研究表明,在肿瘤发生发展过程中PGE2途径失调诱发多种致癌信号,从而促进癌变[5]。越来越多的证据表明,PGE2及其受体是恶性肿瘤病理生理过程中的一个重要环节,在结肠癌的进展过程中起重要作用,对它的作用机制的研究及相关药物的开发将是相关领域的一个新热点。
1 材料与方法
1.1 试剂与仪器
人结肠癌细胞株 HT29(牡丹江医学院传代培养),胎牛血清(杭州四季青生物工程材料有限公司),流式检测凋亡试剂盒AnnexinV-FITC Apoptosis Detection Kit I(BD 上海基因公司),Caspase-3 兔抗人多克隆抗体、β-actin兔抗人多克隆抗体(SANTA上海中杉公司)、Fas兔抗人多克隆抗体、辣根过氧化物酶(HRP)标记山羊抗鼠二抗IgG(北京中杉金桥生物技术有限公司)、辣根过氧化物酶 (HRP)标记山羊抗兔二抗IgG,EP4抑制剂L161982(Cayman Chemical)。细胞培养所用仪器及Western blot 所使用试剂及仪器均为牡丹江医学院提供。
1.2 实验分组
分为 5组:正常对照组(Control组),常规方法培养;L161982不同剂量组 (Ll、L2、L3、L4组):加入L161982于 DMEM 培养基,使其终浓度分别为10、30、60、120 μM,常规方法培养。
1.3 试验方法
1.3.1 结肠癌细胞培养 人结肠癌HT29细胞,用DMEM培养基培养,培养基中加入10%胎牛血清,接种至细胞培养瓶后,置于37 ℃、5%CO2培养箱中培养。每天更换细胞培养液1次,每培养3~5 d传代 1次;取对数生长期细胞用于实验[6]。
1.3.2 MTT法检测细胞增殖抑制率 选取处于对数生长期的HT29细胞,经过处理制成混悬液后接种于96孔板内,每孔均加入细胞悬液 200 μL,细胞最佳接种密度为 2.5×10/L,置CO2培养箱中培养,24 h显微镜观察细胞贴壁,吸去原培养液后按不同组别处理加入培养基(每孔200 μL);以 DMEM 培养液作为空白对照孔,以含 0.1% 二甲基亚砜(DMSO)培养基作为阴性对照。取分别处理培养第12、24、48、72 h为检测点。于检测点时间每孔加入无菌MTT溶液20 μL,继续在原条件下CO2培养箱孵育4 h,吸去孔内培养液后每孔再加入150 μL DMSO,振荡 10 min,在酶标仪上测出各孔的A值。抑制率=(阴性对照组 A 值-实验组 A 值)/阴性对照组A值×100%。
通过政策的支持,河北省特色农产品先后通过淘宝、京东等电商企业平台,将农产品进行销售,带动河北省特色农产品行业发展,提升其品牌知名度。
1.3.3 流式细胞仪检测细胞凋亡率 参照Annexin V 细胞凋亡检测试剂盒说明书进行操作。细胞不同分组处理培养48 h后,每组收集1×106个细胞,冷PBS 洗涤 2 次,1 000 r/ min 离心,弃上清。将细胞重悬于1 mL 1×binding buffer,取100 μL 细胞置于流式细胞仪专用试管中,加5 μL AnnexinV FITC 和10 μL PI,轻轻混匀,避光室温反应15 min,加入300 μL 1×binding buffer,应用流式细胞仪进行检测分析,CellQuest软件分析结果。
1.3.4 采用 Western Blot法检测细胞中Caspase-3蛋白的表达 HT29细胞,经不同分组处理后,提取总蛋白,测定总蛋白质浓度。等量蛋白质进行SDS-聚丙烯酰胺凝胶(PAGE)电泳,转移蛋白质至硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,用鼠多克隆抗Caspase-3抗体在5%的脱脂奶粉中4 ℃过夜。二抗为辣根过氧化物酶标记的抗鼠抗体,室温1 h,最后用增强化学发光(ECL)自显影显像在胶片上,膜用洗脱液洗脱后检测β-actin的表达。应用Gel-pro Analyzer 4.0图像分析软件,测得目的蛋白条带积分光密度值,以各组β-actin条带的积分光密度值对Caspase-3蛋白表达量进行标化。
1.4 统计处理
所有影像用Scion Image 软件量化处理,统计学分析应用Statview软件的单因素方差分析(One-wayANOVA),P<0.05为有显著性差异。
2 结果
2.1 各组不同时间点HT29细胞的增殖抑制率(MTT比色测定法)
2.1.1 不同剂量组同一时间点比较 与对照组比较,各剂量组细胞的增殖抑制率在药物干预第 12、24、48、72 h时间点均显著升高,有显著性差异 (P<0.05);L2、3、4组与前一组比较,细胞增殖抑制率有显著性差异 (P>0.05),见图1。结果表明抑制EP4能够抑制人结肠癌细胞 HT29的生长增殖,且抑制率随着抑制剂剂量增大而升高,呈现显著的剂量相关性。
2.1.2 同一剂量组不同时间点比较 与对照组相比,除 Ll组外其余3组抑制率均有不同程度增高,差异具有统计学意义;L2、3、4组作用24 h的抑制率明显增高,与12 h时间点比较差异有统计学意义 (P<0.05);其后随着时间延长,细胞增殖抑制率进一步升高,见图1。结果表明L161982的增殖抑制作用随着作用时间的延长而增强,存在较明显的时间依赖关系。

图1 MTT比色法测定HT29细胞的增殖抑制率
2.2 各组HT29细胞凋亡率
L2、3、4剂量组培养第24h检测细胞凋亡率,contro1组HT29细胞极少发生凋亡,L2、3、4组细胞凋亡率明显增高,与 control组比较存在显著差异(P<0.05,n=3),L4组凋亡最明显,见图2。
2.3 Caspase-3蛋白的表达
Caspase-3在contro1组HT29细胞中表达水平较低;L161982各剂量组Caspase-3表达水平均明显上调,与对照组比较有显著统计学差异 (P<0.05,n=3),其中L4组的表达水平最高,提示L161982可有效增加Caspase-3蛋白表达,见图3。

图2 流式细胞技术检测HT29细胞凋亡情况
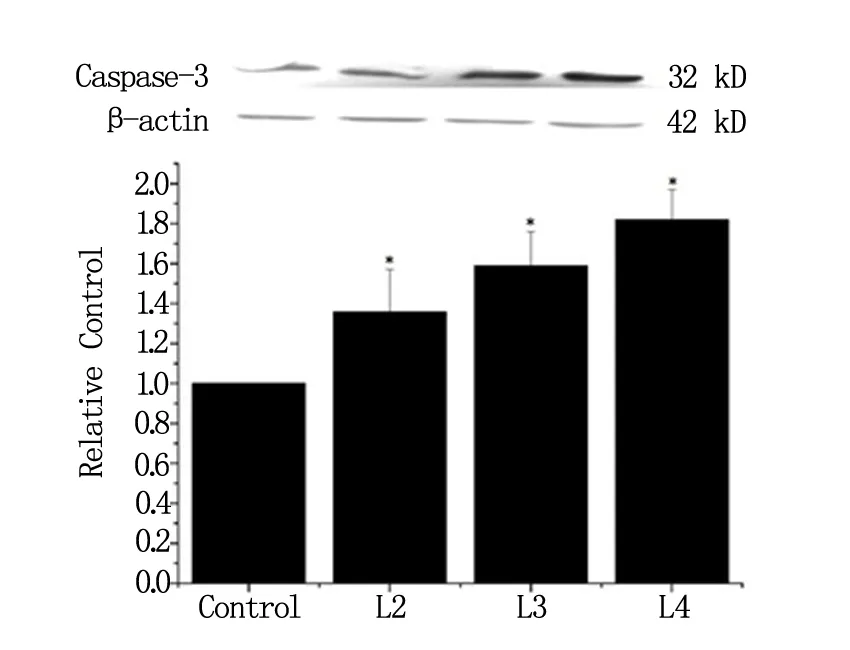
图3 L161982对HT29细胞Caspase-3表达的影响
3 讨论
研究表明,PGE2及其受体是恶性肿瘤增殖转移过程中的一个重要环节[7-8],最新研究中有科学家表明EP4受体在肿瘤的病理过程中发挥重要作用[9-11]。本实验探讨了EP4受体在人结肠癌细胞HT29中的作用,对PGE2 受体的研究将为治疗结肠癌更加特异的治疗靶点。
细胞凋亡在肿瘤的发生、发展及抗肿瘤药物的治疗中起着重要作用,细胞凋亡启动和执行的发生过程受到精确调控,存在于细胞浆中的Caspases家族蛋白启动和执行凋亡过程中起到关键作用,细胞凋亡的主要效应因子为Caspase-3[6,12-13]。
本研究首先采用MTT法来观察L161982对HT29细胞增殖的影响,结果发现在药物干预后48 h与72 h时间点,L161982预处理细胞中各剂量组的抑制率均最高,基于上述预实验结果,第48 h时间点作为检测观察点。此外,在不同剂量组同一时间点的比较中,EP4抑制剂L161982各剂量组均能抑制人结肠癌HT29细胞增殖,且抑制率随着抑制剂浓度增大而升高,其中以L3组增殖抑制率最高。以上结果可表明抑制EP4后可明显抑制人结肠癌细胞的增殖,且抑制增殖的作用存在较明显的时间、剂量相关性。为了进一步探讨上述抑制增殖作用是否通过诱导细胞的凋亡而实现,我们使用流式细胞技术和Western Blot进行检测,后发现这种损伤作用以细胞凋亡为主,凋亡蛋白Caspase-3 的表达增高,Annexin V/PI检测结果与Western Blot法检测结果一致,Caspase-3蛋白的表达在EP4抑制剂各剂量组均明显升高,且存在一定的量效相关性,在对照组仅有少量表达,该结果提示抑制EP4而抑制HT29细胞增殖可能是通过Caspase-3来启动细胞凋亡信号转导途径。
本实验初步表明抑制EP4能够诱导结肠癌细胞HT29凋亡,且存在着一定的剂量相关性。综上所述,本实验从细胞和分子水平证实了PGE2的抑制肿瘤细胞凋亡和增加肿瘤细胞的转移作用可能是通过受体EP4这一途径实现。
[1] Na HK,Surh YJ.Peroxisome proliferator-activated receptorγ (PPAR-γ) ligands as bifunctional regulators of cell proliferation 〔J〕.Biochem Pharmacol,2003,66(8):1381-1391.
[2] Nakanishi M,Menoret A,Tanaka T,et al.Selective PGE(2) suppression inhibits colon carcinogenesis and modifies local mucosal immunity〔J〕.Cancer Prev Res,2011,4(8):1198-1208.
[3] Lee DK,George SR,O'Dowd BF.Continued discovery of ligands for G protein-coupled receptors〔J〕.Life Sci,2003,74(2-3):293-297.
[4] Glen AD,Sinead MB,Eamonn SM,et al.Proneaplastic effe- cts of PGE2 mediated by EP4 receptor in colorectal cancer〔J〕.BMC Cancer,2009,9:207.
[5] Wu WK,Sung JJ,Lee CW,et al.Cyclooxygenase-2 in tumorigenesis of gastrointestinal cancers:an update on the molecular mechanisms〔J〕.Cancer Lett,2010,295(1):7-16.
[6] 田 波,傅颖珺,田 亮,等.槲皮素对人结肠癌细胞HT29的增殖抑制及诱导凋亡的体外实验研究〔J〕.南昌大学学报(医学版),2012,52 (4):16-21.
[7] Kaur J,Sanyal SN.PI3-kinase/Wnt association mediates C- OX-2/PGE(2) pathway to inhibit apoptosis in early stages of colon carcinogenesis:chemoprevention by diclofenac〔J〕.Tumour Biol,2010,31(6):623-631.
[8] Xue X,Shah YM.Hypoxia-inducible factor-2αis essential in activating the COX2/mPGES-1/PGE2 signaling axis in colon cancer〔J〕.Carcinogenesis,2013,34(1):163-169.
[9] Chandramouli A,Onyeagucha BC,Mercado-Pimentel ME,et al.MicroRNA-101 (miR-101) post-transcriptionally regulates the expression of EP4 receptor in colon cancers〔J〕.Cancer Biol Ther,2012,13(3):175-183.
[10] Wu CH,Shih YW,Chang CH,et al.EP4 upregulation of Ras signaling and feedback regulation of Ras in human colon tissues and cancer cells〔J〕.Arch Toxicol,2010,84(9):731-740.
[11] Cherukuri DP,Chen XB,Goulet AC,et al.The EP4 receptor antagonist,L-161982 blocks prostaglandin E2-induced signal transduction and cell proliferation in HCA-7 colon cancer cells〔J〕.Exp Cell Res,2007,313(14):2969-2979.
[12] Suzuki M,Endo M,Shinohara F,et al.Differential apoptotic response of human cancer cells to organoselenium compounds〔J〕.Cancer Chemother Pharmacol,2010,66(3):475-484.
[13] Hengartner MO.Apoptosis:Death cycle and Swiss armykni- ves〔J〕.Nature,1998,391(6666):441-442.
(编辑:吴小红)
Effect of EP4 on HT29 Cell Proliferation
GAOYan,JIANGHao,SUNZhiguo,etal.
HongQiHospitalofMudanjiangMedicalSchool,Mudanjiang,157011
Objective To observe the effect of prostaglandin E2 receptor4 on HT29 proliferation.Methods HT29 cells were pretreated with L161982,antagonist of EP4.MTT was added to measure the cell viability.HT29 apoptosis was measured by Flow Cytometry.Protein expression of Caspase-3 was examined by Western Blot.Results The survival rate of HT29 cells that were pretreated with L161982 was significantly lower than those without pretreatment (P<0.05).The expression levels of Caspase-3 and cell apoptosis increased significantly after pretreatment.Conclusion EP4 is involved in the pathogenesis of HT29 cells proliferation and apoptosis induced by L161982,and this may be molecular mechanism of proliferation of colon cancer cells.
Prostaglandin E2;Prostaglandin EP4;HT29
黑龙江省卫生厅科研课题(No.2011-308)
157011黑龙江省牡丹江医学院红旗医院(高 岩,姜 浩,孙治国);157000 中国人民解放军93383部队医院(高 健)
10.3969/j.issn.1001-5930.2014.12.002
R735.3+7
A
1001-5930(2014)12-1518-04
2014-07-08
2014-09-14)
