心肌组织特异性高表达核仁素转基因小鼠的构建与鉴定*
2014-08-08刘艳娟蒋碧梅童中艺李媛彬肖献忠
刘艳娟, 周 斌, 蒋碧梅, 童中艺, 孙 丽, 李媛彬, 肖献忠
(中南大学湘雅医学院病理生理教研室,湖南 长沙 410078)
核仁素(nucleolin, Ncl)是目前发现的271种核仁蛋白质中含量最多的一种,约占核仁蛋白质总量的10%[1],是细胞内一个非常重要的具有多功能的穿梭蛋白。研究表明,核仁素具有多种生物学功能,如调控核糖体的生物合成与成熟,调控细胞增殖、生长、胚胎发生、胞质分裂、染色质复制与核仁的发生等过程[2-5]。本实验室前期工作中发现氧化应激导致的心肌细胞及内皮细胞发生凋亡时伴有核仁素的断裂及表达下调[6-7];核仁素过表达则可明显增强心肌细胞的抗损伤能力[8]。目前已有研究使用转基因小鼠进行整体水平实验[9],但现阶段对核仁素的心肌保护作用及其机制的研究往往只局限于细胞水平,缺乏整体水平证据。本研究建立并鉴定了携带有外源核仁素基因的转基因小鼠, 为从整体水平上研究核仁素对心肌功能的影响, 并为其发挥心肌保护作用的机制研究提供动物模型。
材 料 和 方 法
1 材料
H9C2细胞(大鼠心肌细胞株)由本校细胞中心提供。pcDNA3.l质粒为我科室保存,含α-肌球蛋白重链(α-myosin heavy chain, α-MyHC)启动子的质粒Alpha-MyHC clone 26为南京大学模式动物研究中心馈赠。C57BL/6小鼠购买于南京大学模式动物研究中心。GAPDH单克隆抗体购于Cell Signaling。兔抗核仁素单克隆抗体购于Sigma-Aldrich。辣根过氧化物酶标记的羊抗小鼠、山羊抗兔均购自Boster Biological Technology。
2 方法
2.1质粒 Alpha-MyHC clone 26-Ncl的建立 提取小鼠心脏总RNA,用 RT-PCR 扩增小鼠Ncl全长cDNA,将扩增片段插入 pcDNA3.1 载体,经测序并比对正确无突变碱基后,以SalI内切酶酶切,回收Ncl片段,并克隆入α-MyHC启动子下游构建心脏特异性核仁素表达载体(Alpha-MyHC clone 26-Ncl),挑取抗氨苄青霉素的阳性克隆菌并扩增后,用小量质粒DNA提取试剂盒抽提质粒。一部分采用SalI内切酶进行酶切鉴定,一部分测序鉴定。
2.2心脏特异性高表达核仁素转基因小鼠的建立 此工作委托南京大学模式动物研究中心完成。将Alpha-MyHC clone 26-Ncl 质粒采用显微注射的方法注入小鼠受精卵雄性原核,将注射后的受精卵移植入假孕小鼠输卵管内,获得首建小鼠。
2.3转基因小鼠基因型的鉴定 剪取5 mm小鼠尾巴,提取尾巴组织DNA,并委托上海生物工程技术服务有限公司设计并合成核仁素PCR扩增引物,上游引物5’-AGTGAGGAAGATGCCAAAGC-3’,下游引物5’-GAAGGACACCTAGTCAGACA-3’。再以提取的小鼠尾巴组织DNA为模板进行PCR扩增反应,PCR产物用1.5%琼脂糖凝胶电泳检测,溴化乙啶染色后于紫外透射仪摄像。
2.4Western blotting法检测各组织中Ncl的表达 分别取转基因小鼠的肝、肾、脑、心脏组织,提取各组织中的蛋白后用BCA法测蛋白浓度,取30 μg蛋白裂解液经12% SDS-PAGE电泳分离,电转移法将胶上蛋白转至PVDF膜上,用封闭缓冲液室温下封闭4 h,然后加入兔Ncl单克隆抗体(1∶1 000稀释)于摇床上,室温下反应2 h。用洗膜液洗去I抗后,加入辣根过氧化物酶偶联的抗兔IgG II抗(1∶1 000稀释)于摇床上,反应1 h后,洗膜液洗去Ⅱ抗。用DAB显色,进行灰度扫描及定量分析。
3 统计学处理
用SPSS 13.0统计软件处理,数据以均数±标准差(mean±SD)表示,多组间比较采用方差分析,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
结 果
1 小鼠核仁素基因的心肌特异性表达质粒Alpha-MyHC clone 26-Ncl的建立与鉴定
为了构建心肌特异性高表达核仁素的转基因小鼠,我们首先采用SalⅠ内切酶分别酶切pcDNA3.1-Ncl和Alpha-MyHC clone 26质粒,再采用基因重组的方法,将小鼠核仁素基因插入至心肌特异性表达载体Alpha-MyHC clone 26)中,构建含小鼠核仁素基因的心肌特异性表达质粒Alpha-MyHC clone 26-Ncl,分别采用NotI和SalI进行酶切鉴定,结果显示SalI酶切后产生了一条约2.1 kb大小的片段,而NotI酶切后出现一条约3 kb大小的片段,与预期结果相符 (图1A),进一步测序鉴定其序列的正确性(图1B)。上述结果提示含有小鼠核仁素基因的心肌特异性表达质粒Alpha-MyHC clone 26-Ncl构建成功。
2 心肌特异性高表达核仁素转基因小鼠的鉴定
剪取少许小鼠尾巴提取组织DNA,采用PCR方法鉴定首建鼠(F0代)基因型,发现共有4只首建鼠为阳性小鼠,分别为51号、52号、56号和86号。其中首建鼠52号和86号繁殖良好,并保留有核仁素高表达特性。目前为止共繁殖到F6代。图2显示部分首建鼠基因鉴定结果。
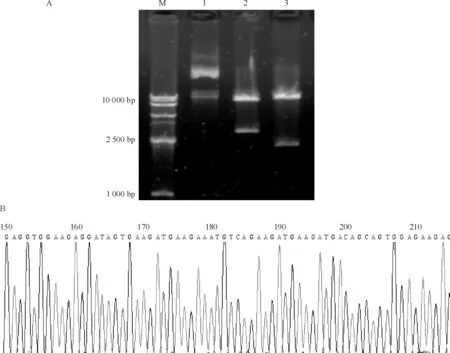
Figure 1. Identification of myocardium-specific nucleolin-expressing plasmid (Alpha-MyHC clone 26-Ncl) by restriction enzyme digestion (A) and sequencing (B). M: DNA marker; 1: without digestion; 2: digested by Not I; 3: digested by Sal I.

Figure 2. Identification of the founders by PCR.M: DNA mar-ker; P: positive control; B6: wild-type mice; N: negative control.
3 转基因小鼠心肌中核仁素的表达情况
分别剪取转基因小鼠与野生型小鼠心肌、肝、肺、肾和脑组织,提取组织蛋白后,采用Western blotting检测核仁素蛋白表达水平。结果显示,核仁素在转基因小鼠心肌组织中特异性高表达,转基因小鼠心肌组织中核仁素蛋白水平明显高于野生型小鼠(图3),其中52系首建鼠子代心肌组织内核仁素表达量约为野生型2.05倍,86系首建鼠子代心肌组织内核仁素表达量约为野生型3.61倍。
4 心肌特异性高表达核仁素对小鼠心脏重量指数(heart weight index,HWI)、心功能及心肌形态学的影响
分别称取转基因小鼠与野生型小鼠的体重与心脏重量,计算HWI(心脏重量/体重)。经统计学分析发现心脏体重指数未见明显差别,见图4A。采用PowerLab装置检测血流动力学参数,发现两者无明显差别,见图4B。收集各组的心肌组织,进行石蜡包埋、切片、HE染色,于显微镜下观察,发现两者心肌组织形态无明显差异,见图4C。这些结果表明,与野生型小鼠相比,核仁素转基因小鼠的心脏大小、心脏功能和心肌细胞形态无明显变化。

Figure 3. The expression of nucleolin (Ncl) protein in the myocardium and other tissues measured by Western blotting. A: expression of Ncl protein in cardiac tissues of transgenic (TG) and wild-type (WT) mice; B: expression of Ncl in myocardium and other tissues in transgenic mice (86 line). Mean±SD.n=6.*P<0.05 vs WT; #P<0.05 vs liver, lung, kidney or brain.
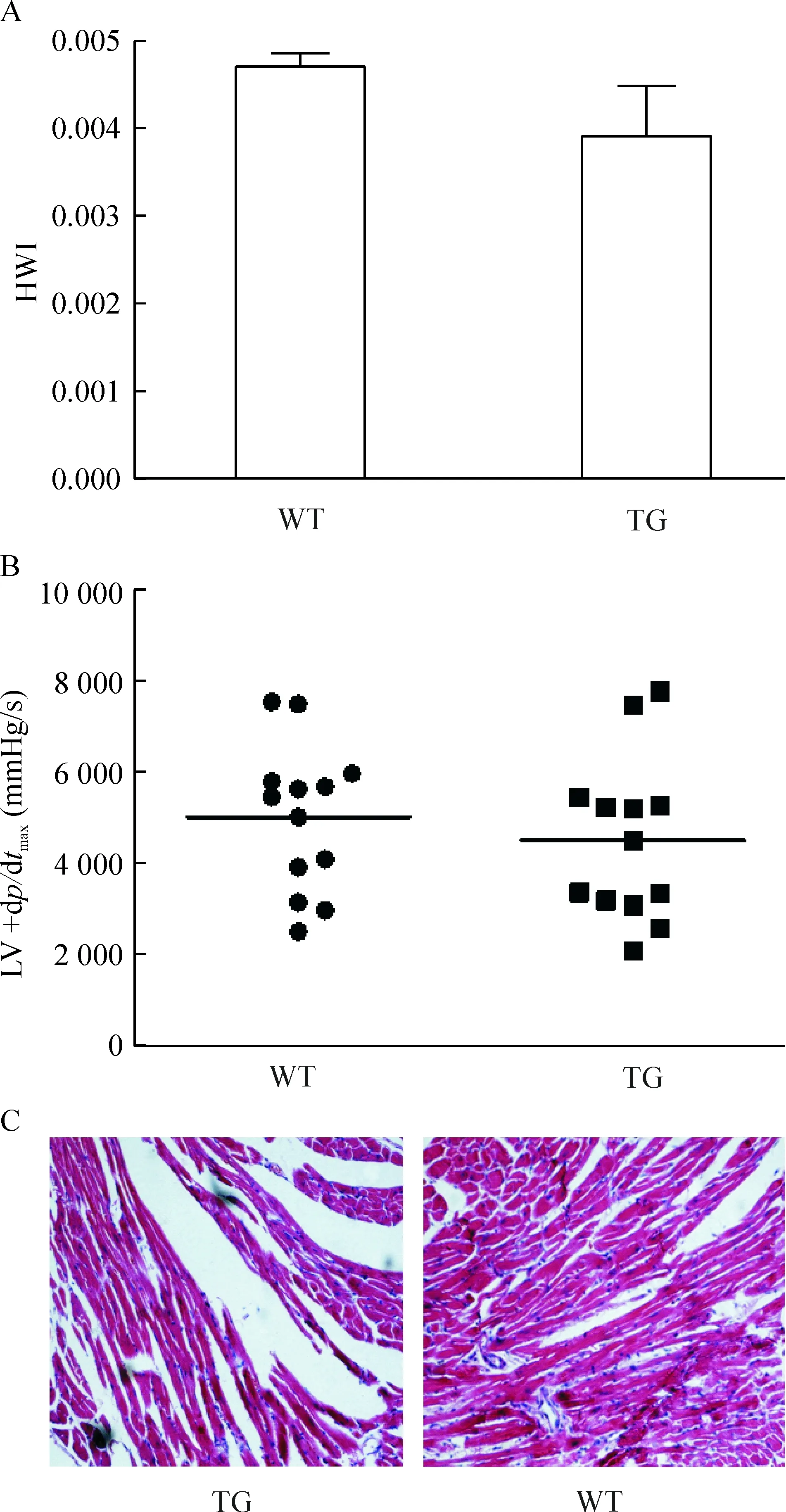
Figure 4. The effects of nucleolin overexpression on heart weight index (HWI; A), left ventricular pressure maximum rise rate (LV+dp/dtmax; B)and myocardial morphology (C; HE staining,×200) in transgenic mice.Mean±SD.n=6.
讨 论
核仁素作为细胞核仁中含量最丰富的磷酸蛋白具有多种生物学功能。本实验室前期工作中发现核仁素表达下调能触发心肌细胞凋亡,过表达则可明显增强心肌细胞的抗损伤能力[8],核仁素还可通过与HSP70 mRNA的 3’UTR 相结合, 增强 HSP70 mRNA 的稳定性, 上调HSP70的表达,进而在心肌缺血预适应中起作用[10]。整体动物水平实验发现,核仁素能调控热休克蛋白32的表达进而在心肌缺血再灌注诱导的心肌损伤中起保护作用[11]。但核仁素在整体动物水平是否起保护作用,目前尚不十分清楚。为了解决此问题,本研究构建了具有表达核仁素能力的真核质粒,然后用该序列构建带有心肌细胞特异性启动子的心肌细胞核仁素表达质粒,成功制备了转基因小鼠。
本实验中转基因小鼠的构建利用原核显微注射法,即将基因(真核表达质粒)注射到受精卵的雄性原核。该表达质粒的构建分两步实现:首先,以pcDNA3.1质粒为载体,插入小鼠核仁素表达序列,构建成pcDNA3.1-Ncl;其次,将pcDNA3.1-Ncl中的核仁素序列插入到Alpha-MyHC clone 26质粒中Alpha-MyHC启动子下游,构成Alpha-MyHC clone 26-Ncl心肌细胞特异性表达核仁素质粒。再利用其核仁素全长cDNA基因构建Alpha-MyHC clone 26-Ncl表达质粒,并以此进行显微注射,从而制备了核仁素的转基因小鼠。采用Western blotting方法观察到转基因小鼠心肌中核仁素表达量明显高于野生鼠;与野生型小鼠相比较,心肌中核仁素过表达对小鼠的心脏、心肌形态学改变及心功能改变无明显影响,提示心肌特异性高表达核仁素转基因小鼠构建成功。
本研究制备的心肌特异性表达核仁素的转基因小鼠,可作为整体动物模型用于核仁素蛋白的心肌保护作用及机制的研究,也可用于其它心血管疾病的研究。
[参 考 文 献]
[1] Anlbrosio G, Zwier JL,Beeker LC. Apoptosis is prevented by administration of superoxide dismutase in dogs with reperfused myocardial infarction[J]. Basic Res Cardiol,1998, 93(2): 94-96.
[2] Ginisty H, Sicard H, Roger B, et al. Structure and functions of nucleolin [J]. J Cell Sci, 1999,112(Pt 6):761-772.
[3] Marjan MT, Renu T, Narendra T. Nucleolin: the most abundant multifunctional phosphoprotein of nucleolus [J]. Commun Integr Biol, 2011,4(3):267-275.
[4] 王慷慨,蒋 磊,鄂顺梅,等. 核仁素表达下调对C2C12细胞增殖与凋亡的影响[J]. 中南大学学报: 医学版,2005,30(2):125-129.
[5] Roselló-Lletí E, Rivera M,Cortés R,et al. Influence of heart failure on nucleolar organization and protein expression in human hearts [J].Biochem Biophy Res Commun,2012,418(2):222-228.
[6] Wang K, Deng G, Chen G, et al. Heat shock protein 70 inhibits hydrogen peroxide-induced nucleolar fragmentation via suppressing cleavage and down-regulation of nucleolin[J]. Cell Stress Chaperones, 2012, 17(1): 121-130.
[7] Zhang B, Wang H, Jiang B, et al. Nucleolin/C23 is a negative regulator of hydrogen peroxide-induced apoptosis in HUVECs[J]. Cell Stress Chaperones, 2010, 15(3): 249-257.
[8] Jiang B, Zhang B, Liang P, et al. Nucleolin/C23 mediates the antiapoptotic effect of heat shock protein 70 during oxidative stress[J]. FEBS J,2010, 277(3):642-652.
[9] 官 杰,李 浩,刘剑刚,等. 还脑益聪方组分对APP转基因小鼠脑组织炎症因子和氧化应激的影响[J]. 中国病理生理杂志, 2011,27(4):732-738.
[10] 蒋碧梅. 核仁素对大鼠心肌缺血预适应中 HSP70 表达的影响及其机制[J].中国病理生理杂志,2010,26(10):1986.
[11] Jiang B, Zhang B, Liang P,et al. Nucleolin protects the heart from ischaemia-reperfusion injury by up-regulating heat shock protein 32[J]. Cardiovasc Res, 2013, 99 (1):92-101.
