远志皂苷元抗H/R诱导皮层神经元凋亡的机制初探*
2014-08-08赵严冬刘潘虹李学敏王华东陆大祥戚仁斌
赵严冬, 刘潘虹, 李学敏, 鲁 凡, 王华东, 陆大祥, 戚仁斌△
(1暨南大学医学院病理生理学系, 2国家中医药管理局病理生理实验室, 3暨南大学附属第一医院骨科,广东 广州 510632)
缺血缺氧性脑病是老年人的常见病和多发病,患者脑部血液循环受阻,局部组织缺血缺氧,引起神经元丢失最终导致神经功能缺失。目前研究认为,缺血缺氧性脑病引起的神经元迟发性死亡(delayed neuronal death)以凋亡为主[1]。缺血再灌注损伤是大多数缺血缺氧性脑病发病的主要机制,其中诱导神经元凋亡的主要因素包括氧化应激[2]、炎症反应[3]、细胞内钙超载以及线粒体损伤[4]等。
远志(polygala)是一种远志属远志科多年生草本植物,是我国常用的益智中草药,在益智、抗衰老、抗氧化等方面显示出独特的药理活性[5]。本课题组前期通过东莨菪碱所致小鼠学习记忆障碍模型、快速老化系SAM/P-8小鼠和AD细胞模型,对中药组方Q0409进行研究,发现远志的主要单体成分远志皂苷元(senegenin,Sen)是发挥神经保护作用的主要单体成分之一[6]。本研究拟采用原代神经元缺氧/复氧(hypoxia/reoxygenation,H/R)诱导凋亡的细胞模型,对Sen抗H/R诱导的神经细胞凋亡作用及其机制进行初步探讨,为Sen防治相关疾病提供理论基础和实验依据。
材 料 和 方 法
1 动物
新生24 h内健康Sprague-Dawley大鼠乳鼠,SPF级,雌雄不限,由南方医科大学实验动物中心提供,许可证号为SCXK(粤)2011-0015,合格证编码为No.4402101641。
2 主要试剂
远志皂苷元购自中国生物药品检验所;DMEM/F12培养基、DMEM/HG培养基购自Hyclone;Neurobasal培养基、B27购自Gibco;胎牛血清(fetal bovine serum,FBS)、PBS缓冲液购自HyClone;胰蛋白酶粉和青、链霉素双抗购自北京普博欣公司;厌氧产气剂购自日本三菱公司;厌氧培养袋购自法国梅里埃公司;Annexin V-PI凋亡检测试剂盒购自南京凯基公司;RIPA裂解液、蛋白酶抑制剂PMSF、SDS-PAGE凝胶试剂盒、5×上样缓冲液、BCA定量试剂盒购自碧云天公司;GAPDH、SAPK/JNK、phospho-SAPK/JNK、c-Jun、phospho-c-Jun、Bax和Bcl-2抗体购自Cell Signaling Technology;大鼠神经元特异性微管相关蛋白2(microtubule-associated protein 2,MAP-2)抗体、PVDF膜购自Millipore;其它生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1原代大鼠皮层神经元的分离培养 用75% 乙醇消毒新生鼠头部后放入超净工作台内,无菌条件下依次剥离皮肤、颅骨,分离出大脑组织置于预冷的PBS磷酸盐缓冲液中,用眼科弯镊分离出皮层组织,小心去除脑膜和血管,收集入含 2 mL DMEM/F12培养基的小玻璃瓶中,用眼科剪快速将组织剪成1 mm×1 mm×1 mm左右组织块。以上步骤均在4 ℃条件下(冰袋上面)进行。将剪碎的组织转移至装有DMEM/F12配制的0.125%胰蛋白酶消化瓶中,置于37 ℃培养箱内消化10 min,隔5 min摇匀1次,使之充分消化。向消化瓶内加入含10% FBS的DMEM/F12培养基终止消化,用尖端抛光的玻璃管轻轻吹打至无可见的组织块。将悬液通过200目筛网过滤,收集滤液移至15 mL离心管,4 ℃、1 200 r/min离心5 min后弃去上清液,加入neurobasal完全培养基(含2% B27),用尖端抛光的玻璃管轻轻吹打数次。取10 μL细胞悬液镜下计数,将细胞密度调为2×1010/L ,接种于0.25 g/L多聚赖氨酸提前包被的培养板中,置于37 ℃、5% CO2、饱和湿度的培养箱中培养。接种4 h后,用neurobasal完全培养基(含2% B27)全换液。继续培养至6 d,每隔2 d用neurobasal完全培养基(含2% B27)进行半换液。
3.2MAP-2免疫荧光染色鉴定原代神经元 弃去原培养基,用复温PBS静孵清洗3次,每次5 min。用4%多聚甲醛溶液室温固定神经元20 min。PBS洗细胞3次,每次5 min。用0.3% Triton X-100(300 μL Trion X-100+100 mL 5%山羊血清)室温处理细胞15 min。PBS清洗3次,每次5 min。用5%山羊血清室温封闭1 h。用抗体稀释液将MAP-2按1∶200的比例稀释, 滴于细胞爬片的细胞面,并将整个24孔板放入湿盒里,4℃孵育过夜。去除Ⅰ抗,用PBS洗细胞3次,每次5 min。FITC-辣根过氧化物酶标记的山羊抗小鼠IgG用抗体稀释液按1∶200的比例稀释,室温避光孵育1 h。用1∶200比例稀释Hoechst 33342 染核。用PBS洗细胞3次,每次5 min。在细胞爬片上滴加抗荧光淬灭液,荧光显微镜下观察拍照。
3.3实验分组 (1)正常对照组(control组):无血清DMEM/F12培养液培养15 h;(2) 模型组(H/R组):缺氧液无氧条件下培养12 h后添加等量无血清DMEM/HG培养液常氧培养3 h;(3) Sen保护处理组(Sen+H/R组):含60 μmol/L Sen的缺氧液无氧条件下培养12 h后,添加等量含60 μmol/L Sen无血清DMEM/HG培养液常氧培养3 h;(4) Sen处理组(Sen组):含60 μmol/L Sen的无血清DMEM/F12培养液培养15 h。
3.4流式细胞术检测细胞凋亡 6孔板培养细胞,按照上述实验分组进行实验。达到作用时间后,弃去培养液,用PBS洗2次,每次5 min。每孔加入0.25%胰酶1 mL,放入37 ℃培养箱1~2 min左右,轻轻并且迅速地吹打细胞使之悬浮于消化液中,然后加入含10% FBS的DMEM/F12培养基终止消化。待细胞消化完全后,转移入5 mL离心管中分组标记,配平并放入4 ℃离心机中,1 000 r/min离心5 min。轻轻吸去上清,在各组中加入binding buffer 200 μL,枪头吹打成单细胞悬液。避光条件下先后加入annexin V-FITC染料和PI染料各2 μL,孵育15 min。轻轻吹打混匀后,上机检测各组细胞凋亡率,作为造模的质量监控。
3.5Western blotting免疫印迹法检测JNK、p-JNK、c-Jun、p-c-Jun、Bcl-2和Bax的蛋白表达的变化 造模成功后,进行蛋白提取。弃去原培养基,用预冷PBS洗2次。每孔按比例加入细胞裂解液RIPA和蛋白酶抑制剂PMSF(RIPA∶PMSF=100∶1),冰上裂解40 min(每10 min用细胞刮刮1次),4 ℃、12 000 r/min离心15 min。取上清液,用BCA试剂盒进行蛋白定量后,将各组的蛋白浓度调成一致。向蛋白上清液内加入相应比例5×上样缓冲液,沸水浴5 min后立即置于-80 ℃冰箱保存。使用10% SDS-PAGE凝胶电泳分离所得蛋白(GADPH作为内参照),半干转法转移至PVDF膜上,室温下用合适的封闭液(5% 脱脂奶粉或者5% BSA)轻摇封闭PVDF膜1 h后,1×TBST洗膜3次,每次5 min。再分别加入相应Ⅰ抗(Ⅰ抗稀释液按说明书以适当浓度稀释)于4 ℃孵育过夜。取出PVDF膜,用1×TBST洗3次,每次10 min。加入相应的Ⅱ抗(1×TBST 按说明书以适当浓度稀释),室温孵育1 h后,1×TBST洗3次,每次10 min。用ECL发光液以及显影液、定影液发光显色,将膜上的蛋白印迹转移到胶片上,并且进行灰度扫描。实验重复3次。
4 统计学处理
数据以均数±标准误(mean±SEM)表示,多组间比较用单因素方差分析(One-way ANOVA)法进行统计学分析:各组方差齐性时,两两比较采用LSD法;各组方差不齐性时,两两比较采用Tamhane’s T2法。以P<0.05为差异有统计学意义。
结 果
1 大鼠大脑皮层原代神经元鉴定
新生大鼠皮质原代神经元采用含2% B27的无血清neurobasal完全培养基培养,以减少胶质细胞的影响。培养6 d后,用神经元特异性抗体MAP-2免疫荧光染色法对皮层神经元进行鉴定,结果见图1。使用免疫荧光的方法将FITC标记的Ⅱ抗与Ⅰ抗结合,并在 488 nm的激发光激发下,在激光共聚焦显微镜下观察细胞绿色荧光的分布情况,同时用Hoechst 33342 染细胞核。蓝色荧光标记的是细胞核,绿色荧光标记的是MAP-2。细胞中神经元的数量占细胞总数的80%以上,可用于后续实验,见图1。
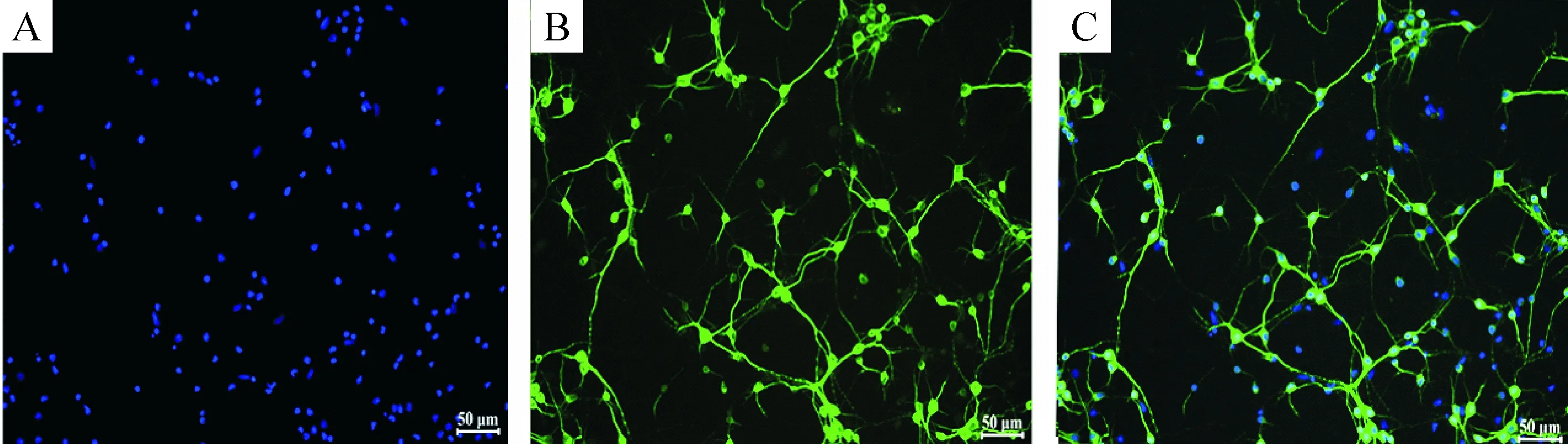
Figure 1. Immunocytochemical identification of cultured primary cortical neurons at DIV6 with anti-MAP-2 antibody (green) marker.A: Hoechst 33342; B: MAP-2; C: Merged. Scale bar=50 μm.
2 Annexin V-PI双染流式细胞术检测皮层神经元凋亡率
图2显示流式细胞术检测各组神经元凋亡率,control组和Sen组的凋亡率分别为6.9%、9.7%;H/R组凋亡率显著增加,达29.2%;H/R+Sen组细胞凋亡率低于H/R组,仅为11.4%。由表1可见,control组和Sen组的凋亡率分别为(8.5±2.9)%、(11.5±1.9)%;与control组比较,H/R组凋亡率显著增加,达(29.1±3.9)%(P<0.05);H/R+Sen组细胞凋亡率则显著低于H/R组[(14.1±3.4)%,P<0.05]。这一结果提示Sen可对抗H/R诱导的皮层神经元凋亡,造模成功。
3 Sen抗H/R诱导皮层神经元凋亡对JNK蛋白及下游信号通路的影响
3.1对JNK蛋白表达及磷酸化的影响 由图3可见,与control组(0.42±0.05)相比,H/R组JNK蛋白表达显著减少(0.32±0.10,P<0.05);与H/R组相比,H/R+Sen 组JNK蛋白表达显著增加(0.49±0.06,P<0.05)。同时,与control 组(0.26±0.15)相比,H/R组p-JNK蛋白表达显著增加(0.31±0.19,P<0.05);与H/R组相比,H/R+Sen 组p-JNK蛋白表达显著减少(0.24±0.08,P<0.05)。与control 组p-JNK/JNK(0.64±0.10)相比,H/R组p-JNK/JNK比值显著升高(0.98±0.14,P<0.05);与H/R组相比,H/R+Sen 组p-JNK/JNK比值显著降低(0.63±0.15,P<0.05)。
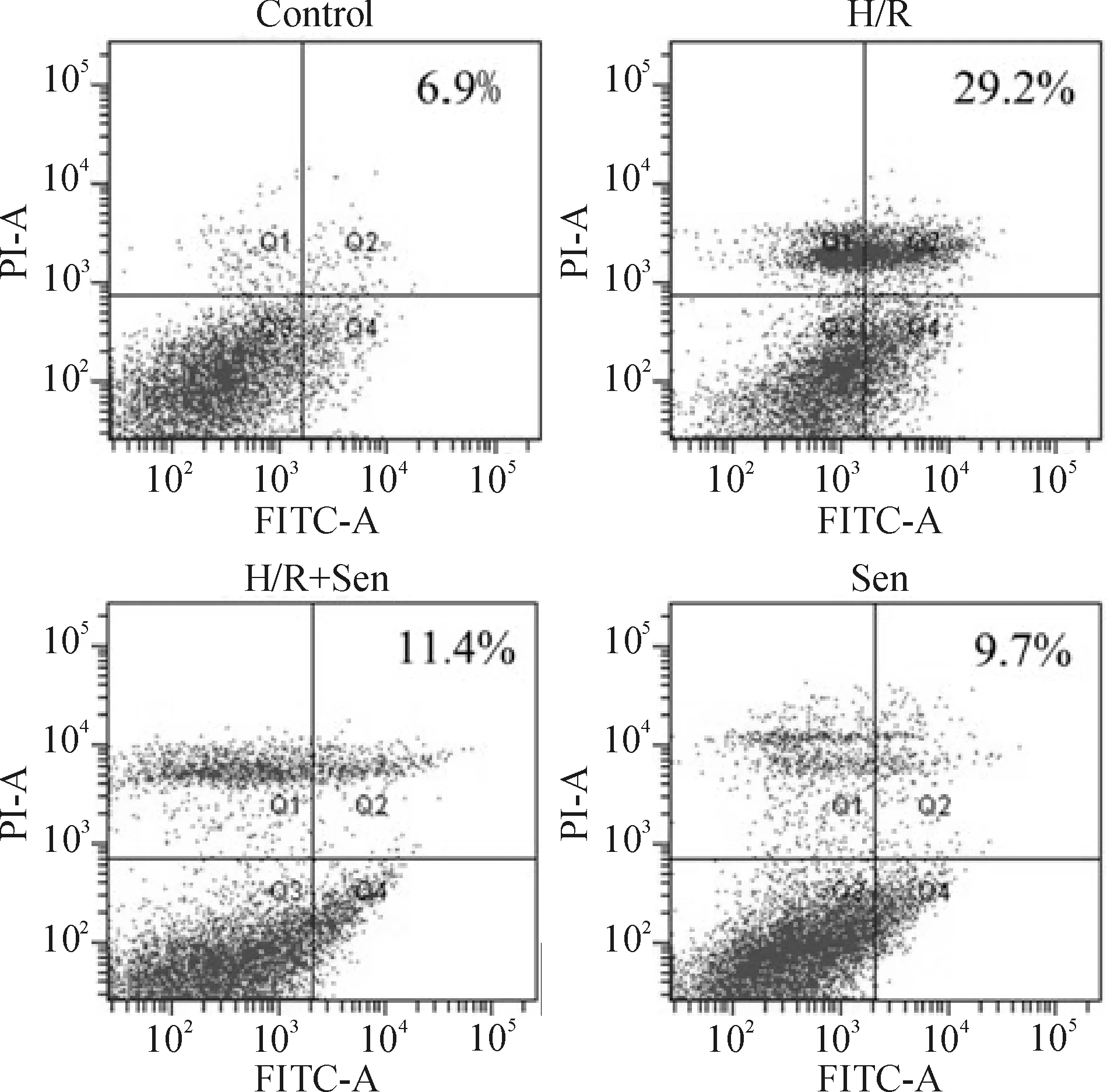
Figure 2. The effect of Sen on the H/R-induced apoptosis of primary cortical neurons examined by flow cytometry. The representative results of 3 independent experiments were shown.

表1 远志皂苷元对H/R损伤诱导的神经元凋亡的影响
3.2对c-Jun蛋白表达及磷酸化的影响 由图4可见,与control 组(0.39±0.14)相比,H/R组c-Jun蛋白表达显著减少(0.32±0.06,P<0.05);与H/R组相比,H/R+Sen 组c-Jun蛋白表达显著增加(0.41±0.05,P<0.05)。同时,与control 组(0.22±0.05)相比, H/R组p-c-Jun蛋白表达显著增加(0.33±0.26,P<0.05)。与H/R组相比,H/R+Sen 组p-c-Jun蛋白表达显著减少(0.25±0.05,P<0.05)。以control 组p-c-Jun/c-Jun为标准值进行比较,H/R组p-c-Jun/c-Jun相对值显著升高(1.20±0.14,P<0.05);与H/R组相比,H/R+Sen 组p-c-Jun/c-Jun相对值显著降低(0.84±0.19,P<0.05)。
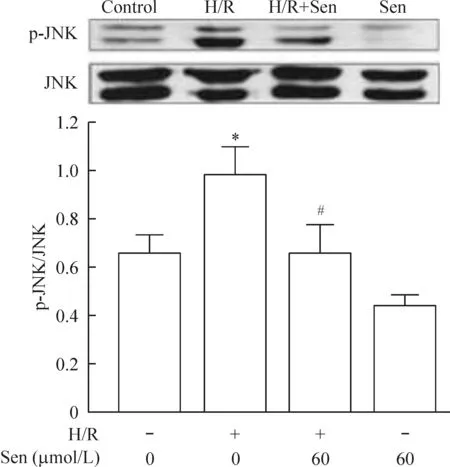
Figure 3. The effects of Sen on JNK expression and the phosphorylation of JNK in H/R-induced primary cortical neurons. Mean±SEM. n=3.*P<0.05 vs control; #P<0.05 vs H/R.
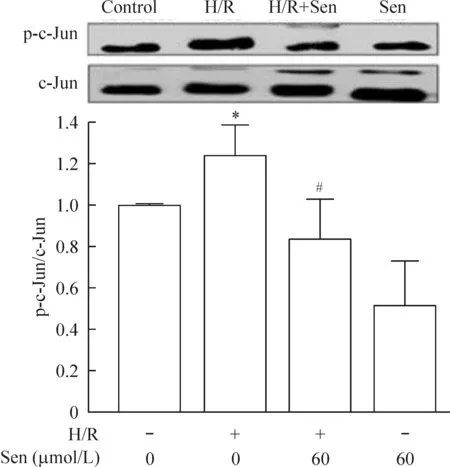
Figure 4. The effects of Sen on c-Jun expression and the phosphorylation of c-Jun in H/R-induced primary cortical neurons. Mean±SEM. n=3.*P<0.05 vs control; #P<0.05 vs H/R.
3.3Sen抗H/R诱导皮层神经元凋亡对Bcl-2、Bax蛋白表达的影响 由图5可见,与 control 组(Bcl-2 1.21±0.14, Bax 0.53±0.17)相比, H/R组Bcl-2蛋白表达显著减少(0.56±0.14,P<0.05),Bax蛋白表达显著增加(1.15±0.50,P<0.05)。与H/R组相比,H/R+Sen 组Bcl-2蛋白表达显著增加(0.79±0.20,P<0.05),Bax的蛋白表达显著减少(0.59±0.17,P<0.05)。
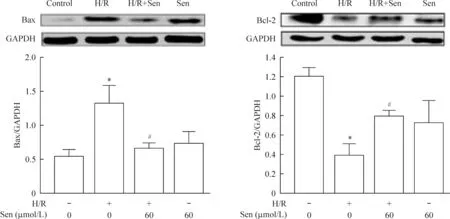
Figure 5. The effects of Sen on the expression of Bax and Bcl-2 in H/R-induced primary cortical neurons. Mean±SEM. n=3. *P<0.05 vs control; #P<0.05 vs H/R.
讨 论
已有研究证实,神经退行性疾病中神经元丢失多是由于凋亡信号通路被激活后诱发凋亡所致[7]。我们先前的研究以H/R损伤诱导的PC12细胞凋亡模型,证实Sen可对抗H/R诱导的PC12细胞凋亡,其机制可能是通过抑制NADPH氧化酶活化,减少活性氧生成,降低[Ca2+]i,维持线粒体膜电位,最终抑制caspase-3的活化[8]。本研究拟在先前研究基础上,通过建立原代皮层神经元的H/R模型,模拟神经元凋亡过程,在原代皮层神经元上研究Sen抗细胞凋亡的作用及对相关信号转导通路的影响。
有研究发现[9],在小脑颗粒神经元H/R模型中,神经元凋亡率升高与JNK的磷酸化增加有关。Koga等[10]在对神经母细胞瘤H/R模型的研究中发现,过表达MKP-1可以抑制JNK的磷酸化,抑制凋亡基因的表达,从而减少H/R模型中神经细胞的凋亡;而沉默MKP-1基因可以升高JNK的磷酸化水平,最终导致神经细胞凋亡增加。此结果提示了JNK参与神经细胞凋亡过程的调节,并且其磷酸化水平与神经细胞凋亡率有关。Zhao等[11]在对神经细胞的研究中发现,缺血再灌注损伤可以活化Cdc42,促进Cdc42-MLK复合体的形成及JNK信号通路的激活,而选择性敲低Cdc42可抑制MLK3-MKK7-JNK级联反应,阻滞c-Jun的磷酸化及FasL 的表达、Cyt C的释放及caspase-3的活化,减轻再灌注后神经细胞凋亡等,提示c-Jun磷酸化水平亦与神经细胞凋亡有关。此外,Relja等[12]在对肝细胞H/R模型的研究中发现,H/R模型中Bcl-2表达水平明显降低;Liu等[13]采用Zea-Longa法构建大鼠缺血再灌注模型,通过在不同时点对各组大鼠进行行为学检测并且通过免疫组化和TUNEL法检测海马不同区域caspase-3、Bcl-2和Bax 表达情况发现,模型组行为学发生改变,caspase-3表达增加,Bcl-2表达减少而Bax表达增加,说明脑缺血/再灌注损伤可能会导致神经损伤,导致动物行为学的改变,且神经元凋亡可能与caspase-3、Bcl-2及Bax的表达水平相关;Gao等[14]在白藜芦醇对抗短暂性糖氧剥夺损伤发挥神经元保护作用的研究中也证实了Bcl-2表达下调和Bax表达上调在神经元凋亡中的重要作用。Lei 等[15]研究显示,Bcl-2家族蛋白也可能参与到依赖JNK的凋亡信号通路中:Bcl-2表达增加后,JNK诱导的凋亡会受到抑制;而JNK基因敲除细胞在受到损伤时,Bcl-2则不表达。Zhai等[16]最近研究表明,抑制JNK磷酸化可上调Bax表达,进而减少细胞凋亡的发生。这些结果证实了Bcl-2及相关蛋白在细胞凋亡的JNK信号通路中扮演了相当重要的角色。因此,本研究建立原代皮层神经元的H/R凋亡模型,重点观察了在该模型中Sen对凋亡相关信号通路中JNK和c-Jun蛋白表达及其磷酸化,以及Bcl-2和Bax的蛋白表达的影响。
首先,我们采用免疫荧光法(神经元特异性蛋白MAP-2抗体)鉴定分离培养的大鼠原代皮层细胞,结果显示培养的细胞为皮层神经元,纯度达到80%以上(图1)。在后续造模实验中,为确保所收集的样本具有代表性,我们收集一部分细胞,通过Annexin-V/PI双染法并进行流式细胞术实验检测细胞凋亡率,以作为后续蛋白组学实验的质控指标。流式结果(表1)显示H/R组细胞凋亡率显著高于正常对照组和Sen组,而H/R+Sen组细胞凋亡则显著低于H/R组,提示模型构建成功,可用于蛋白提取并进行后续实验。接着,我们采用Western blotting法检测各凋亡相关蛋白的表达水平。实验结果(图3~5)显示:(1)H/R组的JNK和c-Jun的蛋白表达水平均显著低于control组;与H/R组比较,H/R+Sen组的JNK和c-Jun的蛋白表达水平显著升高;(2) H/R组的JNK和c-Jun磷酸化水平均高于control组;与H/R组比较,H/R+Sen组的JNK和c-Jun磷酸化水平均显著降低;(3) H/R组的Bcl-2水平显著低于control组,同时Bax水平显著高于control组;与H/R组比较,H/R+Sen组Bcl-2蛋白表达水平显著升高,Bax蛋白表达水平显著降低。这一结果初步证实Sen对抗H/R诱导神经细胞凋亡、发挥细胞保护作用的机制可能是通过上调JNK及c-Jun的表达并抑制其磷酸化,进而上调下游信号蛋白Bcl-2的表达和下调Bax的表达,最终抑制H/R诱导的原代神经元的凋亡。然而,Sen的药理作用及其深入的机制还有待进一步研究。
[参 考 文 献]
[1] Shinoda Nl, Moriguchi S, Shirasaki Y, et al. Generation of constitutively active calcineurin by calpain contributes to delayed neuronal death following mouse brain ischemia[J]. J Neurochem, 2006, 98(1):310-320.
[2] Chen H, Yoshioka H, Kim GS, et al. Oxiadative stress in ischemic brain damage: mechanisms of cell death and potential molecular targets for neuroprotection[J]. Antioxid Redox Signal, 2011, 14(8):1505-1517.
[3] Ma M, Uekawa K, Hasegawa Y, et al. Pretreatment with rosuvastatin protects against focal cerebral ischemia/reperfusion injury in rats through attenuation of oxidative stress and inflammation[J]. Brain Res, 2013, 1519:87-94.
[4] Eltzschig HK, Eckle T. Ischemia and reperfusion--from mechanism to translation[J]. Nat Med, 2011, 17(11):1391-1401.
[5] 刘大伟, 康利平, 马百平. 远志化学及药理作用研究进展[J]. 国际药学研究杂志, 2012, 39(1):32-36.
[6] 戚仁斌. 中药Q0409防治学习记忆障碍的作用及机制研究[D]. 广州:暨南大学,2007.
[7] Wines-Samuelson M, Schulte EC, Smith MJ, et al. Characterization of age-dependent and progressive cortical neuronal degeneration in presenilin conditional mutant mice[J]. PLoS One, 2010, 5(4):e10195.
[8] 纪惜銮. 远志皂苷元对缺氧/复氧诱导PC12细胞损伤的作用及机制[D]. 广州:暨南大学,2010.
[9] Liu AL, Wang XW, Liu AH, et al. JNK and p38 were involved in hypoxia and reoxygenation-induced apoptosis of cultured rat cerebellar granule neurons[J]. Exp Toxicol Pathol, 2009, 61(2):137-143.
[10] Koga S, Kojima S, Kishimoto T, et al. Over-expression of map kinase phosphatase-1 (MKP-1) suppresses neuronal death through regulating JNK signaling in hypoxia/re-oxygenation[J]. Brain Res, 2012, 1436:137-146.
[11] Zhao J, Pei DS, Zhang QG, et al. Down-regulation Cdc42 attenuates neuronal apoptosis through inhibiting MLK3/JNK3 cascade during ischemic reperfusion in rat hippocampus[J]. Cell Signal, 2007, 19(4):831-843.
[12] Relja B, Töttel E, Breig L, et al. Plant polyphenols attenuate hepatic injury after hemorrhage/resuscitation by inhibition of apoptosis, oxidative stress, and inflammation via NF-κB in rats[J]. Eur J Nutr, 2012, 51(3):311-321.
[13] Liu G, Wang T, Wang T, et al. Effects of apoptosis-related proteins caspase-3, Bax and Bcl-2 on cerebral ischemia rats[J]. Biomed Rep, 2013, 1(6):861-867.
[14] Gao D, Huang T, Jiang X, et al. Resveratrol protects primary cortical neuron cultures from transient oxygen-glucose deprivation by inhibiting MMP-9[J]. Mol Med Rep, 2014, 9(6):2197-2204.
[15] Lei K, Nimnual A, Zong WX, et al. The Bax subfamily of Bcl2-related proteins is essential for apoptotic signal transduction by c-Jun NH2-terminal kinase[J]. Mol Cell Biol, 2002, 22(13):4929-4942.
[16] Zhai CL, Zhang MQ, Zhang Y, et al. Glycyrrhizin protects rat heart against ischemia-reperfusion injury through blockade of HMGB1-dependent phospho-JNK/Bax pathway[J]. Acta Pharmacol Sin, 2012, 33(12):1477-1487.
