COPD患者early-EPCs β2-肾上腺素受体的表达及其对细胞迁移的影响*
2014-08-08刘笑然黄鑫炎林耿鹏谭卫平刘扬丽谢灿茂
刘笑然, 黄鑫炎, 林耿鹏, 谭卫平, 刘扬丽, 谢灿茂△
(1海南医学院附属医院急诊科, 海南 海口 570102; 2中山大学第一附属医院呼吸内科, 广东 广州 510080)
β-肾上腺素受体(β-adrenergic receptor, βAR)是一种7次穿膜的受体。βAR家族包括β1AR、β2AR和β3AR 3个亚型[1],其经典途经是通过G蛋白增加细胞内的cAMP水平,激活蛋白激酶A(protein kinase A, PKA),使下游各靶位点(如NF-κB)磷酸化,调控细胞各项生理活动。小鼠体内淋巴组织中的T细胞和B细胞均有β2AR表达,参与调节细胞的增殖、分化、迁移等功能。用6-羟多巴胺封闭DBA/2小鼠T细胞的β2AR,细胞增殖速度明显增加[2]。 也有学者发现βAR调节细胞迁移,肾上腺素可增加循环中淋巴细胞的数量,给予βAR阻滞剂后淋巴细胞的数量下降[3-4]。体内注入异丙肾上腺素或肾上腺素,能增加小鼠脾脏中淋巴细胞外流的数量[5]。将小鼠淋巴细胞用荧光标记,并用异丙肾上腺素预处理15 min后注入小鼠体内,标记的淋巴细胞较多地分布在脾脏或外周淋巴结中[6]。另有资料显示: CD34+干细胞能表达β2AR[7],其激动剂调节细胞迁移[8]。交感神经通过β2AR途径促进细胞迁移,β2AR激动剂加速细胞迁移,但慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者外周血中的早期内皮祖细胞(early endothelial progenitor cells, early-EPCs)是否表达β2AR及其对细胞迁移的影响如何,目前尚无报道。
材 料 和 方 法
1 病例的来源和选择
从来自25例已戒烟的COPD患者及16例年龄、性别无差异的志愿者外周血中分离CD34+细胞。所有实验均得到海南医学院伦理委员会的同意。
患者入组标准:(1)中、重度COPD(GOLD stages 2~4);(2)稳定期(研究前4周内肺功能无变化或无恶化);(3)休息时PO2>60 mmHg;(4)年龄<70岁;(5)近2周内无全身性应用激素治疗。 排除标准:(1)有原发性心血管病,如原发性高血压、脑血管疾病、心律失常等;(2)影响外周血液干细胞数量的疾病,如肿瘤性疾病、肾脏疾病、风湿性疾病;(3)糖尿病及其它代谢性疾病。对照组入选标准:(1)年龄<70岁;(2)肺功能正常;(3)没有临床症状;(4)无吸烟史。
2 实验细胞的制备和鉴定
2.1CD34+细胞的分离提纯 将20 mL静脉血按1∶1用Hanks液稀释,用1.077的Ficoll梯度分离液分离血中的单个核细胞;将5×107个细胞悬浮于100 μL 试剂中,按100 μL抗体1 mL细胞悬液的比例,加入EasySep®抗体混合物(例如,在2 mL细胞悬液中加入200 μL 抗体混合液),用移液器上下吹打充分混匀,室温孵育15 min。
用移液器上下吹打EasySep®纳米磁珠5 次以上,以确保磁珠均匀一致(不使用涡旋震荡器);按50 μL 磁珠1 mL 细胞悬液的比例,加入磁珠,充分吹打混匀,室温孵育10 min; 用EasySep®缓冲液将细胞悬液的体积调整至2.50 mL(<5×108cells),用移液器上下轻轻吹打2~3次,混匀细胞。将试管插入磁极中,静置5 min。将磁铁及试管一起拿起,以连续缓慢的动作倾倒磁极至倒置状态,倒出上清部分。保持磁极及试管倒置2~3 s,然后使试管口恢复向上的位置。从磁极中取出试管,加入2.50 mL(<5×108cells)EasySep®缓冲液。用移液器轻轻吹打细胞悬液2~3次,混匀细胞。将试管放回磁铁中,静置5 min。重复上述步骤,在磁极中的分选过程共4次,每次5 min。从磁极中取出试管,加入适量试剂重悬细胞,得到所需的CD34+细胞并用流式细胞术分析。
2.2检测内皮祖细胞(endothelial progenitor cells,EPCs) 将CD34+细胞种植在有内皮细胞基础培养基2(endothelial basal medium-2,EBM-2)的6孔板中,48 h后,去除不贴壁的细胞,将贴壁细胞用胰酶消化,加入2% BSA孵育30 min,之后加入mAb-CD34-FITC、mAb-CD133-PE及Ⅰ抗mouse anti-human VEGFR2,孵育40 min,再加入Ⅱ抗rabbit anti-mouse APC,20 min后用流式细胞术检测。获得80%表达的EPCs用于本实验研究。CD34+的细胞悬浮液用PBS液加入1% FCS,用2% BSA封闭。
2.3细胞的传代 EPCs为贴壁生长细胞。把经密度梯度离心、磁珠正分选的CD34+细胞均匀种植在3%明胶包被的6孔培养板中,至细胞单层铺满培养皿时,即需分殖至新的培养皿中,一般大概需要10 d左右。 吸掉旧培养基,用无菌1×PBS 1 mL轻轻洗涤细胞1次,加入0.25% 胰蛋白酶-EDTA消化液1 mL(1 mL/直径10 cm培养皿),37 ℃、5% CO2培养箱中作用1~2 min,轻拍培养皿使细胞脱落。于显微镜下观察,细胞呈现圆粒状。将洗脱下来的细胞转移至有4 mL EBM-2全培养液的15 mL离心管中,1 000 r/min离心5 min。弃除离心后的上清液,再次加入4 mL EBM-2全培养液,充分吹打混匀细胞和培养液。取新的6孔培养板,加入2~3 mL EBM-2全培养液,取细胞液约0.3 mL加入培养板,37 ℃、5% CO2培养箱培养。
2.4细胞标记 取原液(1 g/L)40 μL加入2 mL EBM-2全培养液中;取1×106EPCs加入放有上述培养基的6孔板中,放入5% CO2、37 ℃的培养箱中6 h。取出培养板,吸除培养基,用Hanks液轻轻冲洗3次,每次5 min。用 4%多聚甲醛固定细胞10 min。 固定后用Hanks液冲洗1次 ,将 FITC-UEA-I(10 mg/L)加入上述标本中在5% CO2、 37 ℃下孵育 1 h。荧光显微镜鉴定 FITC-UEA-I 和 DiI-acLDL 双染色阳性细胞为正在分化的 early-EPCs。整个过程避光进行。Early-EPCs主要表达CD34、CD133和VEGFR2,细胞形态呈大头钉状,一般是在培养的第4~7天出现。
3 β2AR在early-EPCs表达的检测
3.1RT-PCR法测定β2AR mRNA的表达 (1) 细胞总RNA的提取:细胞置于1.5 mL Eppendorf 管,加入Trizol 1 mL裂解细胞提取总RNA,经氯仿/异丙醇纯化和75%乙醇沉淀,真空干燥后加DEPC处理水溶解RNA,加入2.5倍体积乙醇,置-80 ℃保存。(2)逆转录反应:取4 μL RNA模板做逆转录反应,MMLV体系,总反应体积20 μL;反应条件:37 ℃ 1 h,然后95 ℃ 3 min。(3) 定性PCR扩增:用Primer Express 2.0 软件设计引物,β2AR上游引物5’-CGC TTC CAT GTC CAG AAC CT-3’,下游引物5’-TCT TGA GGG CTT TGT GCT CC-3’,扩增片段长度为 106 bp;内参照基因β-actin上游引物5’-GCA TGG GTC AGA AGG ATT CCT-3’,下游引物5’-TCG TCC CAG TTG GTG ACG AT-3’, 扩增片段长度为106 bp。PCR反应条件为:93 ℃ 5 min;然后93 ℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,共40个循环;72 ℃ 7 min。
3.2Western blotting法检测β2AR蛋白的表达 (1)提取细胞膜蛋白:收集对数生长期的细胞至15 mL离心管,加1 mL RIPA裂解液充分混匀,用超声波细胞破碎仪粉碎裂解细胞(10 s×3次),12 000×g、4 ℃离心30 min,取上清-80 ℃保存;BCA法测定蛋白质浓度,用细胞裂解液调整使各样本蛋白浓度一致;(2)SDS-PAGE :按配方灌制分离胶和浓缩胶,在调整好浓度的各样本蛋白中加入等体积2×SDS-PAGE上样缓冲液,100 ℃加热5 min,立即冰上冷却,4 ℃、15 000×g离心1 min,取上清液,用微量加样器按10 μg待测样品/孔上样, 60 mA 电泳30 min,90 mA 60 min;(3)免疫印迹操作:30 V、4 ℃过夜电转膜, 将PVDF膜室温下封闭1 h,分别将β2AR和β-actin 的PVDF膜装入透明塑料袋中,分别按照 1∶400和1∶2 000用2 mL封闭液稀释鼠抗人β2AR Ⅰ抗及兔抗人β-actin Ⅰ抗,摇床上缓慢摇动,4 ℃过夜; 将PVDF膜分别浸入1∶5 000封闭液稀释的抗鼠和抗兔HRP标记的Ⅱ抗中,置摇床上缓慢摇动,室温下孵育40 min; ECL试剂显影,暗室曝光约20 min,冲洗胶片,应用彩色图像摄录输入仪及全自动图像分析仪Multi-Gauge 3.0软件分析蛋白条带密度值,以β-actin作为内参照,计算蛋白相对表达水平。
3.3荧光染色和流式细胞术测定β2AR的表达 (1)Early-EPCs(1× 105)用2% BSA封闭30 min,加入鼠抗mAb-β2AR孵育40 min,再加入兔抗鼠IgE-PE,室温孵育40 min,同时加入DAPI(5 mg/L)20 min,用PBS清洗2次,放在倒置荧光显微镜下观察。(2)Early-EPCs(1× 105)用2% BSA封闭30 min后,加入鼠抗人mAb-β2AR Ⅰ抗,孵育40 min后,再加入山羊抗鼠IgE-APC Ⅱ抗孵育 30 min,用PBS清洗2次,每次5 min,流式细胞术检测。
4 Transwell实验检测early-EPCs的迁移能力
用含0.1% FCS的EBM-2培养基调整细胞数,以每孔3×104early-EPCs/200 μL加入Transwell上室中,下室加入0.1% FCS 的EBM-2培养基 500 μL 及100 μg/L 基质细胞衍生因子1α(stromal cell-derived factor 1α,SDF-1α)。细胞置于37 ℃、5% CO2培养箱,2 h 后收集下室的细胞并计数。
5 siRNA的转染步骤
用LipofectamineTM2000 (Lip02000)于24孔细胞培养板转染siRNA。转染前1 d,接种适当数量的细胞至细胞培养板中,每孔中加入无抗生素的培养基,使转染时的细胞密度能够达到30%~50%汇合度;对于每个转染样品,按如下步骤准备siRNA-Lipo2000混合液: 用 50 μL不含血清的培养基 Opti-MEM®Ⅰ(v2) 稀释 25 pmol siRNA(加入细胞中的 RNA终浓度为50 nmol/L),轻轻混匀,室温孵育5 min;用50 μL不含血清的培养基Opti-MEM® I (v2) 稀释1 μL Lipo2000,轻轻混匀并室温孵育 5 min; 将两者轻轻混匀,室温孵育 20 min。将siRNA-Lipo2000混合液加入含有细胞以及培养液 (v1) 的培养板各孔中,轻轻混匀,置于 37 ℃、5%CO2培养箱中培养 24~96 h。培养 4~6 h 后,将孔里含有siRNA-Lipo2000混合液的培养基移去,更换新鲜的生长培养基。
6 统计学处理
数据用均数±标准差(mean±SD)表示,应用SPSS 16.0统计软件处理,两组间均数比较采用配对t检验,多组间均数比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 细胞培养 early-EPCs的形态
显微镜下观察early-EPCs形似淋巴细胞,核大,胞浆少,呈集落样生长。EPCs为贴壁细胞,接种后24 h基本全部贴壁生长,大概10 d后细胞在培养皿中长成梭状致密单层,已基本上饱和,需要传代,见图1。

Figure 1. Culture and identification of early-EPCs. A: a colony of early-EPCs in COPD group after 48 h of culture (×20); B: early-EPCs were simultaneously labeled with DiI-acLDL (red) and UEA-1-FITC after 10 d of culture (×40).
2 β2AR mRNA及蛋白在early-EPCs的表达
COPD组和对照组early-EPCs,不加入逆转录酶者,未检到 β2AR 和 β-actin 条带,说明实验用的mRNA没有基因组DNA的污染。加入逆转录酶者的目的条带283 bp处均可见特异性β2AR mRNA表达,COPD组细胞 β2AR mRNA的表达强于对照组细胞,见图2A。COPD组和对照组的 early-EPCs 均可检出分子量约为56~85 kD的 β2AR 蛋白条带。经图像分析软件分析,以β-actin标准化后的COPD组early-EPCs 其β2AR蛋白表达强度高于对照组细胞(P<0.05),见图2B。用流式细胞术观察可见COPD组和对照组的 early-EPCs均有 β2AR表达,其阳性率分别为82.9%和55.7%,见图2C。

Figure 2. β2AR were expressed on the early-EPCs from the peripheral blood of COPD patients or control subjects. A: β2AR mRNA in early-EPCs from the COPD patients and the control subjects were detected by RT-PCR as gel electropherogram and quantification; B: the protein levels of β2AR in the early-EPCs from the COPD patients and the control subjects were determined by Western blotting; C: the expression of β2AR in the early-EPCs were analyzed by FACS in COPD group and control group. Mean±SD.n=6.*P<0.05 vs control.
3 β2AR在early-EPCs的分布
在荧光显微镜下对COPD组和对照组的 early-EPCs进行观察,可见两组细胞均表达 β2AR。COPD组 β2AR 的荧光强度明显高于对照组,呈现两极分布,见图3。
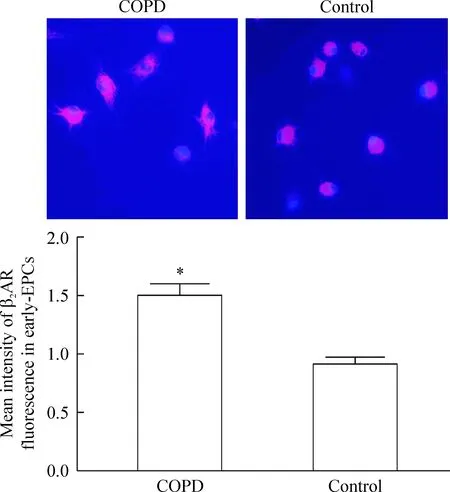
Figure 3. Distribution of β2AR in the early-EPCs of COPD patients or control subjects(×200). Mean±SD.n=6.*P<0.05 vs control.
4 ICI118551和去甲肾上腺素(norepinephrine,NE)对early-EPCs迁移功能的影响
为了减少多次实验对结果的影响,空白对照组采用同一实验得出的结果。
4.1不同浓度的ICI118551对early-EPCs迁移的影响 COPD组及对照组的early-EPCs分别与ICI118551(0、5、10、15 nmol/L)孵育24 h后,经过2 h迁移,下室细胞计数表明,COPD组迁移的细胞数明显少于对照各组(P<0.05)。当ICI118551 为10 nmol/L时,COPD组与对照组的迁移细胞数没有明显差异(P>0.05),见图4。
4.2不同浓度的NE对early-EPCs迁移的影响 COPD组及对照组的early-EPCs分别与不同浓度的NE(0、50、100、150 nmol/L)在37 ℃、5% CO2孵育24 h后,经过2 h迁移,可见随着NE的浓度升高,抑制细胞迁移的效应增强,见图5。

Figure 4. Number of migratory early-EPCs treated with ICI118551 at different concentrations (0,5,10 and 15 nmol/L) for 24 h.Mean±SD.n=6.*P<0.05 vs control; △P<0.05 vs COPD at baseline concentration (0 nmol/L).
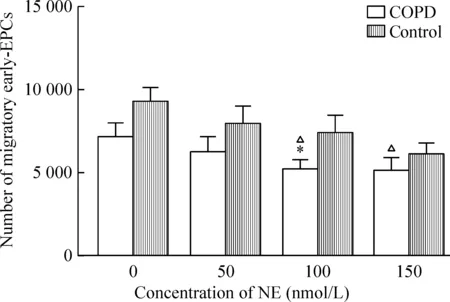
Figure 5. Number of migratory early-EPCs treated with NE at different concentrations (50, 100 and 150 nmol/L) for 24 h.Mean±SD.n=6.*P<0.05 vs control; △P<0.05 vs COPD at baseline concentration (0 nmol/L).
5 β2AR单克隆抗体(monoclonal antibody of β2AR,mAb-β2AR)对early-EPCs迁移的影响
5.1不同浓度的mAb-β2AR对early-EPCs迁移的影响 COPD组及对照组的early-EPCs分别与不同浓度的mAb-β2AR(0、1∶100、1∶150、1∶250和1∶300)在37 ℃、5% CO2孵育24 h后,经过2 h迁移,行下室细胞计数,可见用mAb-β2AR封闭细胞的β2AR有助于提高细胞的迁移能力,且mAb-β2AR的浓度是1∶250时,两组的迁移细胞数量无明显差别(P>0.05),见图6。
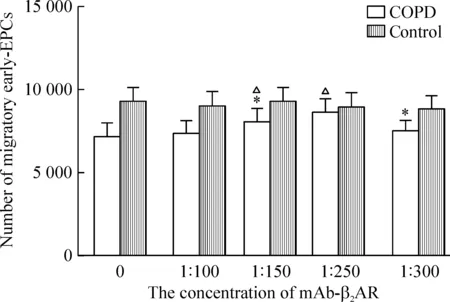
Figure 6. Number of migratory early-EPCs treated with mAb-β2AR at different concentrations (1∶100, 1∶150, 1∶250 and 1∶300) for 24 h.Mean±SD.n=6.*P<0.05 vs control; △P<0.05 vs COPD at baseline concentration (0).
5.2mAb-β2AR与ICI118551和NE共同作用下对early-EPCs迁移的影响 将COPD组及对照组的early-EPCs先与mAb-β2AR(1∶250)共同孵育40 min (37 ℃、5% CO2)后,再与ICI118551(10 nmol/L)或NE(100 nmol/L)共同孵育24 h,经2 h迁移,行下室细胞计数,可见COPD组不同处理组与对照组之间的细胞迁移数之间无明显差异(P>0.05),在COPD组之间的细胞迁移数也无明显差异(P>0.05),见图7。
6 RNA干扰下调β2AR在early-EPCs的表达对细胞迁移的影响
经72 h 转染siRNA(转染率70%),收集细胞,在Transwell上室培养2 h 后收集下室的细胞并计数,发现COPD组下调β2AR表达后,其early-EPCs的迁移能力得到改善,见图8。
讨 论
本实验中我们发现,COPD组的early-EPCs β2AR mRNA表达强于对照组。Western blotting结果示:以β-actin标准化后,COPD组细胞的β2AR蛋白表达强度明显高于对照组(P<0.05)。流式细胞术检测COPD组及对照组的early-EPCs 其β2AR的表达分别为82.9%和55.7%。COPD组的early-EPCs对SDF-1α迁移的细胞数量明显少于对照组(P<0.05)。应用不同浓度的β2AR阻滞剂ICI 118551 作用于COPD组的early-EPCs 24 h,COPD组的early-EPCs对SDF-1α(100 μg/L)迁移的数量均有所提高,其中当 ICI118551 浓度达10 nmol/L时,细胞迁
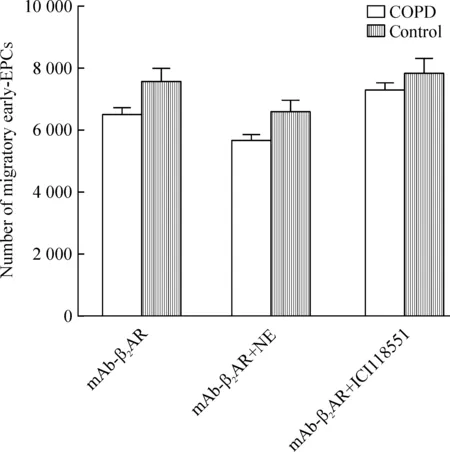
Figure 7. Effects of mAb-β2AR (1∶250) combined with NE (100 nmol/L) or ICI118551 (10 nmol/L) on the migration of early-EPCs.Mean±SD.n=6.

Figure 8. Effect of knockdown of β2AR expression by RNA interference on the migration of the early-EPCs to SDF-1α.Mean±SD.n=6.*P<0.05 vs control; △P<0.05 vs COPD.
移数量增加最明显(P<0.05)。将COPD组的early-EPCs与不同浓度NE共同孵育24 h 后,细胞的迁移数量均不同程度地减少,与NE浓度呈负相关。β2AR抗体可使COPD组的early-EPCs迁移细胞数增加。将COPD组的early-EPCs与mAb-β2AR (1∶250)孵育40 min 之后,再分别与β2AR激动剂(NE 100 nmol/L)、阻滞剂 ICI118551 (10 nmol/L)作用,各组间的迁移细胞数无明显差异。这表明β2AR被抗体封闭后,细胞迁移受到影响。通过下调β2AR的表达,能增加细胞的迁移能力。
β2AR是一种广泛分布在人体组织的肾上腺能受体,调节着机体多种生理功能。β2AR在交感神经作用下,调节细胞迁移和增殖[9]。有研究显示[7,10],β2AR激动剂加速细胞迁移,在一定程度上抑制细胞增殖,改变β2AR的表达将影响细胞的增殖和迁移功能[11-12]。骨髓内表达CD34+的干细胞归巢受交感神经调节[7-8]。幼稚CD34+干细胞表达β2AR,通过β2AR激活,使细胞膜金属基质蛋白酶活化,分泌金属蛋白酶,引起骨髓微环境中起抑制外流作用的基质膜破坏,促进CD34+干细胞外流。应用相应受体阻滞剂,细胞的外流过程受到抑制。β2AR可在交感神经作用下,促进T淋巴细胞迁移,β2AR激动剂可加速细胞迁移[7, 10]。本实验发现:在COPD组的外周EPCs上有β2AR表达,明显高于对照组,其迁移能力较低,与过高β2AR表达有关,应用β2AR抗体、阻滞剂后,EPCs的迁移功能有所改善,这与Goncharova等[13]报道的关于β2AR 激动剂能选择性抑制HASM细胞的迁移,长期应用β2AR激动剂对细胞迁移的抑制作用降低的结果相一致。当应用β2AR抗体封闭β2AR时,再给于β2AR激动剂或阻滞剂处理,细胞的迁移数量无明显差异,进一步说明β2AR表达对COPD组的early-EPCs的迁移起着非常重要作用,且与β2AR的密度改变有关。而COPD组急性发作期血浆中去甲肾上腺素水平增高[14],加之治疗期间患者间断应用β2AR激动剂,可能会通过改变β2AR的功能变化,进而影响early-EPCs的迁移功能。另外,COPD组血浆中的细胞因子及毒素(TNF-α、IL-1、LPS)能改变细胞上β2AR的表达,改变细胞的迁移能力[15-16]。
因此,我们推测COPD组的呼吸系统反复发生炎症反应,引起肺组织中细胞因子水平增高,当外周血中的EPCs进入肺组织,在肺内“停留”,部分细胞因子及外源性β2AR激动剂可能会改变EPCs上β2AR的表达数量与受体活性,造成COPD组的EPCs上β2AR mRNA及蛋白的表达水平明显高于对照组,干扰EPCs由肺组织向外周血中进一步迁移,造成外周血中细胞数量降低,同时通过β2AR数量或活性变化导致下游受体活性异常,激活相应信号通路,造成EPCs迁移功能异常,受损血管内皮处的EPCs数量下降,影响修复,导致血管内皮功能异常,加速动脉硬化,促进COPD患者心血管疾病发病率升高[17-18]。
本研究的意义在于,应用β2AR阻滞剂或抗体能够提高COPD患者外周血中early-EPCs迁移功能。通过基因干扰技术下调COPD组early-EPCs的β2AR表达,可改善细胞迁移能力,将为临床上预防COPD患者心血管疾病的发生提供理论依据。但β2AR是如何改变COPD患者血中EPCs迁移能力,仍需进一步研究。
[参 考 文 献]
[1] Bylund DB, Eikenberg DC, Hiebleet JP, et al. International Union of Pharmacology nomenclature of adrenoceptors[J]. Pharmacol Rev, 1994, 46(2):121-136.
[2] Kohm AP, Sanders VM. Norepinephrine and β2-adrenergic receptor stimulation regulate CD4+T and B lymphocyte functioninvitroandinvivo[J]. Pharmacol Rev, 2001, 53(4):487-525.
[3] Gader AM. The effects of beta adrenergic blockade on the responses of leucocyte counts to intravenous epinephrine in man[J]. Scand J Haematol, 1974, 13(1):11-16.
[4] Rogausch H, Del Rey A, Oertelet J, et al. Norepinephrine stimulates lymphoid cell mobilization from the perfused rat spleen via beta-adrenergic receptors[J]. Am J Physiol, 1999, 276(3 Pt 2):R724-R730.
[5] Ernström U, Sandberg G. Effects of adrenergic alpha- and beta-receptor stimulation on the release of lymphocytes and granulocytes from the spleen[J]. Scand J Haematol, 1973, 11(4):275-286.
[6] Carlson SL, Fox S, Abell KM. Catecholamine modulation of lymphocyte homing to lymphoid tissues[J]. Brain Behav Immun, 1997, 11(4):307-320.
[7] Spiegel A, Shivtiel S, Kalinkovichet A, et al. Catecholaminergic neurotransmitters regulate migration and repopulation of immature human CD34+cells through Wnt signaling[J]. Nat Immunol, 2007, 8(10):1123-1131.
[8] Katayama Y, Battista M, Kaoet WM, et al. Signals from the sympathetic nervous system regulate hematopoietic stem cell egress from bone marrow[J]. Cell, 2006, 124(2):407-421.
[9] Baerwald CG, Wahle M, Ulrichset T, et al. Reduced catecholamine response of lymphocytes from patients with rheumatoid arthritis[J]. Immunobiology, 1999, 200(1):77-91.
[10] Madden KS, Moynihan JA, Brenneret GJ, et al. Sympathetic nervous system modulation of the immune system. III. Alterations in T and B cell proliferation and differentiationinvitrofollowing chemical sympathectomy[J]. J Neuroimmunol, 1994, 49(1-2):77-87.
[11] Kizaki T, Izawa T, Sakuraiet T, et al. β2-Adrenergic receptor regulates Toll-like receptor-4-induced nuclear factor-κB activation through β-arrestin 2[J]. Immunology, 2008, 124(3):348-356.
[12] Guo M, Pascual RM, Wanget S, et al. Cytokines regulate β2-adrenergic receptor adrenergic receptor responsiveness in airway smooth muscle via multiple PKA- and EP2 receptor-dependent mechanisms[J]. Biochemistry, 2005, 44(42):13771-13782.
[13] Goncharova EA, Goncharov DA, Zhao H, et al. β2-adrenergic receptor agonists modulate human airway smooth muscle cell migration via vasodilator-stimulated phosphoprotein[J]. Am J Respir Cell Mol Biol, 2012, 46(1):48-54.
[14] Bratel T, Wennlund A, Carlstrom K. Impact of hypoxaemia on neuroendocrine function and catecholamine secretion in chronic obstructive pulmonary disease (COPD). Effects of long-term oxygen treatment[J]. Respir Med, 2000, 94(12):1221-1228.
[15] Xiang L, Del Ben KS, Rehmet KE, et al. Effects of acute stress-induced immunomodulation on Th1/Th2 cytokine and catecholamine receptor expression in human peripheral blood cells[J]. Neuropsychobiology, 2012, 65(1):12-19.
[16] Gebhardt T, Gerhard R, Bedouiet S, et al. β2-Adrenoceptor-mediated suppression of human intestinal mast cell functions is caused by disruption of filamentous actin dynamics[J]. Eur J Immunol, 2005, 35(4):1124-1132.
[17] Takahashi T, Suzuki S, Kuboet H, et al. Impaired endothelial progenitor cell mobilization and colony-forming capacity in chronic obstructive pulmonary disease[J]. Respirology, 2011, 16(4):680-687.
[18] 梁敏烈,谢良地,李宏亮,等. 脂肪间充质干细胞早期干预对野百合碱诱发的肺动脉高压大鼠肺小动脉功能的影响[J]. 中国病理生理杂志,2013, 29(10):1729-1735.
