氧化石墨烯和石墨烯对离子型染料不同吸附性能研究
2014-08-06唐和清张海燕
唐和清,张海燕
(中南民族大学 化学与材料科学学院,催化材料科学湖北省暨国家民委-教育部重点实验室,武汉430074)
近年来,染料废水污染引发的环境问题日益突出.多数染料带有复杂的芳环结构,且具有一定的毒性和生物积聚性,在自然条件下很难降解.吸附法效率高、速度快、适应性强和易操作,一直是最重要的水处理方法之一,广泛应用于各种废水处理中.
碳质材料作为吸附剂在处理染料废水方面具有广阔的应用前景.自1958年Hummers最早制备出氧化石墨烯和2004年Geim等采用胶带粘附的方法获得单层的石墨烯之后,这两种新型材料在性能和应用上得到了广泛地研究,尤其是石墨烯独特的二维结构和应用潜能.由于石墨烯由六元环构成的二维蜂窝状平面纳米材料,仅有一个原子厚度(0.334 nm),具有很大的比表面积,理论值高达2630 m2/g,在吸附法去除废水中的有机、无机污染物方面具有广泛的应用前景.如石墨烯纳米片可吸附丙烯腈、对甲苯磺酸、1-萘磺酸和甲基蓝[1].石墨烯对金属离子也具有较高的亲和力,主要由石墨烯表面重要的活性位点产生.砷吸附于磁铁矿/还原的GO复合物和石墨烯片层[2,3],聚吡咯/还原的GO复合物吸附Hb2+[4,5].故与其他碳基材料相比,石墨烯不仅易于改性,还可与带有苯环的化学物质产生p-p作用力[6]表现出吸附效果,优异的选择性吸附性能使石墨烯在处理含苯环的化学物质的废水时成为最具有前景的吸附剂.
本文以改进的Hummers法制备GO,以水合肼还原GO的方法制备了还原的石墨烯(RGO),以GO和RGO为吸附剂,选择阳离子染料罗丹明B(RhB)和阴离子染料甲基橙(MO)作为考察GO和RGO对阴阳离子吸附性能的探针分子,考察了吸附体系中pH影响和吸附平衡需要的时间,并进行等温吸附模型的拟合和吸附动力学的研究.
1 实验部分
1.1 试剂和仪器
美国石墨粉(SP1 graphite, Bay Carbon, Bay city, MI),硝酸钠,高锰酸,浓硫酸,双氧水,水合肼,罗丹明B,甲基橙(上海国药集团化学试剂有限公司).所有试剂均为分析纯,所用水均为二次蒸馏水.
电热恒温鼓风干燥箱(上海索谱仪器有限公司),电子天平(ESJ200-4A型,沈阳龙腾有限公司),pH计(ORION STAR A211型,Thermo Scientific),DF-101S集热式恒温加热磁力搅拌器(85-1A型,上海科兴仪器有限公司),循环水真空泵(SHZ-D(III)型,上海东玺制冷仪器设备有限公司),数显水浴恒温振荡器(SHZ-82A型,金坛市科兴仪器厂),高功率数控超声波清洗器(KQ-200KDE型,昆山市超声仪器有限公司),紫外-可见分光光度计(Thermo Scientific),离心机(Thermo Scientific).
1.2 吸附剂的制备
GO的制备:向250 mL干燥的圆底烧瓶中加入1 g美国石墨粉和46 mL浓硫酸,置于冰浴下恒温搅拌器中,边搅拌边加入0.5 g NaNO3,再缓慢加入6 g KMnO4,继续搅拌90 min.升温至35℃,恒温搅拌2 h.滴加92 mL蒸馏水,升温至98℃,继续搅拌15 min.冷却后加入20 mL H2O2,溶液产生气泡,颜色由深褐色变为亮黄色.离心洗涤数次至上清液为中性.超声分散1 h得均一的GO分散液,吸取20 mL烘干,刮下来称重得GO分散液的浓度.
RGO的制备:移取200 mL GO的分散液于圆底烧瓶中,按质量比1︰1加入水合肼,95℃油浴中反应2 h.溶液由黄褐色变为黑色.反应完成后冷却至室温,抽滤洗涤数次,直至滤液为中性.采用与GO同样的定量方法计算RGO分散液的浓度.
1.3 吸附量的测定
移取约5 mg GO或RGO的分散液于100 mL锥形瓶中,依据染料在吸附体系中的实际浓度加入不同体积的染料储备液和水,配制50 mL的混合液.采用0.1 mol/L HCl和NaOH调节溶液的pH.在25℃的水溶恒温振药器中以120 r/min振荡90 min,达到吸附平衡.移取吸附平衡后的混合液1 mL离心3 min,于665 nm处检测上清液的吸光度,计算吸附剂对不同染料的吸附量.
吸附剂对染料的吸附量按照公式(1)进行计算:
(1)
式(1)中:C0表示染料在溶液中的初始浓度(mg/L),Ce表示染料溶液平衡浓度(mg/L),qe表示染料平衡时的吸附量(mg/g),m表示吸附剂的质量(g),V表示溶液的体积(L).
2 结果与讨论
2.1 吸附剂的表征
2.2.1 TEM 图
GO和RGO的TEM结果见图1.由图1可见,GO具有一定层状结构,是不平整褶皱状的片状物.GO出现了部分薄层,主要是在氧化、清洗和干燥过程中,氧化后含氧官能团的增加使层片之间的范德华作用力减弱,导致层片剥离[7].还原时GO层剥落形成层数较少的石墨烯材料.GO和RGO的结构不规则,表面密布着大量的微孔,凹凸不平,有褶皱和缺陷及发达的空隙,说明GO和RGO具有较高的吸附能力[8].

a) GO ; b) RGO图1 GO和RGO的TEM图Fig.1 TEM images of GO and RGO
2.1.2 FT-IR和Raman谱图分析
GO和RGO的红外谱图和Raman谱图见图2.由图2(a)可知,GO表现出各类含氧官能团的红外峰[9]:3400 cm-1波数处强而宽的吸收峰归属于-OH的伸缩振动和吸附的水分子峰,1726 cm-1为C=O的伸缩振动峰,1605 cm-1,1400 cm-1,1221cm-1和1054 cm-1分别对应C=C骨架振动,C-OH的面内变形振动,酚-OH的伸缩振动和环氧C-O-C的伸缩振动,而RGO的红外谱图中各类含氧官能团的峰明显消失.故GO呈现亲水性,而RGO却是疏水性.图2中(b)为GO和RGO的Raman谱图.1350 cm-1处为D峰,由样品边缘的缺陷引起,1580 cm-1处是G峰,对应光学二重简并模式[10].RGO与GO相比,ID/IG的比值增大,是由于GO被逐步还原为RGO时,样品被破坏为较多碎片而导致边缘缺陷增多引起.
天亮后,先后有两个人扒着木排求救。男人没有再阻拦,任表姐把他们一个一个拉上木排。第二个上岸的人见表姐没穿衣服,身子抖得厉害,就脱下自己的衣服,拧干,让表姐穿上。那是件中山装,厚厚的卡其布料,外挂四个兜。应该是干部装,不知道是水里捞的还是那男人自己的。杨小水穿在身上又胖又长,连下身也罩得严严实实的。
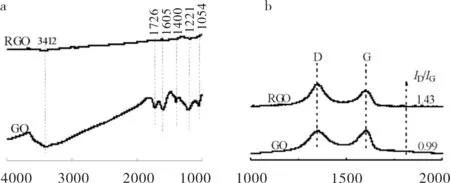
σ/cm-1 σ/cm-1a) FT-IR;b) Raman图2 GO和RGO的FT-IR和Raman谱图Fig.2 FT-IR and Raman spectra of GO and RGO
2.1.3 X射线光电子能谱分析
为确定样品中各元素的含量,对GO和RGO进行了XPS分析(见图3,图4),并将碳进行分峰处理结果见图3.由图3可知,RGO中各含氧官能团(如C-OH,C-O-C,C=O,O-C=O)含量比GO显著降低.各元素含量列于表1,由此可知,RGO中O元素的含量(32.97%)比GO中(13.8%)明显减少.故结合红外谱图、拉曼谱图和XPS各种表征手段均证明GO被水合肼还原为RGO后含氧官能团明显减少,
RGO平面性增加,疏水性增强.
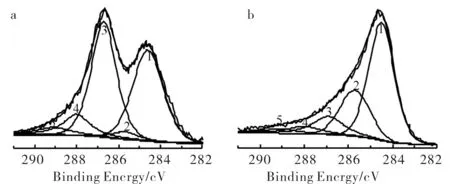
a) GO; b) RGO1) C-C,C=C;2) C-OH;3) C-O-C;4) C=O;5) O-C=O图3 GO和RGO的C1s XPS图谱分析Fig.3 C1s XPS spectra analysis of GO and RGO
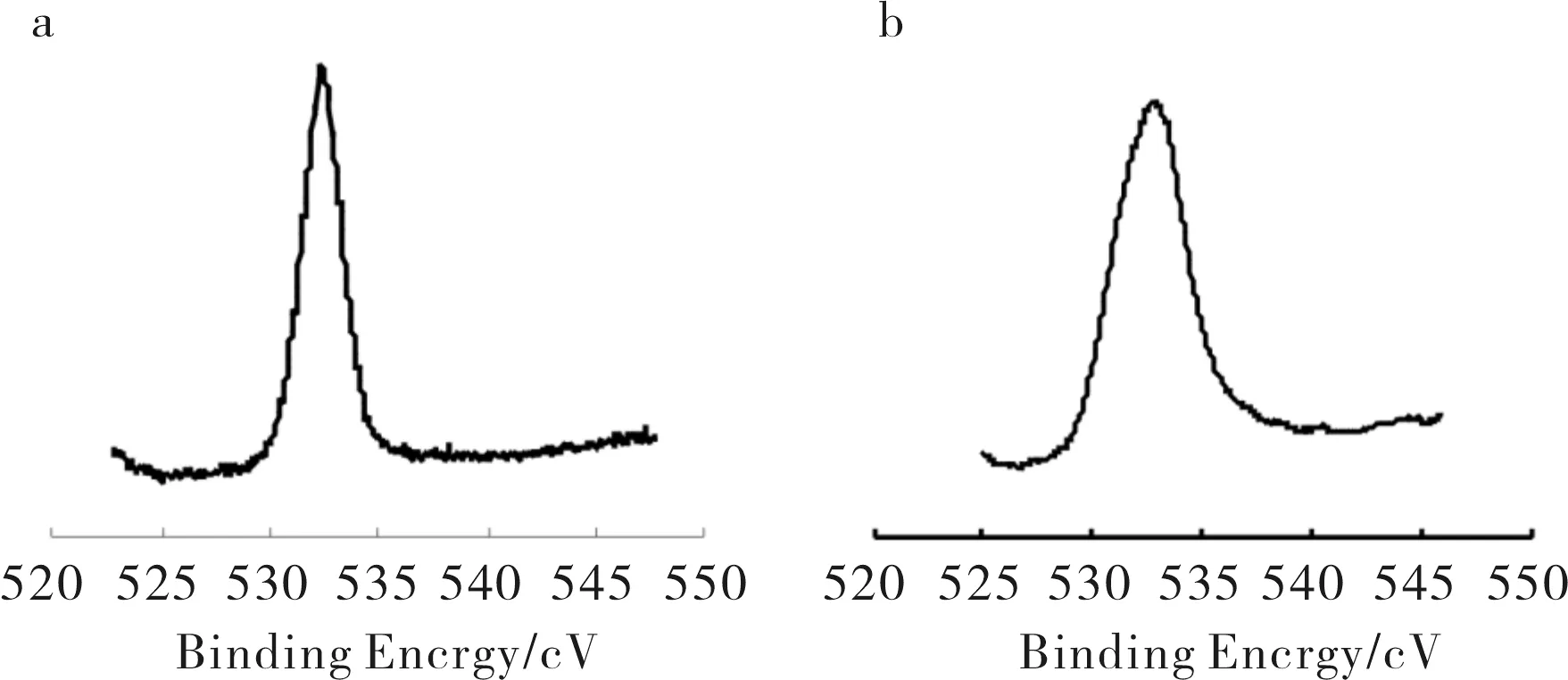
a) GO; b) RGO图4 GO和RGO的O1s XPS图谱Fig.4 O1s XPS spectra of GO and RGO

不同物质w(C)/%w(O)/%w(N)/%ξ(O︰C)GO66.3732.970.840.49RGO83.5013.802.700.17
2.2 pH对吸附性能的影响
pH是影响GO和RGO吸附离子型染料的重要因素.需要根据染料的变色范围,选择合适的pH范围,保证最大吸收波长处于同一值.pH对GO和RGO吸附RhB和MO的影响见图5.图中pH=6时两者对RhB的吸附能力相比其他pH值时较好,pH=5时两者对MO的吸附能力相比其他pH值时较好.主要因为pH影响吸附剂表面Zeta电势的大小(图6),进而影响吸附剂与吸附质之间的作用力.在pH为5或者6时,吸附剂表面都是负电荷,RhB为阳离子染料,吸附剂对RhB的吸附主要表现为静电作用[11];而MO为阴离子染料,吸附剂与MO是电荷排斥的,故两者对MO的吸附量相对RhB均较小.但RGO存在p电子体系,可与MO分子内的N=N和芳香环间产生p-p分散作用力而表现出吸附能力[12],而GO对MO的吸附仅依靠范德华作用力,故RGO对MO的吸附大于GO对MO的吸附.
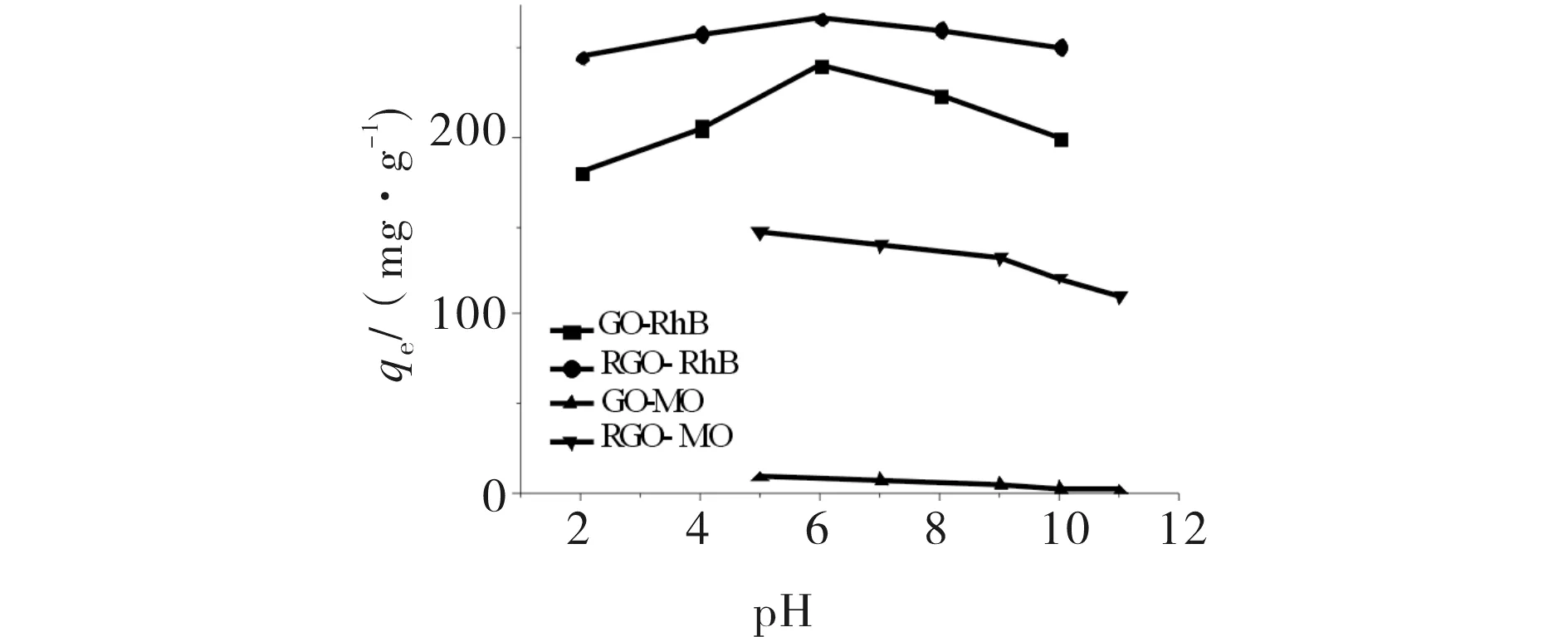
图5 pH在吸附体系中的影响Fig.5 The effects of pH at the adsorption system
2.3 吸附时间的确定
在各吸附剂吸附性能表现最好的pH值下,分别在不同振荡时间取样检测剩余染料的吸光度,计算各个时间点处的吸附量,结果如图7.由图7可见,GO和RGO对染料的吸附在初始阶段较快,而后吸附量逐渐趋于平台,在约60 min时可达到吸附平衡.

图6 pH对GO和RGO表面Zeta 电势的影响Fig.6 The effects of pH on the Zeta potentials of GO and RGO
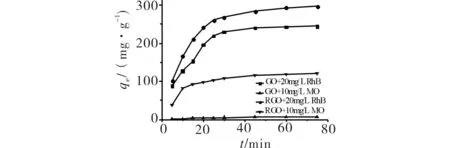
图7 时间对吸附RhB和MO的影响Fig.7 The effect of time on the adsorption of RhB and MO
2.4 吸附等温模型的研究
Langmuir等温吸附模型假定吸附剂表面的能量均一且不存在能量转移.Langmuir等温吸附模型的直线形式表现为:
(2)
上式中qe(mg·g-1)指平衡时的吸附容量,Ce(mg·L-1)为吸附平衡后吸附质的浓度,qm和b分别指吸附剂的最大吸附容量和Langmuir常数值.各吸附剂对两种染料的Langmuir等温吸附模型的直线形式见图6.
另一种吸附模型为Freundlich模型.Freundlich模型的对数公式为:
(3)
其中Kf和n是Freundlich模型中吸附容量和吸附强度的常数.吸附等温线的相关拟合参数见表2.由图8及表2可知,两者对两染料的吸附行为都较好的符合Langmuir等温吸附模型,且由其线性处理可知RGO和GO对RhB的最大吸附容量分别为551.2mg·g-1和476.2 mg·g-1,对MO的最大吸附容量分别为270.3 mg·g-1和15.0 mg·g-1.
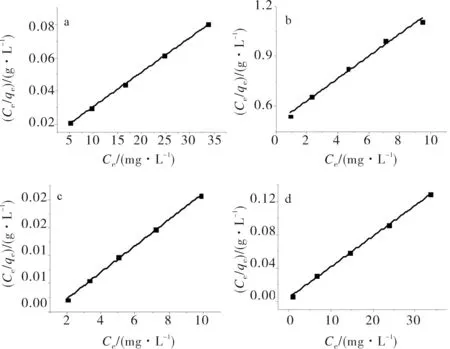
a) GO+RhB;b) GO+MO;c) RGO+ RhB;d) RGO+MO图8 GO和RGO对两种染料的Langmuir等温吸附模型线性拟合Fig.8 The linear form of Langmuir isotherm for dyes adsorption
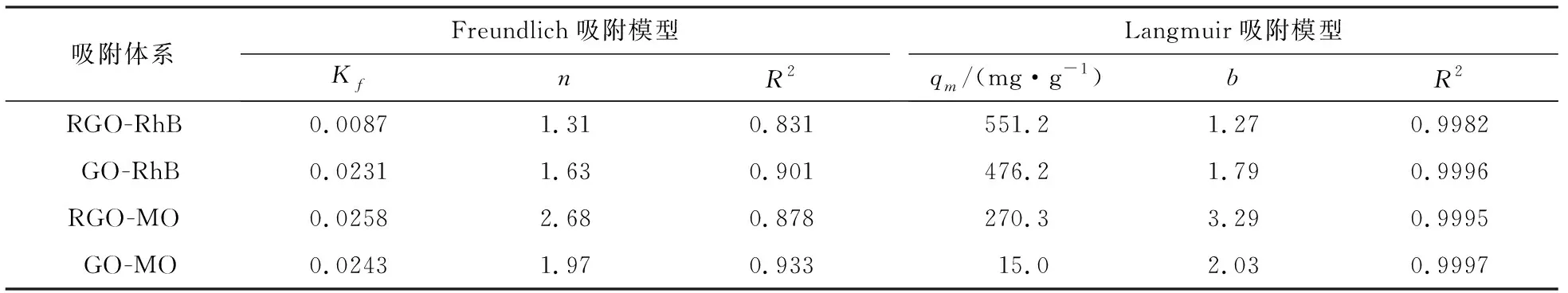
吸附体系 Freundlich吸附模型KfnR2Langmuir吸附模型qm/(mg·g-1)bR2RGO-RhB0.00871.310.831551.2 1.270.9982GO-RhB0.02311.630.901476.2 1.790.9996RGO-MO0.02582.680.878270.3 3.290.9995GO-MO0.02431.970.93315.0 2.030.9997
2.5 吸附动力学的拟合研究
为了探究吸附过程的内部特点,将准一级和二级动力学应用于吸附过程的描述,根据线性相关系数R2的值来判断两种动力学模型的适宜性.
一级反应速率方程反应的是颗粒内传质阻力是吸附的限制因素,可用下式表示:
(4)
二级反应速率方程反应的是吸附的限制因素是吸附机制,而不是传质.其表达式见下式:
(5)
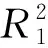
2.6 吸附剂与染料间可能的相互作用分析
四个吸附体系中各自的最大吸附容量分别是:RGO-RhB为551.2 mg/g,GO-RhB为476.2 mg/g,RGO-MO为270.3 mg/g,GO-MO为15.0 mg/g.存在差异的原因是在pH为5或者6时,吸附剂表面呈负电性,RhB为阳离子染料,吸附剂对RhB的吸附主要表现为静电作用;同时RGO独特的p电子体系与RhB的芳香环也产生p-p分散作用力,故RGO对RhB的吸附能力稍大于GO.MO为阴离子染料,吸附剂与MO是电荷排斥的,故两吸附剂对MO的吸附容量相对RhB均较小.GO对MO的吸附仅依靠范德华作用力,而RGO对MO的吸附作用力除了来源于范德华力外,还来源于RGO与MO分子内的N=N和芳香环间产生p-p分散作用力,故RGO对MO的吸附能力稍大于GO.
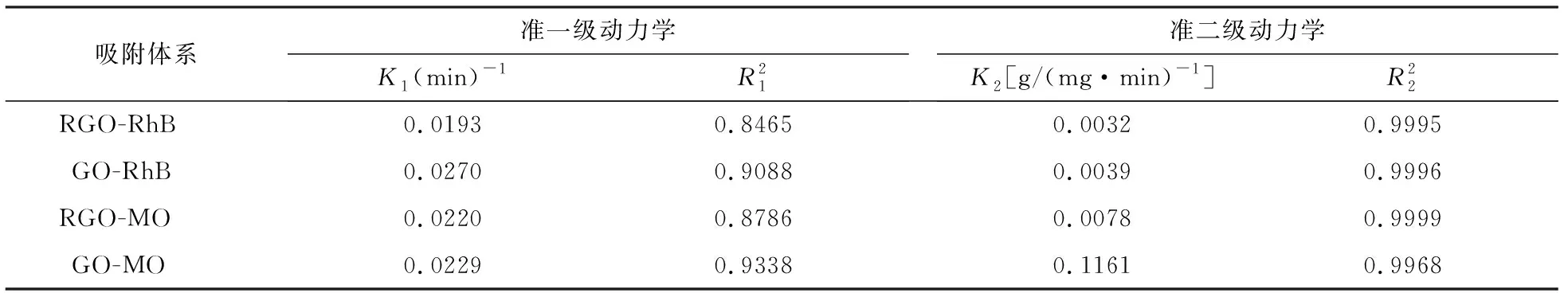
表3 动力学模型拟合参数Tab.3 Adsorption kinetic parameters for the adsorption of dyes on adsorbents
3 结语
GO和RGO在吸附去除废水中的阴阳离子染料方面是较佳的吸附剂材料.在pH为5或者6时,RGO和GO对阳离子染料均表现出较强的吸附能力且吸附过程迅速,这种作用力主要来源于静电作用;而吸附阴离子染料时首选RGO为吸附剂,RGO与阴离子间的吸附作用力主要来自于p-p分散作用力.两吸附剂对RhB和MO的吸附行为都符合Langmuir等温吸附模型和二级动力学行为.
参 考 文 献
[1] Wu T,Cai X,Tan S,et al.Adsorption characteristics of acrylonitrile, p-toluenesulfonic acid, 1-naphthalenesul-fonic acid and methyl blue on graphene in aqueous solutions[J]. Chem Eng J, 2011, 173(1): 144-149.
[2] Chandra V,Park J,Chun Y.Water-dispersible magnetite-reduced grapheme-oxide composites for arsenic removal[J]. ACS Nano, 2010, 4(7): 3979-3986.
[3] Mishra A K,Ramaprabhu S.Functionalized graphene sheets for arsenic removal and desalination of sea water[J]. Desalination, 2011, 282: 39-45.
[4] Chandra C,Kim K S.Highly selective adsorption of Hg2+by a polypyrrole-reduced graphene oxide composite[J]. Chem Commun, 2011, 47(13): 3942-3944.
[5] Ren Y M, Yan N, Wen Q. Graphene/MnO2composite as adsorbent for the removal of nickel ions from wastewater[J]. Chem Eng J, 2011, 175(15): 1-7.
[6] Cai X, Tan S, Lin M, et al. Synergistic antibacterial brilliant blue/reduced grapheme oxide/quaternary phosphonium salt composite with excellent water solubility and specific targeting capability[J]. Langmuir, 2011, 27(12): 7828-7835.
[7] Tournus F,Charlier J C.Ab initio study of benzene adsorp-tion on carbon nanotubes[J]. Phys Rev B, 2005, 71(16): 165421-165426.
[8] Zhang Wei, Wang Kunlin, Zhu Hongwei. Adsorption of methylene blue from aqueous solution by graphene[J]. Colloids and Surfaces B: Biointerfaces, 2012, 90:197-203.
[9] Stankovich S, Piner R D, Nguyen S, et al. Synthesis and exfoliation of isocyanate-treated graphene oxide nanoplatelets[J]. Carbon, 2004, 44: 3342-3347.
[10] Ferrari A C, Meyer J C. Raman Spectrum of Graphene and Graphene Layers[J]. PRL, 2006, 97:187401.
[11] Liu Y, Zheng Y, Wang A, et al. Enhanced adsorption of Methylene Blue from aqueous solution by chitosan-g-poly (acrylic acid)/vermiculite hydrogel composites[J]. J Environ Sci, 2010, 22(4): 486-493.
[12] Pereira M F R,Soares S F, Orfao J J M, et al. Adsorp-tion of dyes on activated carbons: influence of surface chemical groups[J]. Carbon, 2003, 41(4): 811-821.
