铜胁迫下菌株CL01促进紫云英生长的研究
2014-08-06程国军曾小波周艳琳田梦洋
程国军, 曾小波, 周艳琳, 田梦洋
(中南民族大学,生命科学学院,武汉 430074)
近年来,由于人口的快速增长和工业化进程的加速,环境污染加剧,土壤遭到破坏,尤其是土壤重金属污染.土壤重金属污染的污染物在土壤中很难移动,滞留时间较长,难以被其他微生物降解,并可通过水、植物媒介的传递而影响人类生命健康[1].
为缓解土壤重金属污染问题,国内外专家曾采用非毒性改良剂法、深耕法、排土法、客土法及化学冲洗等方法,但受方法的局限性,均未能得到理想的治理效果.近年来,生物学方法因成本低、能耗小、无二次污染、处理效果好,具有广泛的应用前景[2].
本文从湖北大冶市某矿区某植物根际土样中筛选到1株重金属抗性菌CL01,并根据其形态和16S rRNA基因序列,对其进行了鉴定.在模拟铜污染土壤中种植紫云英,发现其具有较好的促进紫云英抵抗铜胁迫的作用,通过测定紫云英的生物量、植株不同部位的含铜量和土壤中不同状态铜含量,进一步揭示了该细菌促进植物抵抗铜胁迫的机理,为重金属污染土壤的微生物修复提供了重要的理论基础.
1 材料与方法
1.1 材料
752型紫外可见光光度计(上海光谱仪器有限公司),AA1700原子吸收分光光度计(浙江福立分析仪器有限公司),DNA凝胶回收试剂盒(博大泰克),2×Power Taq PCR MasterMix(北京百泰科生物技术有限公司),pMD18-T Vector (宝生物工程大连有限公司),测定分析所用试剂均为分析纯,由国药集团化学试剂有限公司生产.
氯化铜(CuCl2·H2O)配成所需浓度,一次性拌入供试土壤.供试土壤取自中南民族大学生物实验园,经自然风干后碾碎过2 mm筛,与洗净风干的砂等质量混合.混合土壤含有机质13.6 g/kg,速效氮58 mg/kg,速效磷19.7 mg/kg,速效钾205 mg/kg,pH 6.65,有效铜0.43 mg/kg,全铜4.22 mg/kg.将供试土壤121 ℃灭菌1 h,连续灭菌2次,备用.
紫云英(Astragalussinicus),本实验室保存.细菌在LB培养基中过夜培养后离心收集菌体,用无菌水洗涤3次后制成菌悬液,悬液菌浓度约为1×109cfu/ml,4 ℃保存备用.
1.2 重金属抗性细菌的筛选和抗性水平
取湖北大冶市某矿区植物根圈的土样1 g加入含有99 mL无菌蒸馏水并带有玻璃珠的三角瓶中,放置于37 ℃摇床(200 r/min)振荡30 min.静置后取样涂布含铜和铬的Luria-Bertani平板中,置于37℃生化培养箱中培养48 h,待其长出菌后,挑取菌落进行纯化培养,LB斜面4℃保存.
分别倒置含不同浓度梯度的重金属LB平板,接种后于37℃生化培养箱中培养48 h后,观察菌体生长情况,检测细菌对不同重金属的抗性水平.本实验所用的重金属盐分别为:K2CrO4, ZnSO4·7H2O, CdCl2·2.5H2O, CuSO4·5H2O,NiSO4, MnCl2·4H2O和Pb(C2H3O2)·3H2O[3].
1.3 16S rDNA的PCR扩增和序列测定
取对数期的菌液,离心后收集菌体,抽提细菌基因组的总DNA.以基因组DNA为模板扩增16S rDNA.扩增引物选用细菌的通用PCR引物,正向引物(5′AAGGAGGTGATCCAGCC 3′),反向引物(5′AGAGTTTGATCCTGGCTCAG 3′).PCR程序为:94 ℃预变性3 min,94 ℃变性30 s,56 ℃退火1 min,72 ℃延伸2 min.循环30次,72 ℃延伸10 min[4].16S rDNA PCR扩增产物先用琼脂糖凝胶回收,再克隆到pMD18-T载体,经过抽提质粒、酶切和PCR验证后,由北京三博远志公司测序.
1.4 16S rDNA的系统发育分析
通过Blast程序,将测定的序列与GeneBank数据库中己有的16S rDNA序列同源性比较分析,采用Bioedit和MAGE 4.0软件以邻位相连(Neighbor-Joining)法构建进化树.选取同源性高的菌株中各个不同属的一些代表菌株用于系统发育树的构建[5].
1.5 盆栽实验设计
将泥土装入塑料盆中,选颗粒饱满大小均匀的紫云英种子,用95%乙醇预处理5min,再用2%次氯酸钠灭菌30 min,无菌水洗涤8~10次.种子在无菌水中充分吸涨后,均匀铺于琼脂平板,22 ℃倒置催芽2 d,催芽后的种子载入盆中.
实验设4个处理:无菌无铜、有菌无铜、无菌有铜和有菌有铜,每个处理5个重复.有铜组按75 mg/kg土壤一次性加入CuCl2溶液(铜溶液提前20 d加入,塑料盆下放一个托盘,将盆底流出的液体重新倒入花盆,以防铜流失).有菌组则在栽种3 d后于根系按每棵植株1mL加入菌悬液.培养过程在智能人工气候培养箱中进行,设置白昼:20 ℃,18 h,湿度为70 %,光照强度3级;16 ℃,6 h, 湿度为70 %,光照强度0级.2 d浇1次营养液.培养35 d后,分根和地上2部分收集植株,并收集根际土壤.
1.6 植物生物量和铜含量的测定
分别测量紫云英根和地上部分长度,称量鲜重.将各部分经150 ℃烘干2 h,75 ℃下24 h,称量干重.对紫云英根和地上部分进行消解,获得上清液用分光光度计测定铜含量[6].提取根际土壤中可交换态和碳酸盐结合态的铜,并用分光光度计测定铜含量[7].
1.7 统计方法
实验数据均采用SPSS统计软件分析相关数据的差异显著性.
2 结果与讨论
2.1 抗重金属微生物的筛选和分离
从分离培养基平板中挑取单菌落,经过筛选获得一株能在含CuCl2和K2CrO4均为1 mM的培养基上生长良好的菌株CL01.在营养琼脂平板上培养2 d后可见其菌落边缘整齐,表面湿润,半透明,呈浅黄色.CL01菌株革兰氏染色呈阴性,菌体杆状,无芽孢.
2.2 Y3菌株对多种重金属离子的抗性
本实验测定了CuSO4·5H2O,K2CrO4,CdCl2·2.5H2O,ZnSO4·7H2O,NiSO4,MnCl2·4H2O和Pb(C2H3O2)·3H2O等7种重金属对CL01菌株的最低抑菌浓度(见表1).结果表明:菌株CL01对不同重金属离子的抗性各不相同,对镉的抗性较弱,仅在含Cd2+浓度1 mmol/L的培养基上生长,而对Mn2+和Pb2+的抗性很强,其抗性浓度均达到了5 mmol/L.另外,菌株对Cr6+、Zn2+、Cu2+、Ni2+等重金属离子的抗性浓度也均达到了2 mmol/L.对7种重金属的抗性试验分析表明,菌株CL01具有普遍较高的重金属抗性能力.

表1 菌株CL01对多种重金属离子的抗性
2.3 16S rRNA基因的克隆与序列分析
以菌株CL01的DNA为模板进行PCR,获得一条约1.5 kb的特异性片度,经回收、转化后,挑选阳性克隆进行测序.利用Blast程序,将测序所得的16S rDNA部分序列和GenBank已登录的16S rDNA序列进行核苷酸序列同源性比较,结果表明:菌株与Bordetella、Alcaligenes、Achromobacter等属中多个种的16S rDNA序列具有高度同源性,与AchromobacterdenitrificansBMB-N6、AchromobacterxylosoxidansCONC18、B.bronchisepticaBb4、B.hinziiAU12584、Alcaligenesdenitrificans等菌的同源性均超过了99%.
2.4 16S rDNA的系统发育分析
将CL01菌株的16S rDNA部分序列提交GenBank进行Blast,下载同源性最高的12株不同属的细菌16S rDNA,采用BioEdit软件进行序列比对后采用MEGA4.1软件进行系统发育分析(见图1).由图1可见,CL01菌株与Achromobacter菌属的Achromobacterxylosoxidans细菌亲缘关系最近,而与Alcaligenes和Achromobacter属在进化上的距离相对较远.依据前面形态学和染色观察结果,可判定所分离的重金属抗性菌株可能为Achromobacterxylosoxidans.在系统发育地位上则属于Bacteria, Proteobacteria, Betaproteobacteria, Burkholderiales, Alcaligenaceae,Achromobacterxylosoxidans.
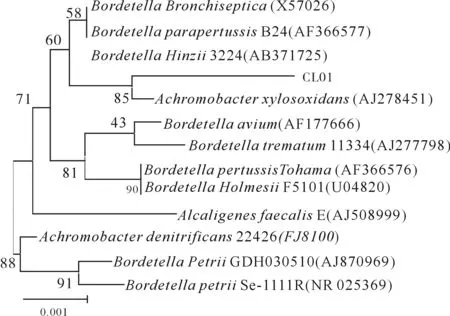
图1 CL01菌株的16S rDNA序列的系统发育树Fig.1 Phylogenetical tree derived from the 16S rDNA sequence of strain CL01
2.5 铜胁迫下紫云英生长的测定
铜是植物生长必需的微量元素,但过量的铜会给植物的生长带来毒害[8].在无菌有铜环境下生长的紫云英与对照组(无菌无铜组和有菌无铜组)相比,表现出明显的外部形态上的诸如叶片出现斑纹、植株失绿和根系萎缩等明显的重金属中毒症状.可见该浓度下的Cu对紫云英的生长有抑制作用,这和此前有关铜离子对紫云英作用的报道相一致[9].而有菌有铜处理下植株的生长水平显著提高,其植株地上部分高度为39.33 mm,根长为57.67 mm,植株鲜重为0.2278 g,达到了无菌无铜处理下植株的生长水平,二者均显著高于无菌有铜处理下植株地上部分高度13.83 mm,根长12.33 mm,植株鲜重0.0386 g(见图2),说明CL01能促进紫云英抵抗Cu的胁迫作用,提高了紫云英的生长能力.
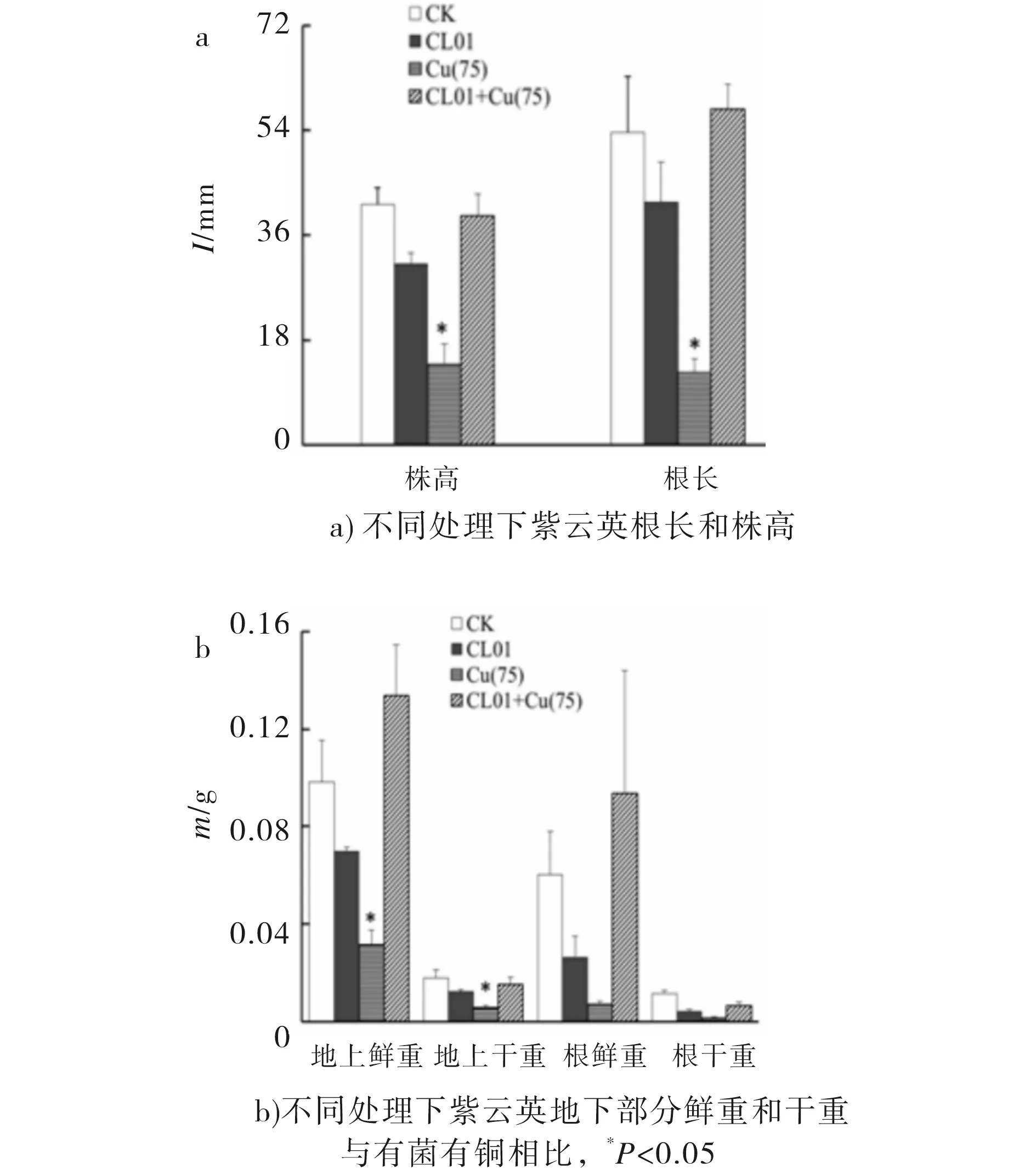
图2 不同处理下对紫云英的生物量的差异Fig.2 The difference of biomass of Astragalus sinicus under various processing
2.6 铜含量的测定
与无铜对照组相比,加铜条件生长的紫云英根部铜吸取量显著增加,表明铜胁迫会促使加大植株对铜的摄入量(见表2).然而,有菌有铜处理植株根部的铜摄取量为0.6 mg/kg , 远低于无菌有铜对照处理摄取量1.74 mg/kg,表明CL01的存在显著缓解了植株对铜离子的吸收.相比之下,紫云英地上部分所含铜浓度的变化不明显.说明重金属被紫云英吸收以后,大部分停留在根部,少量向地上部分迁移.此结果与已有研究报道一致[10].
紫云英根际土壤不同形态铜,结果表明:尽管CL01菌株对有铜处理根际土壤水溶态铜含量影响较小,有菌有铜处理根际土壤可交换态含量为2.62 mg/kg,显著低于无菌有铜处理可交换态含量4.11 mg/kg(见表2);而有菌有铜处理根际土壤铁锰氧化物结合态含量为17.96 mg/kg,高于无菌有铜处理可交换态含量11.51 mg/kg.根据植物根对土壤中重金属吸收的难易程度,可将土壤中重金属大致分为可吸收态、交换态和难吸收态3种状态.研究表明,土壤溶液中的金属如游离离子易为植物根所吸收,结合态等难以被植物所吸收,而交换态介于两者之间,主要包括被粘土和腐殖质吸附的重金属[11].铁锰氧化物结合态重金属是以矿物的外囊物和细粉散颗粒存在,活性的铁锰氧化物比表面积大,吸附或共沉淀阴离子而成[12].本研究表明:土壤中较高浓度的铜会对植物的生长产生毒害作用,而CL01菌株通过形成较高含量的铁锰氧化物结合态铜,有效降低了土壤中水溶态和可交换态铜含量,减少了植物对铜的吸取量,并降低了铜对植物的毒害作用.
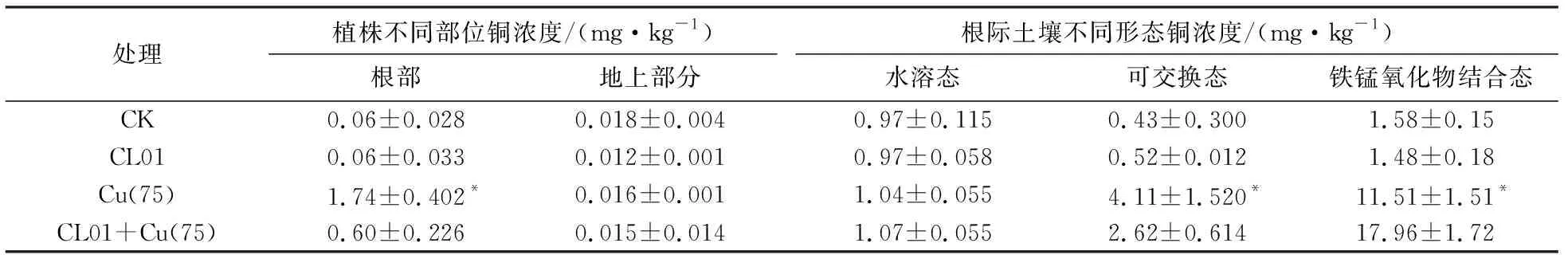
表2 不同处理对紫云英植株含铜量和根际土壤铜浓度的影响
根部、可交换态、铁锰氧化物结合态同列,与有菌有铜相比:*p< 0.05
3 结论
(1)本实验筛选到的菌株CL01具有抗多种重金属能力,经16S rDNA序列比对,判断该菌属于Achromobacter.
(2)在模拟铜污染土壤中种植紫云英,发现其具有较好的促进紫云英抵抗铜胁迫的作用.在含铜环境下,加菌处理植株地上部分高度、根长、植株鲜重,达到了无菌无铜处理下植株的生长水平,二者均显著高于无菌有铜处理下植株.表明CL01能促进紫云英抵抗Cu的胁迫作用,提高紫云英的生长能力.
(3)测定了根际土壤中水溶态、可交换态、铁锰氧化物结合态的铜浓度,结果表明CL01菌株通过形成较高含量的铁锰氧化物结合态铜,有效降低了土壤中水溶态和可交换态铜含量,减少了植物对铜的吸取量,降低了铜对植物的毒害作用.
参 考 文 献
[1] 罗战祥, 揭春生, 毛旭东.重金属污染土壤修复技术应用[J].江西化工,2010(2):100-103.
[2] 邱廷省, 江乐勇, 唐海峰.矿山含铜重金属废水微生物处理试验研究[J].矿冶工程,2005,25(3):50-57.
[3] 潘园园, 陈雯莉, 黄巧云.一株抗重金属铜镉细菌的分离、鉴定及其16S rDNA的序列分析[J].微生物学通报,2005,32(3):68-72.
[4] 国家标准化管理委员会.GB/T5749-2006生活饮用水标准检验方法[S].北京:中国标准出版社,1987:2.
[5] Kumar S,Tamura K,Nei M. Integrated software for molecular evolut-ionary genetics analysis and sequence alignment[J]. Brief Bioinform, 2004, 5(2):150-163.
[6] Huang Y, Xiong Z T, Dai L P, et al. Effect of Cu stress on the invertaseactivity and root growth in two populations ofRumexdentatusL. with different Cu tolerance[J]. Enviro Toxicol, 2008, 23(4):443-450.
[7] Tessier A,Campbell P G C,Bisson M S extraction procedure for the speciation of particulate trace metals. Anal Chem, 1979,51(7): 844-851.
[8] 张开明,黄苏珍,原海燕,等.铜污染的植物毒害、抗性机理及其植物修复[J].江苏环境科技,2005,18(1):4-9.
[9] 黄细花,赵振纪,刘永厚,等.铜对紫云英生长发育影响的研究[J].农业环境保护,1993,12(1):1-6.
[10] 莫 争,王春霞,陈 琴,等.重金属Cu,Pb,Zn,Cr,Cd在水稻植株中的富集和分布[J].环境化学, 2002, 21(2):110-116.
[11] 周启星, 黄国宏. 环境生物地球化学及全球环境变化[M].北京:科学出版社, 2001.
[12] 杨宏伟, 王明仕, 徐爱菊, 等.黄河(清水河段)沉积物中锰、钴、镍的化学形态研究[J].环境科学研究,2001, 14(5):20-22.
