尖镰胞菌细胞色素P450 55a1基因超表达载体的构建和水稻日本晴遗传转化
2014-08-06吴云华
吴云华,邓 欢
(中南民族大学 生命科学学院, 武陵山区特色资源植物种质保护与利用湖北省重点实验室, 武汉 430074)
一氧化氮(NO)是一类可扩散的脂溶性小分子物质,广泛存在于生物体内,易于在细胞内和细胞间扩散[1].NO在植物体内可自身合成,或通过酶促和非酶促反应进行[2].它作为植物体中的信使分子对植物的光形态建成[3]、呼吸作用和根的生长发育[4]起重要的作用,同时对植物进行各种生物胁迫[5](如病虫害)和非生物胁迫[6](如干旱、盐胁迫、低温及重金属)的信息传递中也发挥了重要作用.但目前关于NO在各种生理条件下对水稻幼苗影响的研究较少,尖镰胞菌CYP55A1是一类具有NO还原作用的酶系,故也被称为一氧化氮还原酶细胞色素P450(CYP450)[7],本实验选取cyp55a1基因作为研究对象,对水稻日本晴进行遗传转化得到阳性转基因植株,为研究该基因功能和NO对水稻的生理作用提供实验材料.
1 材料和方法
1.1 材料
Cyp55a1基因为本实验由尖镰胞菌中克隆得到,表达载体pCAMBIA1302、水稻日本晴的种子,大肠杆菌DH5α,农杆菌EHA105宿主菌株均由中南民族大学武陵山区特色资源植物种质保护与利用湖北省重点实验室提供.
限制性内切酶、pyrobest DNA聚合酶、DNA Marker、T4连接酶(TAKARA公司),DNA凝胶回收试剂盒(Axygen公司),酵母粉、胰蛋白胨、总RNA提取试剂Trizol、羧苄(invitrogen公司),反转录试剂盒(ReverTra Ace-α-TM, 日本TOYOBO公司),琼脂糖(FMC公司),其他试剂均为国产试剂分析纯.引物由南京金斯瑞公司合成.
1.2 pCAMBIA1302-cyp55a1植物表达载体的构建
用SDS碱裂解法提取pCAMBIA1302空载体质粒和用Trizol试剂提取尖镰胞菌的总RNA并将其反转得到其cDNA.用设计的特异性引物(见表1)以cDNA作为模板进行PCR扩增.再将扩增产物与pCAMBIA1302空载体质粒用NcoI和SpeI同时进行双酶切,用T4连接酶将二者连接6 h.

表1 引物序列
其中R1比R2多一个终止密码子,目的是为了阻止载体下游的GFP蛋白表达,防止GFP融合蛋白对CYP蛋白的功能造成影响.共构建2个双元表达载体:pCAMBIA1302-cyp55a1-gfp1和pCAMBIA1302-cyp55a1.
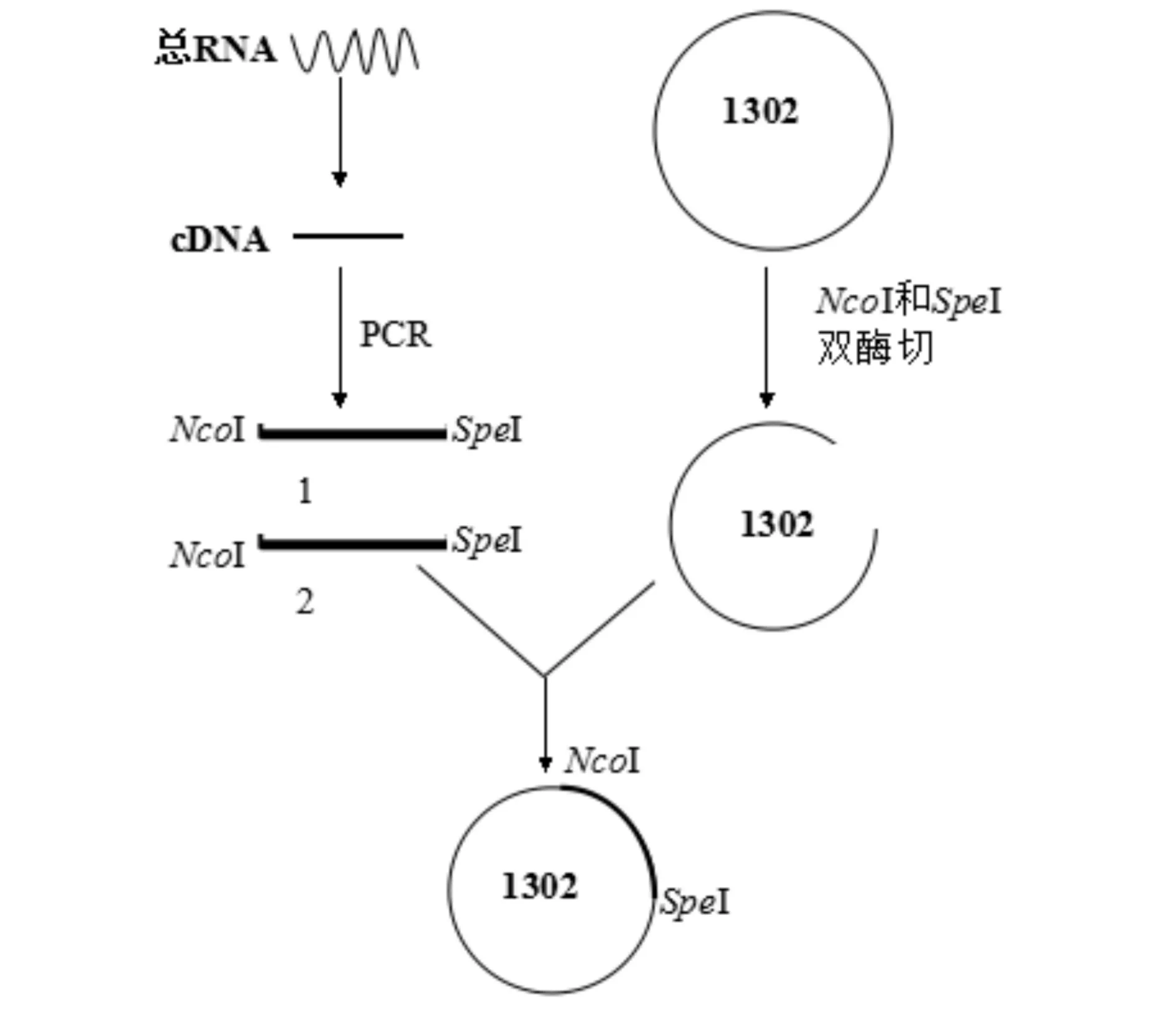
图1 载体pCAMBIA1302-cyp55a1构建流程图Fig.1 The flow diagram for the construction of vector pCAMBIA1302-cyp55a1
1.3 水稻的遗传转化
参考李毓等[8]的方法,利用实验室中保存好的成熟的野生型日本晴种子进行诱导2~3周及继代培养4~6 d,用农杆菌介导法侵染胚性愈伤,共培养2~3 d后进行筛选.2~3周后更换一次筛选培养基,2周后将长有白色抗性愈伤的进行分化培养,直到分化出绿色的小幼苗.将绿色幼苗转入生根培养基中,待植株长到瓶口处、根系发达后,打开瓶口加入一定量的无菌水进行炼苗,约1周后移栽到实验田.
1.4 转基因植株的阳性鉴定
采用CTAB法提取转基因植株的基因组DNA,以cyp55a1基因的引物进行PCR检测.电泳产物取3 μL进行检测.
1.5 阳性植株的RT-PCR
采用Trizol法提取阳性转基因植株的总RNA,利用TOYOBO Rerver Tra Ace-α-TM 试剂盒将其反转录成 cDNA.用内参18sRNA引物对cDNA模板进行PCR鉴定,再按一定比例稀释.用设计cyp55a1基因的RT-PCR引物和18sRNA引物同时对cDNA模板进行RT-PCR.
2 结果及分析
2.1 载体构建
构建的cyp55a1载体用引物F和R做PCR鉴定,cyp55a1-1302载体用NcoI内切酶和SpeI内切酶做双酶切鉴定,cyp55a1基因为1203 bp, 2个载体均为阳性,测序结果正确.
2.2 遗传转化与转基因植株T0代的鉴定
将构建好的pCAMBIA1302-cyp55a1超表达载体通过农杆菌介导法侵染日本晴的愈伤组织,经过诱导、筛选、分化、生根、炼苗,然后种植于田间.
取约5 cm的幼嫩叶片,以CTAB法提取基因组DNA为模板,使用cyp55a1引物(F,R),以转空载体pCAMBIA1302得到的转基因日本晴为阴性对照,进行PCR检测,鉴定T0代阳性转基因植株,共获得了13株阳性苗(部分鉴定结果见图4).
2.3 阳性植株的RNA水平的检测
2.3.1 转基因阳性植株幼苗RNA的提取及cDNA检查
取5 cm左右的嫩叶,用Trizol试剂提取其总RNA(见图5a),电泳可见清晰的3条主带,说明转基因植株幼苗RNA提取成功.利用 TOYOBO Rerver Tra Ace-α-TM 试剂盒将总RNA反转录成 cDNA.用内参18sRNA引物对cDNA模板进行PCR鉴定(见图5b),从图5b可见单一的目的条带,大小与预测相符,结果表明cDNA反转成功,可用于RT-PCR实验.

a) 总RNA电泳图; b) cyp55a1目的片段PCR扩增电泳图; c) cyp55a1/1302重组质粒DNA电泳图,1为空载1302;d) cyp55a1/1302重组质粒双酶切电泳图; e) pCAMBIA1302-cyp55a1重组质粒转农杆菌后的质粒PCR鉴定电泳图图2 重组质粒鉴定图Fig.2 Identification of recombinant plasmid

a)水稻胚性愈伤组织诱导;b)愈伤组织继代培养;c)抗性愈伤组织筛选;d)愈伤组织分化成苗;e)转化植株生根成苗图3 遗传转化的过程图Fig.3 Procedures of genetic transformation

a) T0代植株幼苗基因组DNA结果; b) T0代植株的PCR阳性鉴定图4 T0代植株DNA提取及PCR阳性鉴定Fig.4 DNA extraction and positive identification of T0 generation plant by PCR

a) 转基因阳性植株幼苗总RNA的电泳图; b) RNA反转得到的cDNA的PCR电泳图(内参18sRNA引物)图5 阳性植株RNA的提取和反转cDNA的检测Fig.5 RNA extraction and cDNA testing of T0-generation
2.3.2 T0代阳性植株cyp55a1-ORF表达量的相对定量分析
按一定比例稀释cDNA模板,用设计的RT-PCR引物55a1(F、R)和18sRNA引物(F、R)同时对cDNA模板进行RT-PCR. 结果表明,相比转空载得到的日本晴植株,阳性植株的cyp55a1基因的表达水平得到不同程度的上调(见图6),说明cyp55a1基因在阳性植株中得到了表达,其中cyp55a1-A1-1,cyp55a1-A2-5,cyp55a1-A2-6和cyp55a1-A2-7这4个转基因植株中cyp55a1基因表达较高,可用于后续的实验材料.
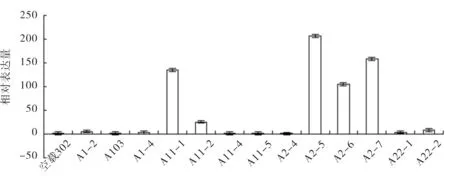
图6 To代阳性植株的RT-PCR结果Fig.6 RT-PCR results of T0 generations positive plants
3 结语
本实验成功地将cyp55a1基因克隆到植物过表达载体pCAMBIA1302中,利用农杆菌介导法进行遗传转化,获得了多个转基因植株.对这些转植株进行阳性鉴定和RNA水平表达量分析,结果表明:cyp55a1基因已成功插入到水稻基因组中,获得了多个高表达的转基因植株.本实验获得的高表达转基因植株为cyp55a1基因功能和NO对水稻生理作用的后续研究提供了实验材料.
参 考 文 献
[1] Moncada S,Higgs A.The L-arginine-nitric oxide pathway[J]. N Engl J M, 1993, 329(27): 2002-2012.
[2] Wojtaszek P. Nitric oxide in plants: to NO or not [J]. Phytochemistry, 2000, 54(1): 1-4.
[3] Takahashi S, Yamasaki H. Reversible inhibition of pho-sphorylation in chloroplasts by nitric oxide[J]. FEBS Lett, 2002, 512(1/3): 145-148.
[4] Pagnussat G C, Simontacchi M, Puntarulo S, et al. Nitric oxide is required for root organogenesis[J]. Plant Physiol, 2002,129(3): 954-956.
[5] Durner J,Wendehenne D, Klessing D F. Defense gene induction in tobacco by nitric oxide, cyclic GMP, and cyclic ADP-ribose[J]. Proc Natl Acad Sci U S A, 1998, 95(17):10328-10333.
[6] Pagnussat G C, Simontacchi M, Puntarulo S, et al. Nitric oxide is required for root organogenesis[J]. Plant Physiol, 2002,129(3): 954-956.
[7] Shoun H, Tanimoto T. Denitrification by the fungus Fusarium oxysporum and involvement of cytochrome P-450 in the respiratory nitrite reduction[J]. J Biol Chem, 1991, 266: 11078-11082.
[8] 李 毓, 洪国琴, 庄伟建, 等.水稻胚性愈伤诱导及其遗传转化的几个技术参数研究[J].核农学报,2008,22(4):394-398.
