乌鲁木齐人群药物性耳聋患者MT-RNR1基因突变频谱分析
2014-08-03王校
王 校
(上海中优医药高科技有限公司,上海 200433)
耳聋是最常见的残疾之一,据WHO估计,2005年全球有2.78亿人患有中度以上听力损失,其中2/3在发展中国家。中国有13亿人口,据2006年第二次残疾人抽样调查显示,我国听力和言语残疾患者高达2 780万人,其中7岁以下聋儿高达80多万,其中30多万是由于抗生素使用不当所导致,占总体聋哑儿童的30%~40%[1]。氨基糖苷类抗生素(aminoglycoside antibiotics,AmAn)主要是通过损害前庭蜗神经(包括前庭和耳蜗),从而对患者听力损失。氨基糖苷类药物是通过与细菌核糖体结合,干扰细菌蛋白合成而发挥抗菌活性的。人类线粒体DNA的基因变异使其更类似于细菌核糖体,更易与氨基糖苷类药物结合。由于氨基糖苷类药物在内耳听细胞中半衰期较长(数月),因此,一旦内耳听细胞线粒体核糖体与药物结合,将引起持久、严重的耳毒性[2]。目前,研究得较多的具有代表性的线粒体DNA突变包括12SrRNA基因上的961insC、961delT/T961G、T1095C、C1494T、A1555G等的突变[3]。这些突变可以是遗传的,也可以是获得性的,可以是同质的也可以是异质的。12S rRNA 1555A>G和1494C>T突变只在部分听力损失的人群中检测到[4],推测存在其他与耳聋相关的基因突变位点。鉴于目前鲜见我国少数民族人群耳聋相关基因突变位点的报道,本研究对新疆乌鲁木齐少数民族集聚地区开展MT-RNR1基因的筛查,旨在为绘制少数民族人群非综合征型耳聋患者的线粒体MT-RNR1基因突变频谱提供可靠信息。
1 对象与方法
1.1 对象和听力学检查 我们在2012年1月至2012年12月对999例来自中国新疆乌鲁木齐地区的人群进行了详细的病史调查和体检,以确定是否有耳聋或听力下降的临床表现、是否有氨基糖苷类抗生素的接触史以及是否有MT-RNR1基因上的碱基突变。研究对象全部按照中国优生优育协会伦理委员会管理规定签署了知情同意书。将听力损失的严重程度根据临床诊断标准进行分类:① 听力正常:≤25 dB;② 轻度听力损失:26~40 dB;③ 中度听力损失:41~70 dB;④ 重度听力损失:71~90 dB;⑤ 极重度听力损失:>90 dB。
1.2 线粒体MT-RNR1基因突变检测
1.2.1 硅胶吸附法提取基因组DNA 首先收集研究对象的口腔黏膜细胞,冷冻保存;实验室取出装有口腔拭子离心管解冻,旋涡震荡器上震荡10~20 s,离心12 000 rmp 2 min;去上清,加入1 ml DNA裂解液,混匀;加入50 μl硅胶制剂,混匀,离心10 000 rmp,10 s;去上清及拭子头,加入1 ml DNA裂洗液,混匀,离心10 000 rmp,10 s;去上清,加入1ml DNA裂解液,混匀,离心10 000 rmp,10 s;去上清,加75%乙醇洗涤两遍,离心;去上清,加入丙酮,干燥硅胶颗粒;加入纯水溶解,离心12 000 rmp 3 min,取上清液50 μl用于后续检测。取5 μl样本1% 琼脂糖凝胶电泳检测,根据检测结果标化样本到10 ng/μl。
1.2.2 PCR扩增 采用在线软件Primer 3设计PCR引物用于扩增线粒体DNA MTRNR1上包含961-1555位点的片段。引物序列如下:正向引物:5’-AAAACGCTTAGCCTAGCCACA-3’反向引物:5’-GGTTTAGCTCAGAGCGGTCAA-3’反应体系(15 μl)包含1x HotStar Taq buffer,3.0 mM Mg2+,0.3 mM dNTP,1 U HotStarTaq polymerase,2 μl样本DNA和正、反向引物各0.5 μl(浓度为10 μM);在ABI 2720型PCR扩增仪上进行。5 μl PCR与1 μl 6×loading buffer混匀,1%琼脂糖凝胶,1×TAE电泳缓冲液,120 V电泳20 min,marker为DL2000,目的条带在898 bp左右。
1.2.3 PCR产物纯化 反应体系包含1U SAP酶、1U Exo I酶和3ul PCR产物组成;反应条件为:37℃ 60min,80℃ 15min,4℃恒温保存;
1.2.4 测序反应 反应体系(5μl)包含1μl BigDye、1μl 测序引物(5’-GGTTTAGCTCAGA GCGGTCAA-3’)(浓度为3 μM)、1 μl PCR纯化产物和2 μl去离子水组成;反应条件为预热96℃、2 min;再进行25个循环的96℃ 10 s、50℃ 5 s、60℃、4 min; 4℃恒温保存;反应结束后每孔加入1 μl 125 mM乙二胺四乙酸EDTA和无水乙醇15 μl,室温沉淀15min;3 650 rmp/min,4℃离心30 min,轻轻倒去上清液;每孔加30 μl 70%乙醇,3 650 rmp/min,4℃离心15 min,倒去上清液;室温放置20 min后加入8 μl 95%甲酰胺与ddH2O混合物,95℃变性5 min后上ABI3130XL测序仪,用软件Chromas查阅测序检测结果。
2 结 果
2.1 研究对象的人口学特征 999例中,汉族人有529人,维吾尔族人有295人,回族有123人,哈萨克族44人,蒙古族4人,俄罗斯族2人,东乡族和土族各1人。男性425例, 女性574例;最小年龄1岁,最大年龄79岁,平均18岁。73人(7.3%)有氨基糖苷类药物接触史,537人(53.8%)未接触氨基糖苷类药物,389人(38.9%)不清楚自己的药物接触史。经过听力学检测,共有508人患有耳聋(占50.9%),491人没有患病。耳聋患者分别表现不同程度的听力损失:186人(18.6%)为极重度听力损失,111人(11.1%)为重度听力损失,62人(6.2%)为中度听力损失,17人(1.7%)为轻度听力损失,132人(13.2%)的头颅损失情况不明。
2.2 线粒体DNA MTRNR1基因突变分析 共有109例样本的MT-RNR1基因上共发现11个位点发生碱基改变,即:961 delT/insC、C1494T、A1555G、T1095C、A1116G、T1005C、G1007A、T1107C、A1047G、A1585G、T1520C,携带率为10.91%。位点检测结果详见图1-12,突变位点及人数情况详见表1。

图1 MTRNR1(正常)
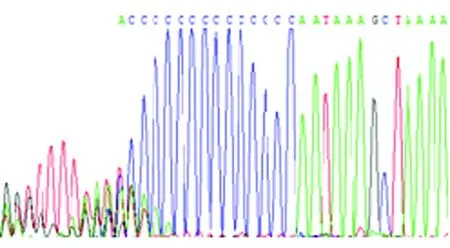
图2 MTRNR1 961 delT/insC

图3a MTRNR1 T1095C T

图3b MTRNR1 T1095C C

图4a MTRNR1 C1494T C

图4b MTRNR1 C1494T T

图5a MTRNR1 A1555G A

图5b MTRNR1 A1555G G
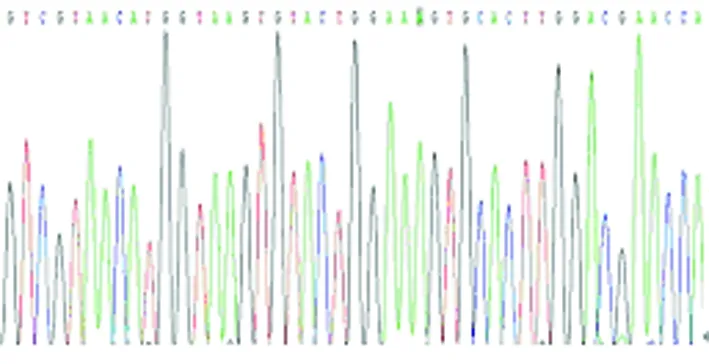
图6a MTRNR1 A1585G A

图6b MTRNR1 A1585G G

图7a MTRNR1 A1047G A
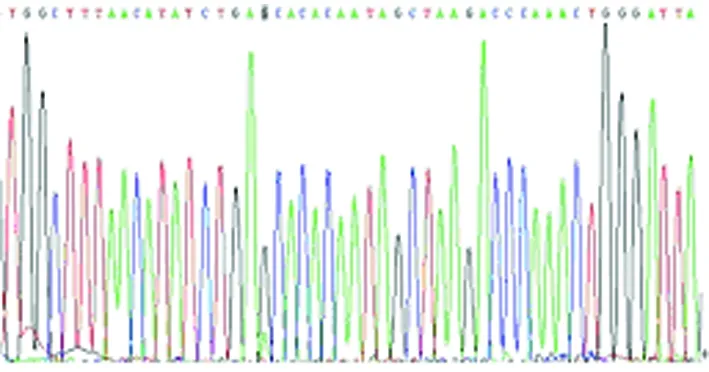
图7b MTRNR1 A1047G G

图8a MTRNR1 A1116G A

图8b MTRNR1 A1116G G

图9a MTRNR1 T1520C T

图9b MTRNR1 T1520C C
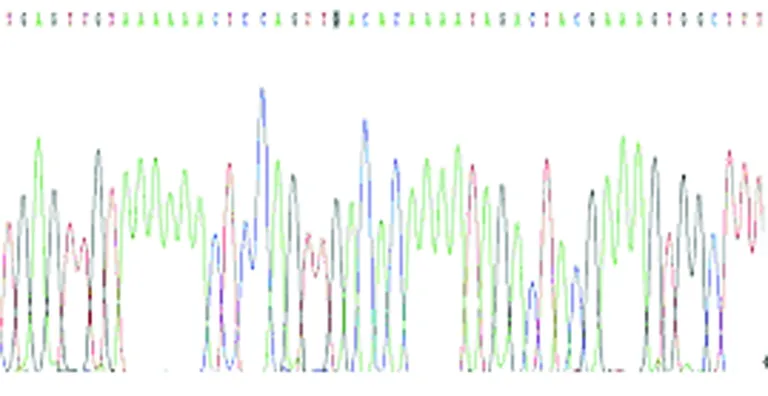
图10a MTRNR1 G1007A G
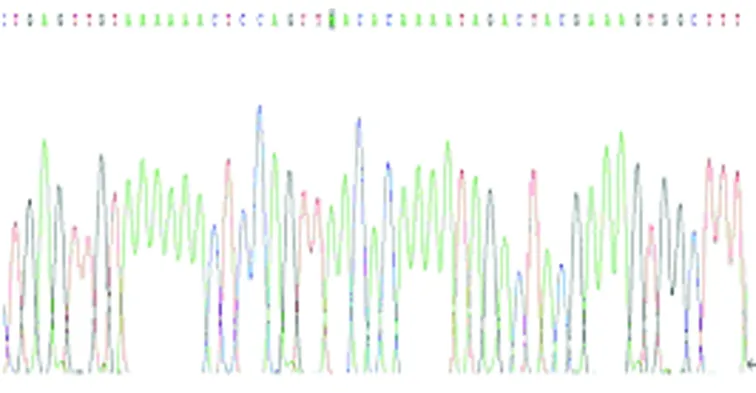
图10b MTRNR1 G1007A A

图11a MTRNR1 T1107C T
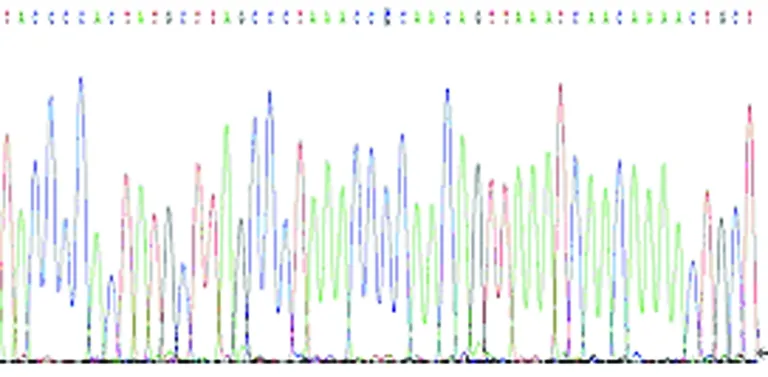
图11b MTRNR1 T1107C C

图12a MTRNR1 T1005C T
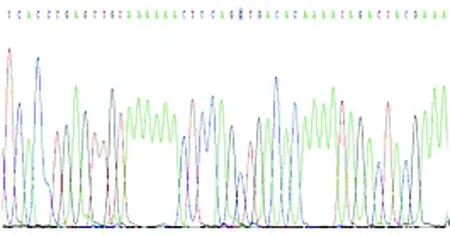
图12b MTRNR1 T1005C C
表1MT-RNR1基因的11个突变位点及人数情况

位点受累人数重度/极重度人数接触AmAn且重度/或极重度耳聋人数少数民族人数961 delT/insC11316C1494T2110A1555G221152T1095C3002A1116G2001T1005C21618G1007A1111T1107C4310316A1047G1000A1585G2002T1520C1000
3 讨 论
A1555G突变被认为是世界上跟耳聋相关的最显著线粒体DNA突变,并已在白种人和亚洲人等不同人群中得以确定,且跟线粒体单倍型类群相关[4-5]。这种突变在亚洲人群中的发生更加普遍,在亚裔人群药物性耳聋患者中,1555A>G突变频率为5%~33%[6],而国内报道的mtDNA A1555G突变阳性率是3.43%[7],但在我国西北地区线粒体DNA 12SrRNA A1555G突变检出率显著高于东北地区[8]。本次研究的1555A>G基因突变频率为4.33%,与国内报道相似。
C1494T突变的发生率远低于A1555G突变对线粒体。有研究显示,在621例耳聋患者中共筛查出2例mtDNA C1494T突变个体,频率为0.32%[9]。1494C>T突变频率在本研究的研究对象者中占0.39%,与以往研究结果相似。位于12SrRNA高度保守的解码区的同质性的C1494T突变与耳聋相关。12SrRNA基因功能有影响的核修饰基因可能会使C1494T突变的生化缺陷增强,使该突变携带者听力下降,而这种核修饰基因也可以抑制该突变的作用而使该成员听力正常[10]。
本研究显示961 delT/insC基因突变频率达2.17%。Bacino等[11]首次报道mtDNA 961delT/insC与药物性耳聋相关,并指出线粒体12SrRNA基因的第961位碱基附近的异质性的缺失,插入突变以及该基因中两个同质性的突变,可导致产生氨基糖苷类药物耳毒易感性。但近年来有研究并不支持mtDNA961delT/insC突变是氨基糖苷类抗生素诱发性耳聋的遗传基础[12-13]。李建忠等[14]认为mtDNA 961位点附近可能是一个多变异的区域,mtDNA 961delT/insC可能是一个与氨基甙类药物性耳聋不明确相关的多态。同时也有研究表明mtDNA G1007A和A1313G点突变、mtDNA G7444A突变可能分别参与了A1555G导致的听力损害的过程[15]。Li等[16]报道线粒体12SrRNA基因的A827G,T1005C和A1116G突变可能参与AAID的发病机制。
根据本研究数据提示,与MT-RNR1基因上的961delT/insC、A1555G、C1494T一样,T1005C、T1107C突变或许也是一个在中国人群中常见的药物敏感致聋靶点,尤其是在新疆的少数民族聚集地区。对于部分突变频率低的位点,我们希望日后能展开更多更详尽的研究。本研究将有助于更进一步揭示氨基糖苷类药物中毒性耳聋的病因,以及临床表现的遗传基础和本质,是实现临床大规模基因诊断的基础,对于耳聋基因的个体治疗也有着重要意义。
参考文献
[1]杨爱芬.浙江省非综合征型聋病分子流行病学调查[C]. 温州医学院硕士学位论文, 2008.
[2]邓万俊.氨基糖苷类药物临床应用再评价[J].国外医药抗生素分册, 2010,3l(5): 219-223.
[3]Li Z, Li R, Chen J,etal. Mutational analysis of the mitochondrial 12SrRNA gene in Chinese pediatric subjects with aminoglycoside-induced and non-syndromic hearing loss[J].HumGenet, 2005, 117(1): 9-15.
[4]Guan M X.Mitochondrial 12SrRNA mutations associated with aminoglycoside ototoxicity[J].Mitochondrion, 2011, 11(2): 237-245.
[5]张 婷, 曾爱平, 郑 静,等.与耳聋相关的线粒体12SrRNA突变[J].中国生物化学与分子生物学报, 2012, 28(4):316-325.
[6]Tessa A, Giannotti A, Tieri L,etal. Maternally inherited deafness associated with a T1095C mutation in the mDNA[J].EurJHumGenet, 2002, 9(2): 147-149.
[7]刘 新, 戴 朴, 黄德亮,等. 线粒体DNA A1555G突变大规模筛查及其预防意义探讨[J].中华医学杂志, 2006, 86(19): 1318-1322.
[8]鲍晓林, 郭玉芬, 刘晓雯,等.西北地区与东北地区耳聋先证者线粒体DNA12SrRNA A1555G突变特点分析[J].听力学及言语疾病杂志, 2010,18(4): 387-388.
[9]龚莎莎. 线粒体DNAC1494T突变分子流行病学调查及线粒体tRNA与耳聋关系的研究[C]. 温州医学院硕士学位论文, 2011.
[10]Guan M X, Fischel-Ghodsian N, Attardi G. Biochemical evidence for nuclear gene involvement in phenotype of non-syndromic deafness associated with mitochondrial 12S rRNA mutation[J].HumMolGenet, 1996, 5(7):963-971.
[11]Bacino C, Prezant T R, Bu X, Foumier P,etal. Susceptibility mutations in the mitochondrial small ribosomal RNA gene in aminoglycoside induced deafness[J].Pharmacogenetics, 1995,5(3): 165-172.
[12]Kobayashi K, Oquci T, Asamura K,etal. Genetic features, clinical phenotypes, and prevalence of sensorineural hearing loss associated with the 961delT mitochondrial mutation[J].AurisNasusLarynx, 2005, 32(2): 119-124.
[13]Bae J W, Lee K Y, Choi S Y,etal. Molecular analysis of mitochondrial gene mutations in Korean patients with nonsyndromic hearing loss[J].IntJMolMed, 2008, 22(2): 175-180.
[14]李建忠,程 静, 卢 宇,等.遗传性耳聋家系线粒体DNA 961delT/insC突变的致病性分析[J]. 中华耳科学杂志, 2010,8(1): 9-13.
[15]吴超群.氨基糖苷类抗生素致聋的遗传易感性[J].中国优生优育, 2008, 14(1): 7-11.
[16]Li Z, Li R, Chen J,etal.Mutational analysis of the mitochondrial 12S rRNA gene in Chinese pediatric subjects with aminoglycoside-induced and non-syndromic hearing loss[J].HumGenet, 2005, 117(1): 9-15.
