深海红鱼胶原蛋白的超声波辅助提取及其理化特性
2014-07-27,*
,*
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.镇江科华渔业发展有限公司,江苏镇江 212134)
我国是渔业大国,但由于加工水平较低,大量加工废弃物造成了严重的资源浪费和环境污染。胶原蛋白可被广泛应用于食品、化妆品、医药、生物材料等领域,但近年来疯牛病、口蹄疫、猪链球菌、H1N1流感等传染病的频繁暴发,使传统上畜禽来源胶原蛋白的安全性越来越让人担心;同时,宗教和习俗原因也使其应用受到一定的限制[1]。因此,从水产品加工废弃物中分离可以替代畜禽来源的胶原蛋白,对于提高渔业效益、减少环境污染、促进食品安全具有重要意义。
目前,胶原蛋白的提取主要有盐法、酸法和酶法。盐法和酸法仅能将组织中新生成的没有形成分子间交联或交联度较低的胶原蛋白抽提出来,因而提取率较低;酶法可以特异性地水解胶原蛋白末端交联部位,提取率较高,但酶解速率较低,一般需要2 d时间[2]。近年来,超声波技术吸引了越来越多人的注意,已广泛应用于多种生物活性物质的制备,如生物碱、类黄酮、油脂、多糖、蛋白质等,其空化、湍动、微扰、界面、聚能等效应有力地促进了溶剂向生物材料的渗透和目标物质向溶剂的释放,从而显著提高目标物质的提取效率[3]。
深海红鱼(Sebastes mentella)是一种非常重要的商业鱼种,主要分布于北大西洋海域,广泛应用于生鱼片、鱼糜制品的生产,年捕捞量超过10万t,其加工废弃物占年捕捞量的50%~70%。本研究首次将超声波技术引入深海红鱼胶原蛋白的制备过程,优化提取工艺关键参数,明确胶原蛋白理化特性,以期为其高效生产和潜在应用提供一定的理论依据。
1 材料与方法
1.1 材料
深海红鱼(Sebastes mentella)由连云港三星食品有限公司提供,2010年夏季捕捞于冰岛海域,体长30cm~35 cm,去除鱼鳞及皮下组织后,将鱼皮用自来水清洗干净,沥干,剪碎(约2×2 mm),-20℃贮藏。
蛋白质分子量标准:德国MBI;氨基酸标样:美国Sigma;电泳试剂:德国Merck;其它药品:国药集团;JY92-II超声波细胞粉碎机:宁波新芝;EPS604垂直电泳系统:南京科宝;MLC-703氨基酸自动分析仪:日本Hitachi;170-SX 红外光谱仪:美国 Nicolet。
1.2 方法
1.2.1 原料预处理
将鱼皮于20%NaCl(0.05 mol/L Tris-HCl,pH 7.5)溶液中(1∶20,w/v),均质 2 min后 5 000 g× 15 min离心,取沉淀,重复该操作直到没有浮游脂肪和气泡产生,然后用去离子水清洗,冻干。
1.2.2 胶原蛋白的提取
将原料置于预冷水中(1∶100,w/v)进行超声波处理,然后加入乙酸和胃蛋白酶分别至0.5 mol/L和0.1%(w/v)提取胶原蛋白,高速离心(20 000 g×60 min)后,向上清液中加入NaCl至0.9 mol/L盐析,离心(5 000 g×15 min)后将沉淀溶解于1.0 mol/L NaCl(0.05 mol/L Tris-HCl,pH 7.5),再次高速离心(20 000 g× 60 min)取上清液,加入NaCl至2.4mol/L盐析,离心(10000g×20min)后取沉淀溶解于0.5 mol/L乙酸,透析,冻干,即为胶原蛋白。所有操作均在4℃下进行。胶原蛋白的提取率(%)按如下公式计算:

1.2.3 超声波辅助提取胶原蛋白工艺的优化
采用响应曲面法Box-Behnken设计进行胶原蛋白提取工艺的优化。根据单因素试验结果选择了提取时间、超声功率和超声时间作为关键因子,因素水平设计如表1所示,试验设计、数据分析和模型建立应用软件Design Expert 6.0进行。
1.2.4 胶原蛋白理化特性分析
羟脯氨酸含量根据ISO 3496-1994方法测定;氨基酸组成通过氨基酸自动分析仪检测胶原蛋白酸解产物得到;SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)采用5%分离胶与3%浓缩胶不连续垂直电泳系统,考马斯亮蓝R-250染色分析;傅立叶转换红外光谱(FTIR)利用KBr压片法获得。

表1 Box-Behnken设计试验因子水平及编码Table 1 Experimental levels and codes of the factors used in Box-Behnken design
1.2.5 统计分析
数据以3次独立样品测定的平均值表示;统计分析利用Student's t检验和一维方差分析(ANOVA),多重比较采用最小显著差数法(LSD);P<0.05被认为存在显著差异。
2 结果与讨论
2.1 超声波辅助提取胶原蛋白工艺的优化
表2显示了响应曲面法Box-Behnken实验设计矩阵与胶原蛋白提取率的实测值和预测值。对实验数据进行二次多元回归拟合,获得了胶原蛋白提取率(Y)与提取时间(A)、超声功率(B)、超声时间(C)的回归模型:

表2 Box-Behnken实验设计矩阵与胶原蛋白提取率的实测值和预测值Table 2 Box-Behnken design matrix along with the experimental and predicted values of collagen yield
Y=-73.13000+6.65925A+0.14196B+7.62402C-0.204 68A2-0.000 203 24B2-0.172 62C2+0.005 157 5AB-0.067 312AC-0.001 373 0BC
图1显示了各因子交互作用对胶原蛋白提取率影响的响应曲面和等高线,从该图和方差分析可知,提取时间、超声功率和超声时间及其交互作用对胶原蛋白的提取率均存在显著影响。总的来说,随着提取时间、超声功率和超声时间的增加,胶原蛋白提取率逐渐增大,达到最高点后,可能由于胶原蛋白的变性或分解,提取率又有所下降。

图1 交互作用对胶原蛋白提取率影响的响应曲面和等高线(A:超声时间20 min;B:超声功率500 W;C:提取时间16 h)Fig.1 Fitted response surface and corresponding contour of interaction effect on collagen yield.(A:ultrasonic time 20 min;B:ultrasonic power 500 W;C:extraction time 16 h)
从二次多项式模型的方差分析(表3)中可以看出,该回归模型极显著(P<0.000 1);失拟项不显著(P=0.804 4);相关系数(R)为 0.997 8,表明实验值和预测值较为一致;校正决定系数(R2Adj)为0.990 0,说明该模型拟合较好,误差较小,99%的变异分布在所研究的3个关键因子中,总变异度中仅有1%不能由该模型来解释,可用于分析和预测任何组合条件下的提取率。
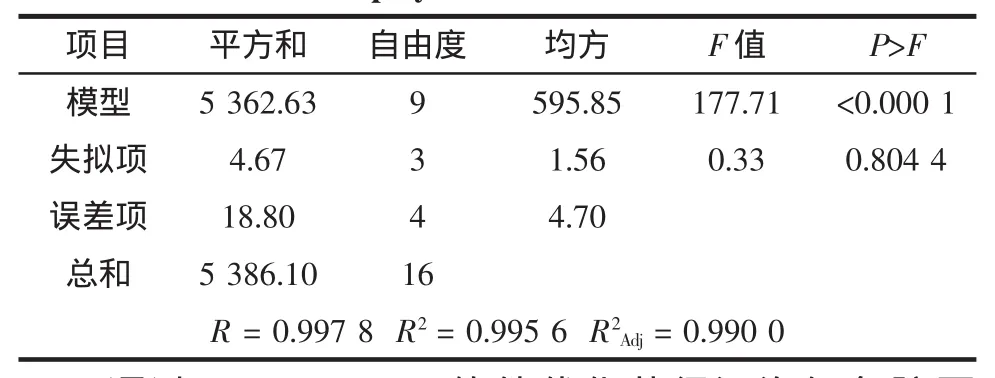
表3 二次多项式拟合模型方差分析Table 3 Analysis of variance(ANOVA)for the fitted quadratic polynomial model
通过Design Expert软件优化获得深海红鱼胶原蛋白的最佳提取条件:提取时间18 h,超声功率505 W,超声时间15 min。在此条件下,胶原蛋白的提取率为93.6%,进一步实验也验证了该模型的精确性(R=0.9956,提取率94.2%)。与传统方法的提取率(92.2%)相比,超声波辅助提取率没有显著性差异,但提取时间从48 h缩短到了18 h,显著提高了制备效率。
2.2 胶原蛋白的理化特性分析
2.2.1 氨基酸组成
表4显示了深海红鱼胶原蛋白的氨基酸组成,其中甘氨酸的含量最高,约占氨基酸总量的1/3;丙氨酸、脯氨酸、谷氨酸、羟脯氨酸和丝氨酸含量也相对较高,而酪氨酸、组氨酸和羟赖氨酸含量相对较低;此外,与其它鱼种相同,没有发现色氨酸和半胱氨酸的存在[1,4-5]。总亚氨基酸(脯氨酸、羟脯氨酸)含量为16.0%,显著低于温带和热带鱼种来源的胶原蛋白(18%~20%),而与冷水鱼种相似(16%~18%),这也说明该胶原蛋白可能具有较低的热稳定性[6-7]。
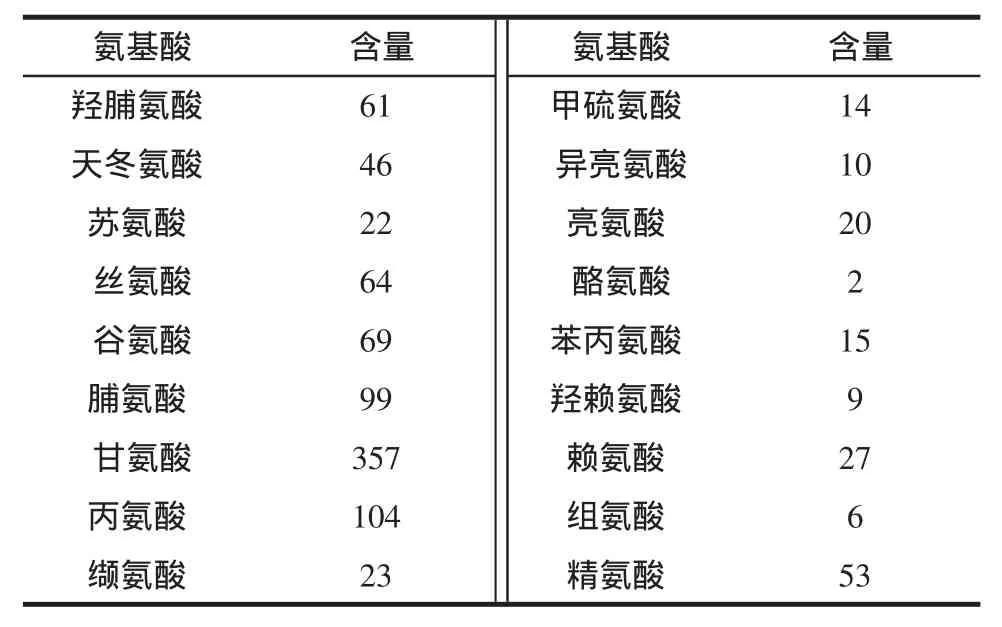
表4 深海红鱼胶原蛋白的氨基酸组成(残基数/1 000个残基)Table 4 Amino acid profile of collagen from deep-sea redfish(residues/1 000 residues)
2.2.2 SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)
图2显示了深海红鱼胶原蛋白的SDS-PAGE图谱。总的来说,该胶原蛋白与其它鱼种来源的胶原蛋白图谱相似,至少含有两种不同迁移率的α链(α1链和α2链)及其交联链(β链),并且α1链的强度显著高于α2链[8-9]。根据电泳图谱的条带组成及其迁移率,可以判断该胶原蛋白主要为I型,这一结果与Nile perch、black drum、sheepshead seabream、bigeye snapper、Brownstripe red snapper等鱼种相似[1,8,10-11]。此外,该胶原蛋白也可能有α3链存在,但其具有和α1链相同的迁移率,因而无法在此凝胶上将其和α1链区分开来[12-13]。

图2 深海红鱼胶原蛋白SDS-PAGE图谱Fig.2 SDS-PAGE pattern of collagen from deep-sea redfish
2.2.3 傅立叶转换红外光谱(FTIR)
图3和表5显示了深海红鱼胶原蛋白的FTIR光谱及其主要吸收峰的归属,与其它鱼种来源的胶原蛋白相似但又不尽相同,和酸法制备的深海红鱼胶原蛋白也略有不同,这表明不同鱼种、不同方法制备的胶原蛋白二级结构存在一定差异[14-15]。
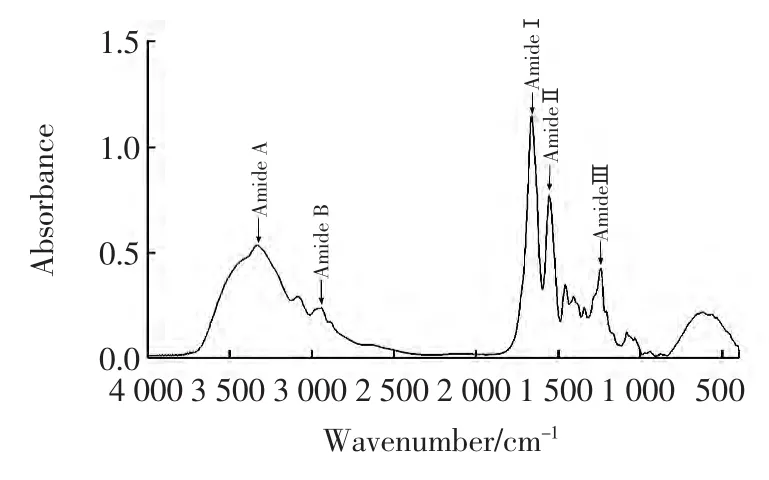
图3 深海红鱼胶原蛋白的FTIR光谱Fig.3 Fourier transform infrared spectra of collagen from deepsea redfish

表5 深海红鱼胶原蛋白FTIR光谱峰位及其归属Table 5 FTIR spectra peak locations and assignment for collagen from deep-sea redfish
具有完整三股螺旋结构的胶原蛋白的1 240 cm-1(Amide III)峰与1 454 cm-1峰面积比为1.0,而该胶原蛋白约为1.2,说明其三股螺旋结构发生了轻微变化,这可能是由于其N末端和C末端的酶解丢失而引起的[16] 。
Amide A峰与N-H伸缩振动有关[14]。根据Doyle理论,游离的N-H伸缩振动在3 400 cm-1~3 440 cm-1之间,而当N-H形成了氢键,其振动频率则会显著降低,通常为3 300 cm-1左右[17],而该胶原蛋白则在3 328 cm-1(表5),这说明其中较多的N-H参与了维持胶原蛋白特有三股螺旋结构的氢键的形成[11]。
3 结论
1)获得了超声波辅助提取深海红鱼胶原蛋白的最佳工艺:提取时间18 h、超声功率505 W,超声时间15 min。在此条件下,胶原蛋白的提取率(93.6%)与传统方法无显著性差异,但提取时间缩短了30 h。
2)深海红鱼胶原蛋白主要为I型,具有较低的亚氨基酸含量(16.0%),由于N末端和C末端非螺旋区的丢失,其分子结构有所改变,但大量氢键的存在使其三股螺旋结构仍占主导地位。
[1] Jongjareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper(Lutjanus vitta)[J] .Food Chemistry,2005,93(3):475-484
[2] Huang Y R,Shiau C Y,Chen H H,et al.Isolation and characteriza-tion of acid and pepsin-solubilized collagens from the skin of balloon fish(Diodon holocanthus)[J] .Food Hydrocolloids,2011,25(6):1507-1513
[3] Li H,Chen B,Yao S.Application of ultrasonic technique for extracting chlorogenic acid from Eucommia ulmodies Oliv.(E.ulmodies)[J] .Ultrasonics Sonochemistry,2005,12(4):295-300
[4] Muyonga J H,Cole C G B,Duodu K G.Characterisation of acid soluble collagen from skins of young and adult Nile perch(Lates niloticus)[J] .Food Chemistry,2004,85(1):181-189
[5] Yata M,Yoshida C,Fujisawa S,et al.Identification and characterization of molecular species of collagen in fish skin[J] .Journal of Food Science,2001,66(2):247-251
[6] Gilsenan P M,Ross-Murphy S B.Rheological characterisation of gelatins from mammalian and marine sources[J] .Food Hydrocolloids,2000,14(3):191-195
[7] Ikoma T,Kobayashi H,Tanaka J,et al.Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J] .InternationalJournalofBiologicalMacromolecules,2003,32(3/5):199-204
[8] Kittiphattanabawon P,Benjakul S,Visessanguan W,et al.Characterisation of acid-soluble collagen from skin and bone of bigeye snapper(Priacanthus tayenus)[J] .Food Chemistry,2005,89(3):363-372
[9] Nagai T,Yamashita E,Taniguchi K,et al.Isolation and characterisation of collagen from the outer skin waste material of cuttlefish(Sepia lycidas)[J] .Food Chemistry,2001,72(4):425-429
[10] Ogawa M,Portier R J,Moody M W,et al.Biochemical properties of bone and scale collagens isolated from the subtropical fish black drum(Pogonia cromis)and sheepshead seabream(Archosargus probatocephalus)[J] .Food Chemistry,2004,88(4):495-501
[11] Muyonga J H,Cole C G B,Duodu K G.Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch(Lates niloticus)[J] .Food Chemistry,2004,86(3):325-332
[12] Nagai T,Suzuki N.Isolation of collagen from fish waste materialskin,bone and fins[J] .Food Chemistry,2000,68(3):277-281
[13] Morimura S,Nagata H,Uemura Y,et al.Development of an effective process for utilization of collagen from livestock and fish waste[J] .Process Biochemistry,2002,37(12):1403-1412
[14] SaiKP,BabuM.Studies on Rana tigerina skin collagen[J] .Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,128(1):81-90
[15] Wang L,An X,Xin Z,et al.Isolation and characterization of collagen from the skin of deep-sea redfish(Sebastes mentella)[J] .Journal of Food Science,2007,72(8):450-455
[16] Plepis A M D G,Goissis G,Das G D K.Dielectric and pyroelectric characterization of anionic and native collagen[J] .Polymer Engineering and Science,1996,36(24):2932-2938
[17] Doyle B B,Bendit E G,Blout E R.Infrared spectroscopy of collagen and collagen-like polypeptides[J] .Biopolymers,1975,14(5):937-957
[18] Abe Y,Krimm S.Normal vibrations of crystalline polyglycine I[J] .Biopolymers,1972,11(9):1817-1839
[19] Payne K J,Veis A.Fourier transform IR spectroscopy of collagen and gelatin solutions:deconvolution of the amide I band for conformational studies[J] .Biopolymers,1988,27(11):1749-1760
[20] Krimm S,Bandekar J.Vibrational spectroscopy and conformation of peptides,polypeptides,and proteins[J] .Advances in Protein Chemistry,1986,38:181-364
[21] Jackson M,Choo L P,Watson P H,et al.Beware of connective tissue proteins:assignment and implications of collagen absorptions in infrared spectra of human tissues[J] .Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease,1995,1270(1):1-6
