一株对害虫具有高毒力的苏云金芽胞杆菌1)
2014-07-27谢滨姣李海涛刘荣梅林慧岩杜传英高继国
谢滨姣 李海涛 刘荣梅 林慧岩 杜传英 高继国
(东北农业大学,哈尔滨,150030)
一株对害虫具有高毒力的苏云金芽胞杆菌1)
谢滨姣 李海涛 刘荣梅 林慧岩 杜传英 高继国
(东北农业大学,哈尔滨,150030)
对来自黑龙江省哈尔滨市横头山国家森林公园的200个土壤样品进行了苏云金芽胞杆菌(Bacillusthuringiensis,Bt)的分离,获得12株菌株。经生物学多样性分析选取3株菌株进行晶体形态分析、杀虫晶体蛋白SDS-PAGE分析,并测定其室内杀虫活性。室内杀虫生物活性测定结果表明,菌株HTS-S-38对甜菜夜蛾(Spodopteraexigua)、亚洲玉米螟(Ostriniafurnacalis)的LC50分别为0.536、0.296 μg/g。经鉴定,菌株HTS-S-38含有cry1Aa、cry1Ac、cry1Ia、cry2Ab、vip3Aa杀虫基因及AiiA、chiB。菌株HTS-S-38对鳞翅目昆虫的高毒力表明其可作为生物农药工程菌的菌株基础。
苏云金芽胞杆菌;甜菜夜蛾;亚洲玉米螟;杀虫基因
Journal of Northeast Forestry University.-2014,42(7).-143~147,153
We isolated 12Bacillusthuringiensisstrains from 200 soil samples from Hengtou Mountain, nearby Harbin, in Heilongjiang Province. Three strains were selected on the spore-crystal microscopy, insecticidal crystal protein electrophoresis and insecticidal activity after the biological diversity analysis. There were globular crystal, large and small bipyramidal crystal, cubic crystal types in three Bt strains. Strain HTS-S-38 showed highly toxic againstSpodopteraexiguaandOstriniafurnacaliswith 0.536 μg/g and 0.296 μg/g of LC50, respectively. Strain HTS-S-38 containedcry1Aa,cry1Ac,cry1Ia,cry2Aa,cry2Ab,vip3Aagenes,AiiA, andchiBgenes. Strain HTS-S-38 had highly toxic against Lepidoptera, which provided a basic strain for biological pesticide Bt engineering bacteria.
KeywordsBacillusthuringiensis;Spodopteraexigua;Ostriniafurnacalis; Insecticidal gene
苏云金芽胞杆菌(Bacillusthuringiensis,Bt)是一种革兰氏阳性细菌,在《伯杰氏细菌鉴定手册》中被归属为第二类第十八群、芽胞杆菌属的一个种[1]。已有数据表明Bt可对16个目3 000多种害虫有效[2]。自1938年产业化以来,Bt成功发展为目前全球应用最广的微生物杀虫剂,在害虫的防治中起到了越来越重要的作用[3-5],尤其是它对哺乳类动物的低毒力促进了对新型菌株及杀虫基因的筛选[6]。但随着Bt生物农药及抗虫转Bt基因作物的产业化,其高效的杀虫毒力和高度的特异性对其靶标害虫造成了强大的选择压力,害虫对Bt杀虫剂抗性问题不断在实验室和田间试验中得到证实[7]。因此,筛选新型的具有高毒力、广谱的杀虫菌株,克隆新的杀虫基因成为延缓昆虫抗性的重要研究方向。目前,Bt的杀虫蛋白主要有Cry蛋白[8],Cyt蛋白[8],Vip蛋白[9-12]和Sip蛋白[13]。PCR-RFLP技术已经成为鉴定杀虫蛋白基因型最广泛的研究方法[14],不仅能检测出已知基因,还能检测出一些未知基因。除此之外,Bt还产生一些其他的活性物质,如,胞内解酯酶AiiA蛋白[15-16]、几丁质酶[17]等。横头山国家森林公园是黑龙江省哈尔滨市周边生态环境比较原始的地区,于2007年9月试营业开放,2008年1月由国家林业局批准晋升为国家级公园,同年12月被列为省级地质公园,很可能蕴藏着新的Bt资源及新型杀虫蛋白基因,因此对横头山的Bt资源的研究具有重要意义。
1 材料与方法
1.1 材料
液体LB:酵母粉0.5%,胰蛋白胨1%,NaCl 1%,pH=7.0,121 ℃高温高压灭菌20 min。固体LB:在液体培养基中加入1.3%琼脂,121 ℃高温高压灭菌20 min。液体牛肉膏蛋白胨:牛肉膏0.3%,大豆蛋白胨0.5%,pH=7.2,121 ℃高温高压灭菌20 min。限制性内切酶及连接酶购自TaKaRa公司,Taq混合酶购自康为公司,KOD高保真酶购自东洋坊公司。分析纯化学试剂均为市售。甜菜夜蛾(Spodopteraexigua)、亚洲玉米螟(Ostriniafurnacalis)和大猿叶甲(Colaphellusbowringi)为中国农科院植物保护研究所提供的标准化试虫。
1.2 方法
土样采集及菌株分离:土壤样品采集自黑龙江省哈尔滨市横头山国家森林公园。取表层下5~10 cm土壤,共采集200份土壤样品。采用温度法进行菌株的筛选[18]。
Bt基因组的提取:分离纯化后的Bt菌在固体LB培养基上30 ℃过夜培养12 h,采用张彦蕊等[19]的方法提取基因组。
Bt菌株的多样性分析:以本研究所筛的菌株基因组为模板,利用兼并引物对Fcon_1f/Fcon_5r[20]进行PCR扩增,并进一步用Hinf I对扩增产物进行酶切消化,对消化产物用2%琼脂糖凝胶进行电泳检测,分析菌种的多样性。
Bt扫描电镜样品的制备:将Bt菌株在1/2 LB平板上划线培养,30 ℃培养36 h,约50%产生晶体。收集菌体用灭菌水洗3次,12 000 r/min,离心10 min,收集芽胞和晶体的混合物。将沉淀悬浮在1 mL灭菌水中,混匀后取少量菌液均匀涂于1 cm2薄玻璃片上,晾干备用。电镜观察离子溅射喷金2 nm扫描。
庹明珠认为,“有人才有事”,要做好企业,首要解决的问题就是人的问题,他认为晟图机械的使命之一,就是让晟图机械的员工在企业这座大学里,技能不断发展,生活过得更好,而这个使命的达成就落地于企业活动、员工福利等诸多琐碎的“小确幸”之中。
Bt菌株晶体蛋白SDS-PAGE分析:取0.1 g胞晶混合物,1 mol/L NaCl洗,灭菌水反复洗3次,取处理后的样品100 μL,加入25 μL的NaOH,室温反应5 min,加入5倍Loading Buffer,混匀,ddH2O补齐体系至200 μL,100 ℃煮5 min,12 000 r/min离心5 min,吸取上清液加样,进行SDS-PAGE分析。以牛血清蛋白(BSA)为标准计算菌体的胞晶含量。采用National Institutes of Health开发的Image J分析SDS-PAGE图谱来对蛋白进行定量。
室内杀虫活性测定样品的制备:挑取单菌落于5 mL液体LB培养基中,30 ℃,220 r/min培养12 h后,转接于200 mL液体牛肉膏蛋白胨培养基中(1%接菌量),30 ℃,220 r/min,培养至裂解产生晶体(70%以上),离心收集胞晶混合物,用含有1 mol/L NaCl和2% TritionX 100的溶液悬浮洗涤沉淀2次,然后用ddH2O悬浮洗涤沉淀2次,最后溶于ddH2O或10 mmol/L Tris-HCl,用SDS-PAGE进行定量分析,-20 ℃保存。
甜菜夜蛾生物活性测定:①称取30 g人工饲料置灭菌培养皿中,加入3 mL待测样品溶液,用药匙充分搅拌均匀,室温放置,使饲料多余水分蒸发。②将全部饲料分装于3个已消毒的24孔细胞培养板中。③先将幼虫轻轻抖落在一张白纸上,再将白纸倒置,此时幼虫将从白纸上开始拉丝下滑,用毛笔轻轻挑丝将幼虫接于24孔板中,每孔1头;接完后,在24孔板上盖一层吹塑纸,再盖盖子,并用橡皮筋固定,严格密封,防止幼虫逃逸。④放置于光照培养箱中,25 ℃培养,光周期为12 h光照、12 h黑暗。从第2天起,湿度<30%时,需要额外添加水盆增加湿度。每天观察,检查光照、湿度、温度以及饲料是否霉变,是否有水蒸气凝结。⑤7 d后,分别调查死、活虫数,计算校正死亡率和LC50。
亚洲玉米螟生物活性测定:①称取15 g人工饲料放置于无菌的培养皿中。②加入待测样品溶液1.5 mL,充分搅拌混匀平均分装于3个培养皿中。③根据饲料的干湿程度室温放置一段时间,直到饲料表面没有水滴,每皿接入30头初孵幼虫,用医用胶带封口,每个浓度重复3次,共处理90头试虫。④将样品置于光照培养箱,25 ℃培养,光周期为14 h光照、10 h黑暗,每天观察饲料干湿程度,适当做出微调。⑤培养7 d后,调查死虫和活虫数,计算死亡率、校正死亡率和LC50。
大猿叶甲生物活性测定:①配置和量取10~20 mL待测样品溶液加入灭菌培养皿中,加入0.1%家用洗涤剂。②选取新鲜的油菜或小白菜叶片(大小一致),均匀地浸入待测样品溶液中,10 s。③取出后于吸水纸上室温下晾干(中间翻转1次)分装于培养皿中,培养皿中垫入无菌水喷湿的滤纸(需用锡箔纸包装灭菌)。④用毛笔轻轻接入初孵幼虫,每培养皿接30头虫,每处理重复3次。⑤放置光照培养箱中,25 ℃培养,光周期为14 h光照、10 h黑暗。每天观察,检查叶片是否腐烂或干枯,是否有水蒸气凝结。⑥48 h后,调查死、活虫数,计算校正死亡率和LC50。
数据分析:将各虫种试验数据分别计算活虫数及对应死虫数,采用POLO软件计算LC50,所有统计分析在SPSS 16.0软件中进行。
Bt菌株杀虫基因的鉴定:采用PCR-RFLP方法,对HTS-S-38菌株进行杀虫基因的鉴定,使用的引物序列见表1(表中省略了没有获得阳性克隆的引物),cry1A类基因用PvuII进行酶切鉴定[21],cry1I类基因用Hinf I进行酶切鉴定[22]。
2 结果与分析
2.1 Bt菌株的分离
从采集的200份土壤样品中分离到12株Bt菌株,出菌率为6%。12株菌株的晶体有长双锥体形、短双锥体形、立方体形、球形等多种晶体形态(表2)。
2.2 Bt菌株的多样性
对所筛的12株菌株进行了生物多样性分析,结果见图1。选定其中鉴定结果显示不同的菌株HTS-S-12、HTS-S-38、HTS-S-69进行了扫描电镜晶体形态观察(图2)、晶体蛋白SDS-PAGE分析,以及室内杀虫活性测定。

表1 用于PCR扩增的引物序列
表2 分离菌株晶体形态

M.DL2000;1.HTS-S-3;2.HTS-S-7;3.HTS-S-9;4.HTS-S-12;5.HTS-S-38;6.HTS-S-47;7.HTS-S-69;8.HTS-S-81;9.HTS-S-96;10.HTS-S-124;11.HTS-S-149;12.HTS-S-173。
图1 Bt分离菌株的生物多样性
2.3 Bt菌株晶体蛋白SDS-PAGE
通过SDS-PAGE分析菌株HTS-S-12、HTS-S-38、HTS-S-69所表达的ICPs分子质量。由图3可见,HTS-S-12表达130 ku蛋白;HTS-S-38表达130、60 ku蛋白;HTS-S-69表达130、60 ku蛋白。

①为HTS-S-12;②为HTS-S-38;③为HTS-S-69;B.双锥体形;C.方形;G.球形;Sp.芽胞。
图2 Bt菌株的油镜、扫描电镜结果

M.Marker;1.HTS-S-12;2.HTS-S-38;3.HTS-S-69。
2.4 Bt菌株晶体蛋白活性
利用10 mmol/L Tris-HCl溶液作为阴性对照,对菌株HTS-S-12、HTS-S-38、HTS-S-69进行甜菜夜蛾、亚洲玉米螟、大猿叶甲的杀虫活性初筛,测定结果见表3。初筛结果显示菌株HTS-S-38、HTS-S-69对甜菜夜蛾、玉米螟有高毒力。用这2种供试昆虫对菌株HTS-S-38进行毒力复筛,利用10 mmol/L Tris-HCl溶液作为阴性对照,设定0.187 5、0.375 0、0.750 0、1.500 0、3.000 0、6.000 0、12.000 0、24.000 0 μg/g 7个浓度测定其生物学活性。测定结果表明,菌株HTS-S-38对甜菜夜蛾的LC50为0.536 μg/g,对玉米螟的LC50为0.296 μg/g,且2种存活试虫都表现出明显体质量抑制。

表3 Bt菌株对供试昆虫毒力初筛的校正致死率 %
注:甜菜夜蛾、亚洲玉米螟、大猿叶甲的对照死亡率分别为8.33%、7.78%、3.33%。
2.5 HTS-S-38杀虫晶体蛋白基因型的PCR鉴定
对HTS-S-38杀虫晶体蛋白的基因型进行了PCR-RFLP鉴定,结果显示,该菌株中含有cry1Aa、cry1Ac、cry1Ia、cry2Ab、vip3Aa;除此之外,还含有AiiA基因和chiB基因。HTS-S-38所含的杀虫基因的PCR鉴定结果以及cry1A、cry1I类的PCR-RFLP鉴定结果见图4和图5。用PvuII酶切cry1A的PCR产物,显示cry1A的PCR产物中有cry1Aa和cry1Ac。用Hinf I酶切cry1I的PCR产物,显示cry1I的PCR产物中只含有cry1Ia。
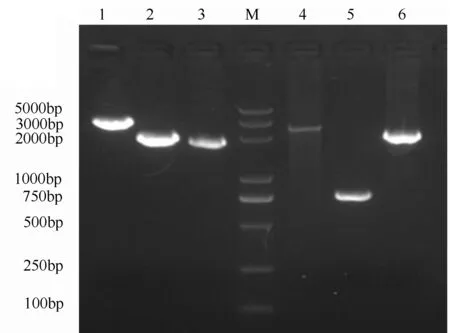
M.DM2000 plus;1.cry1A;2.cry1I;3.cry2A;4.vip3Aa;5.AiiA;6.chiB。
图4 Bt菌株HTS-S-38杀虫基因PCR鉴定
3 结论与讨论
东北农业大学植物生物化学与分子生物学课题组长期开展对东北地区新的Bt菌株资源的发掘工作,由横头山地区采集的200个土壤样品中分离出12株苏云金芽胞杆菌,出菌率为6%。其中编号为HTS-S-38的菌株对甜菜夜蛾、亚洲玉米螟表现出了较高的活性,其LC50分别是0.536、0.296 μg/g,其产生高杀虫活性的原因尚不是明确,还需要进一步的试验分析、验证。这12株菌显示出较低的菌株多样性,可能由于土样采集的密集程度、植被覆盖种类相似等原因,导致菌株的多样性与样品采集密度关系不具有代表性,在以后的研究中可采用预先设置样方统计、适当的增多采样量、扩大采样地范围、多次采集并采取不同的采集密度等方法继而总结出采样量与菌种多样性之间的代表关系,这对更有效的筛选新型Bt杀虫菌株具有重要的意义。

M.DM2000 plus;1.cry1APCR产物;2.cry1A经PvuII酶切产生的片段;3.cry1IPCR产物;4.cry1A经Hinf I酶切产生的片段。
图5 Bt菌株HTS-S-38cry1A和cry1I类杀虫基因的PCR-RFLP鉴定图谱
本研究筛选出的菌株HTS-S-38对甜菜夜蛾、亚洲玉米螟均具有较高的毒力,HTS-S-38至少含有cry1Aa、cry1Ac、cry1Ia、cry2Ab、vip3Aa5种杀虫基因,以及AiiA基因和chiB基因。大多数学者认为Cry1C蛋白和Cry1D蛋白对甜菜夜蛾有较高活性,也有学者报道Cry1Ab[23]、Vip[24]对甜菜夜蛾有较高活性。目前国外对甜菜夜蛾有较好杀虫活性的商业化杀虫剂有Agree和Xentari等,其主要是B.thuringiensissubsp.kustaki亚种HD-1等菌株所产生的Cry1类和Cry2类蛋白[25]。郭靖等[26]筛选出的Bt菌株PS3-C2对甜菜夜蛾的LC50为1.87 μg/g;武汉KN11对甜菜夜蛾的LC50为2.23 μg/g。其中PS3-C2不含有cry1A类基因,它含有cry1C、cry2A、cry9及vip3A基因。菌株HTS-S-38的PCR-RFLP及SDS-PAGE检测结果显示该生测样品的胞晶混合物中含有Cry1Aa、Cry1Ac、Cry2Ab,并不含有Cry1C、Cry1D及Vip3Aa,由此笔者推测HTS-S-38对甜菜夜蛾的高杀虫活性主要来自于Cry1Aa、Cry1Ac、Cry2Ab蛋白的协同增效。Liu等[27]指出Vip3Aa11和Vip3Aa19都对亚洲玉米螟具有低活性。李长友等[28]用大肠杆菌克隆的Cry2Ab4蛋白对甜菜夜蛾和亚洲玉米螟没有表现出杀虫活性。而Xue等[29]对亚洲玉米螟的测试结果显示Cry1Ah、Cry1Ac、Cry1Ab、Cry1Ie的LC50分别为0.05、0.41、0.23、3.50 μg/g。菌株HTS-S-38生测样品中含有Cry1Ac蛋白,但它显示的毒力却比大肠杆菌表达的Cry1Ac的活性高,由此推测菌株HTS-S-38中可能有其他杀虫蛋白对其对亚洲玉米螟的活性起了增效作用。
本研究采用NaOH溶解方法对杀虫晶体蛋白进行定量,从而推算出晶体蛋白的LC50,但由于胞晶混合物生测样品中不可能完全清除芽胞,由此推测昆虫食入芽胞后,可能发生芽胞效应。昆虫的主肠道给苏云金芽胞杆菌提供了复苏发育的媒质,新萌发的营养体分泌了其他的杀虫蛋白如Vip蛋白、几丁质酶协同增效了HTS-S-38菌株的杀虫作用。Bt的芽胞可以大大提高杀虫蛋白的毒力,帮助杀死昆虫。研究发现在纯的晶体蛋白中加入芽胞对小菜蛾的毒力提高了10倍[30],对甜菜夜蛾的毒力提高了10倍[31],对印度谷螟的毒力提高了35倍[32],对蜡螟的毒力提高了1 000倍[33]。芽胞效应的形成一部分原因是因为芽胞衣上的类似晶体蛋白物质具有辅助杀虫作用[34-36],而另一部分原因和Vip3A的存在有关。Donovan等[37]为了确定Vip3A对昆虫的毒性,将vip3A基因从Bt HD1菌株中删除,得到菌株HD1ΔVip3A,生测结果显示对小地老虎的毒性后者为前者的1/4,对甜菜夜蛾的毒性后者不足前者的1/10。HD1芽孢的加入使纯化的Cry1蛋白对甜菜夜蛾的活性增加了约600倍,表明Vip3A蛋白是杀虫活性的重要组成部分。同时发现除去了vip3Aa基因的芽胞加入到Cry蛋白中,毒力提高不明显。几丁质酶可以使Bt对甜菜夜蛾的杀虫活性提高1.8~2.4倍[38]。Arora等[39]从Bt菌株HD-1中通过离子交换和凝胶层析电泳纯化得到36 ku的几丁质酶。这种几丁质酶在生长培养基中含有几丁质时产生,甚至在葡萄糖出现时也会产生,此时表达的几丁质酶会影响Vip蛋白对斜纹夜蛾幼虫的杀虫活性。Hu等[40]将纯化的几丁质酶与Cry1Ac毒素进行生测的数据表明几丁质酶的存在能够将Cry1Ac的毒力提高1倍左右。芽胞效应可能是菌株HTS-S-38对甜菜夜蛾、玉米螟具有高毒力的主要原因,其具体的作用机制还有待进一步研究。
虽然HTS-S-38未显示出广谱的杀虫毒力,但作为具有特异高活性的Bt菌株,对于生物农药工程菌的研制及抗虫转基因作物的构建提供了菌株和基础基因资源,对延缓害虫对Bt的抗性具有积极的意义。目前HTS-S-38菌株中的大部分杀虫基因已经被克隆,将会用于进行下一步详细的杀虫蛋白的生物学活性测定以及菌株高毒力原因的分析。
[1] 布坎南R E,吉本斯N E.杰细菌鉴定手册[M].8版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-758.
[2] 关雄.苏云金芽胞杆菌研究回顾与展望[J].中国农业科技导报,2006,8(6):5-11.
[3] Lord J C. From Metchnikoff to Monsanto and beyond: the path of microbial control[J]. Journal of Invertebrate Pathology,2005,89(1):19-29.
[4] Brar S K, Verma M, Tyagi R D, et al. Recent advances in downstream processing and formulations ofBacillusthuringiensisbased biopesticides[J]. Process Biochemistry,2006,41(2):323-342.
[5] Bravo A, Likitvivatanavong S, Gill S S, et al.Bacillusthuringiensis: A story of a successful bioinsecticide[J]. Insect Biochemistry and Molecular Biology,2011,41(7):423-431.
[6] Carozzi N B, Kramer V C, Warren G W, et al. Prediction of insecticidal activity ofBacillusthuringiensisstrains by polymerase chain reaction product profiles[J]. Applied and Environmental Microbiology,1991,57(11):3057-3061.
[7] Mc Gaughey W H. Insect resistance to the biological insectidideBacillusthuringiensis[J]. Science,1985,229:193-195.
[8] Van Frankenhuyzen K. Insecticidal activity ofBacillusthuringiensiscrystal proteins[J]. Journal of Invertebrate Pathology,2009,101(1):1-16.
[9] Selvapandiyan A, Arora N, Rajagopal R, et al. Toxicity analysis of N-and C-terminus-deleted vegetative insecticidal protein fromBacillusthuringiensis[J]. Applied and Environmental Microbiology,2001,67(12):5855-5858.
[10] Beard C E, Court L, Boets A, et al. Unusually high frequency of genes encoding vegetative insecticidal proteins in an AustralianBacillusthuringiensiscollection[J]. Current Microbiology,2008,57(3):195-199.
[11] Ramasamy B, Nadarajah V D, Soong Z K, et al. A preliminary study of the bioactivity of vegetative proteins extracted from MalaysianBacillusthuringiensisisolates[J]. Tropical Biomedicine,2008,25(1):64-74.
[12] Petosa C, Collier R J, Klimpel K R, et al. Crystal structure of the anthrax toxin protective antigen[J]. Nature,1997,385:833-838.
[13] Donovan W P, Engleman J T, Donovan J C, et al. Discovery and characterization of Sip1A: A novel secreted protein fromBacillusthuringiensiswith activity against coleopteran larvae[J]. Applied Microbiology and Biotechnology,2006,72(4):713-719.
[14] 宋福平,张杰,黄大昉,等.苏云金芽孢杆菌cry基因PCR-RFLP鉴定体系的建立[J].中国农业科学,1998,31(3):13-18.
[15] Gao Mengsheng, Chen Hancai, Eberhard A, et al. Effects of AiiA-mediated quorum quenching inSinorhizobiummelilotion quorum-sensing signals, proteome patterns, and symbiotic interactions[J]. Molecular Plant-Microbe Interactions,2007,20(7):843-856.
[16] 杨梅,姚帆,黄勤清,等.不同来源的苏云金芽孢杆菌aiiA基因表达及其抗病性分析[J].应用与环境生物学报,2007,13(3):373-381.
[17] 郑爱萍,李平.细菌几丁质酶研究进展[J].中国生物工程杂志,2002,22(4):75-79.
[18] 喻子牛.苏云金芽孢杆菌[M].北京:科学出版社,1990:305-323.
[19] 张彦蕊,束长龙,宋福平,等.一种简单、快速的苏云金芽胞杆菌基因组DNA提取方法[J].生物技术通报,2012(11):197-201.
[20] 束长龙.苏云金芽胞杆菌资源多样性分析与杀虫基因发掘[D].哈尔滨:东北农业大学,2013:40-43.
[21] 刘东明.苏云金芽胞杆菌新型cry1基因克隆、表达及活性分析[D].哈尔滨:东北农业大学,2011:40-43.
[22] 赵灿.新型cry1I类基因的克隆及其晶体蛋白的改造[D].哈尔滨:东北农业大学,2012:34-35.
[23] Moar W J, Masson L, Brousseau R, et al. Toxicity toSpodopteraexiguaandTrichoplusianiof individual P1 protoxins and sporulated cultures ofBacillusthuringiensissubsp.kurstakiHD-1 and NRD-12[J]. Applied and Environmental Microbiology,1990,56(8):2480-2483.
[24] Estruch J J, Warren G W, Mullins M A, et al. Vip3A,a novelBacillusthuringiensisvegetative insecticidal protein with a wide spectrum of activities against lepidopteran insects[J]. Proceedings of the National Academy of Sciences,1996,93(11):5389-5394.
[25] Roh J Y, Choi J Y, Li Mingshun, et al.Bacillusthuringiensisas a specific, safe, and effective tool for insect pest control[J]. Journal of Microbiology and Biotechnology,2007,17(4):547-559.
[26] 郭靖,周子珊,蔡吉林,等.对甜菜夜蛾具有高毒力的Bt菌株筛选[J].植物保护,2013,39(1):8-13.
[27] Liu J, Song F, Zhang J, et al. Identification of vip3A-type genes fromBacillusthuringiensisstrains and characterization of a novel vip3A-type gene[J]. Letters in Applied Microbiology,2007,45(4):432-438.
[28] 李长友,张杰,宋福平,等.苏云金芽孢杆菌B-Pr-88菌株中cry2Ab4基因的表达和杀虫活性研究[J].生物工程学报,2007,23(4):634-638.
[29] Xue Jing, Liang Gemei, Crickmore N, et al. Cloning and characterization of a novel Cry1A toxin fromBacillusthuringiensiswith high toxicity to the Asian corn borer and other lepidopteran insects[J]. FEMS Microbiology Letters,2008,280(1):95-101.
[30] Liu Yongbiao, Tabashnik B E, Moar W J, et al. Synergism betweenBacillusthuringiensisspores and toxins against resistant and susceptible diamondback moths (Plutellaxylostella)[J]. Applied and Environmental Microbiology,1998,64(4):1385-1389.
[31] Moar W J, Trumble J T, Federici B A. Comparative toxicity of spores and crystals from the NRD-12 and HD-1 strains ofBacillusthuringiensissubsp.kurstakito neonate beet armyworm (Lepidoptera: Noctuidae)[J]. Journal of Economic Entomology,1989,82(6):1593-1603.
[32] Johnson D E, McGaughey W H. Contribution ofBacillusthuringiensisspores to toxicity of purified cry proteins towards indianmeal moth larvae[J]. Current Microbiology,1996,33(1):54-59.
[33] Li R S, Jarrett P, Burges H D. Importance of spores, crystals, andδ-endotoxins in the pathogenicity of different varieties ofBacillusthuringiensisinGalleriamellonellaandPierisbrassicae[J]. Journal of Invertebrate Pathology,1987,50(3):277-284.
[34] Aronson A I, Tyrell D J, Fitz-James P C, et al. Relationship of the syntheses of spore coat protein and parasporal crystal protein inBacillusthuringiensis[J]. Journal of Bacteriology,1982,151(1):399-410.
[35] Johnson D E, Oppert B, McGaughey W H. Spore coat protein synergizesBacillusthuringiensiscrystal toxicity for the indianmeal moth (Plodiainterpunctella)[J]. Current Microbiology,1998,36(5):278-282.
[36] Du C, Nickerson K W.BacillusthuringiensisHD-73 spores have surface-localized Cry1Ac toxin: physiological and pathogenic consequences[J]. Applied and Environmental Microbiology,1996,62(10):3722-3726.
[37] Donovan W P, Donovan J C, Engleman J T. Gene knockout demonstrates that vip3A contributes to the pathogenesis ofBacillusthuringiensistowardAgrotisipsilonandSpodopteraexigua[J]. Journal of Invertebrate Pathology,2001,78(1):45-51.
[38] Thamthiankul S, Moar W J, Miller M E, et al. Improving the insecticidal activity ofBacillusthuringiensissubsp.aizawaiagainstSpodopteraexiguaby chromosomal expression of a chitinase gene[J]. Applied Microbiology and Biotechnology,2004,65(2):183-192.
[39] Arora N, Ahmad T, Rajagopal R, et al. A constitutively expressed 36kDa exochitinase fromBacillusthuringiensisHD-1[J]. Biochemical and Biophysical Research Communications,2003,307(3):620-625.
[40] Hu S B, Liu P, Ding X Z, et al. Efficient constitutive expression of chitinase in the mother cell ofBacillusthuringiensisand its potential to enhance the toxicity of Cry1Ac protoxin[J]. Applied Microbiology and Biotechnology,2009,82(6):1157-1167.
ABacillusthuringiensisStrain with a Strong Virulence Against Pest/
Xie Binjiao, Li Haitao, Liu Rongmei, Lin Huiyan, Du Chuanying, Gao Jiguo(Northeast Agricultural University, Harbin 150030, P. R. China)//
1) 国家“863”项目(2010RCB54);国家高技术研究发展计划课题(2011AA10A203);转基因生物新品种培育科技重大专项(2014ZX0800913B-002);黑龙江省科学技术研究项目(12521021)。
谢滨姣,女,1988年8月生,东北农业大学生命科学学院,硕士研究生。
高继国,东北农业大学生命科学学院,教授。E-mail:gaojiguo1961@hotmail.com。
2014年3月4日。
S476.11
责任编辑:程 红。
