胃癌组织中跨膜丝氨酸蛋白酶4的表达及其与上皮间质转化的关系
2014-07-25孙思柏吴继锋
孙思柏,吴继锋,2
胃癌的发病机制尚不明确,其病死率居高不下的主要原因是胃癌细胞的侵袭和转移[1]。跨膜丝氨酸蛋白酶 4(TMPRSS4)是 Wallrapp et al[2]在胰腺癌中发现,并进一步发现其表达与胰腺癌细胞株的转移潜能呈正相关,从而猜测其与肿瘤的侵袭有关。上 皮 间 质 转 化 (epithelial-mesenchymal transtion,EMT)是指上皮细胞失去细胞间的黏附力、基底部的极性以及特异性蛋白的表达从而使其获得运动性、梭形细胞样改变和表达间质细胞特异性蛋白的过程,这是细胞表型的改变而并非是细胞类型的改变[3]。Jung et al[4]发现高表达的 TMPRSS4 可以诱导E-钙黏蛋白(E-cadherin)介导的细胞间的黏附力缺失,导致EMT的发生,其中包括形态学的改变、肌动蛋白的重组和间质细胞特异性蛋白表达的上调,从而增加肿瘤细胞的侵袭和转移。该研究主要通过免疫组织化学法检测胃癌组织中TMPRSS4的表达,分析其与临床病理参数间的相关性,并探讨其对判断患者预后的意义;进一步探讨TMPRSS4的表达与EMT相关蛋白 E-cadherin、波形蛋白(Vimentin)之间的关系。从而推测TMPRSS4可能通过诱导EMT从而发生肿瘤侵袭和转移的机制。
1 材料与方法
1.1 材料
1.1.1 标本来源 收集2003年1月~2005年12月安徽医科大学第一附属医院普外科胃癌手术切除标本100例,其中男64例,女36例,年龄29~76(60.32±11.65)岁;分化程度:高分化6例,中分化38例,低分化56例;肿瘤大小分级:ø<5 cm者45例,ø≥5 cm者55例;浸润深度分级:未浸润至浆膜者15例,浸润至浆膜者85例。患者均为初治病例,术前未经任何化疗及放疗,术后均经病理医师证实为胃癌。取对应癌旁组织进行自身对照,肿瘤组织及癌旁组织经4%福尔马林浸泡固定并经石蜡包埋,连续3 μm切片。所有患者临床资料完整,并对全部患者进行随访,随访截止日期为2010年12月。
1.1.2 主要试剂 兔抗人TMPRSS4(11283-1-AP)一抗购于美国Protein Tech公司;鼠抗人Vimentin(ZM-0260)一抗、鼠抗人 E-cadherin(ZM-0092)一抗、二抗试剂盒、DAB显色液均购于北京中杉金桥公司;常规免疫组化试剂、冰箱等由安徽医科大学病理实验室提供。
1.2 方法
1.2.1 免疫组化染色 对所有切片进行免疫组化染色,方法采用免疫组化SABC法,所有步骤按照说明书进行。石蜡切片经过脱蜡水化后,TMPRSS4及E-cadherin一抗采用抗原高压热修复,Vimentin一抗采用抗原微波热修复,过氧化氢灭活内源性过氧化物酶,山羊血清封闭后滴加一抗。其中Vimentin及E-cadherin稀释浓度均为1∶100,TMPRSS4的稀释浓度为1∶50。然后放入冰箱4℃过夜,滴加二抗,滴加abc复合物,DAB显色,苏木精复染。用阳性组织切片作为阳性对照,用PBS缓冲液代替一抗作为阴性对照。
1.2.2 结果判定 TMPRSS4蛋白在胃癌组织中主要定位于细胞膜上,少量定位于胞质内,E-cadherin蛋白在胃癌组织中主要定位于细胞膜和(或)细胞质内。以上两种蛋白皆以细胞质和(或)细胞膜内出现棕色或棕褐色为阳性;Vimentin以细胞质出现棕黄色或棕色为阳性。采用半定量积分法判断阳性结果[5],阳性细胞染色强度评分如下:无染色或基本无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞所占比例评分:每例随机选择5个高倍镜(×400)视野下观确定阳性细胞数,计算阳性细胞所占胃腺上皮细胞的百分率,取平均数,其中细胞阳性率<10%为0分,10% ~25%为1分,26% ~50%为2分,51% ~75%为3分,>75%为3分。两者相乘,乘积≤3分记为阴性,>3分记为阳性。
1.3 统计学处理 采用SPSS 19.0统计软件进行分析。采用χ2检验分析TMPRSS4的表达与临床病理特征之间的关系,采用Spearman等级相关分析来检验TMPRSS4与Vimentin及 E-cadherin之间的相关性,单因素生存分析采用Log-Rank检验并用Kaplan-Meier法计算生存率。
2 结果
2.1 TMPRSS4、Vimentin 及 E-cadherin 在胃癌组织中的表达 100例胃癌组织及癌旁正常组织免疫组化结果显示:TMPRSS4和E-cadherin蛋白以细胞质和(或)细胞膜内出现棕色或棕褐色为阳性,其中E-cadherin在癌旁组织中的染色程度深,而在癌组织中染色程度较弱。Vimentin以细胞质出现棕黄色或棕色为阳性,见图1。100例胃癌组织中 TMPRSS4、Vimentin 及 E-cadherin 的阳性率分别为47%、37%、45%,其对应癌旁组织中的阳性率分别为9%、4%、30%。肿瘤组织中的表达与癌旁组织差异有统计学意义(P<0.05),见表1。

图1 胃癌及癌旁正常组织中TMPRSS4、Vimentin、E-cadherin蛋白的表达 SABC×200

表1 TMPRSS4、Vimentin、E-cadherin 在胃癌及癌旁组织中的阳性表达[n(%)]
2.2 TMPRSS4的表达与临床病理特征之间的关系 TMPRSS4的表达与胃癌患者的TNM分期和淋巴结转移相关(P<0.05),而与患者的年龄、性别、肿瘤组织的大小、分化程度及浸润深度无显著相关(P >0.05),见表2。
2.3 TMPRSS4的表达与 Vimentin及E-cadherin之间的关系 100例胃癌组织中Vimentin及E-cadherin之间存在密切相关性。其中TMPRSS4与Vimentin呈正相关性(rs=0.233,P=0.020);TMPRSS4与 E-cadherin呈负相关性(rs= -0.207,P=0.038),见表 3。
2.4 TMPRSS4的表达与胃癌患者预后的关系TMPRSS4阳性患者术后5年生存率明显低于阴性患者(χ2=15.175,P <0.05),见图2。
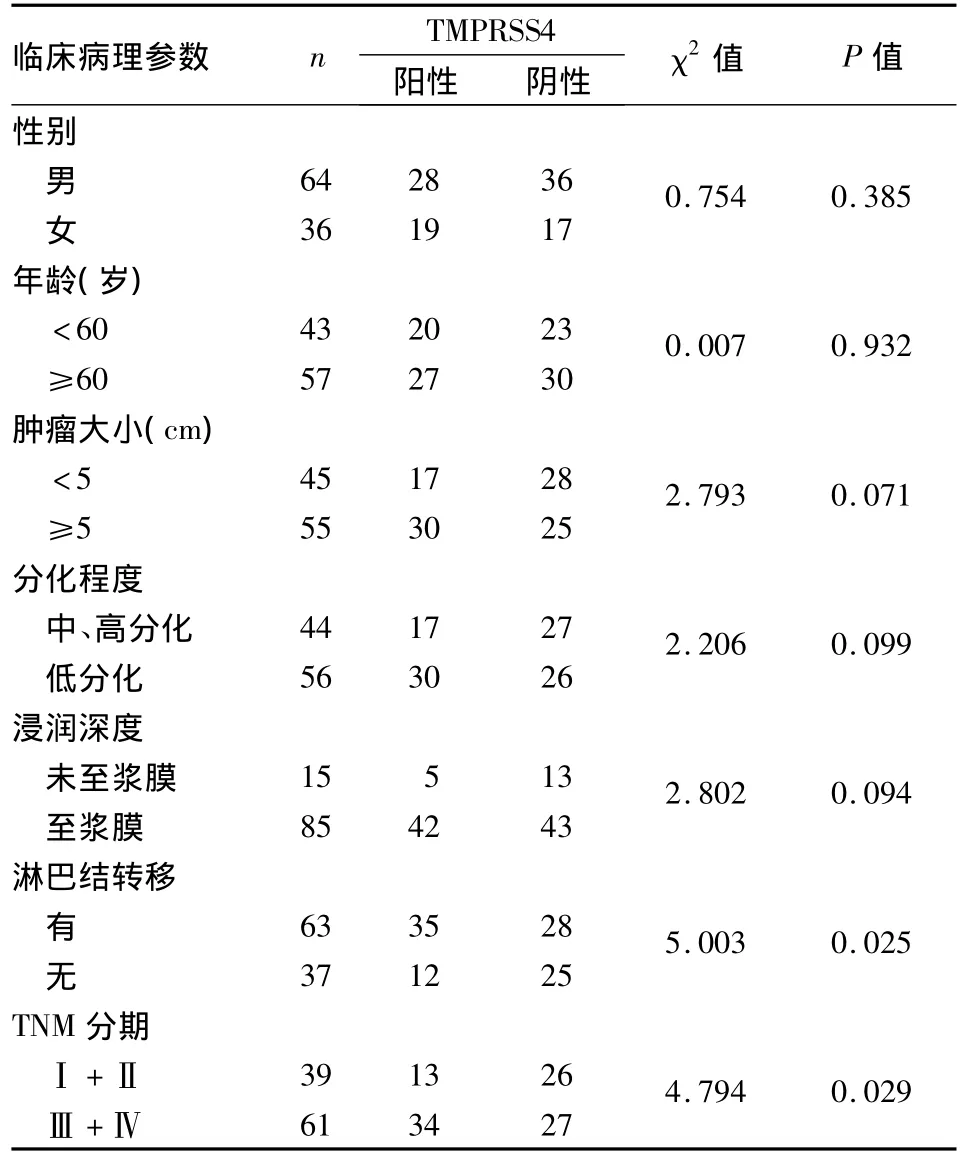
表2 TMPRSS4的表达与胃癌临床病理参数的关系

表3 胃癌组织中TMPRSS4的表达与Vimentin、E-cadherin之间的关系

图2 TMPRSS4阳性组与阴性组胃癌患者的K-M生存曲线
3 讨论
肿瘤细胞的侵袭性在肿瘤的转移过程中起着重要的作用。肿瘤细胞的侵袭是一种复杂的多相过程,包含3个步骤:细胞外基质黏附力的改变;降解细胞外基质蛋白,使肿瘤细胞从原发灶中迁移出来;肿瘤细胞直接从肿块的缝隙中迁移[6]。蛋白水解酶的失调是肿瘤发生转移的一个标志性事件,这其中丝氨酸蛋白酶是主要的蛋白水解酶之一,在肿瘤的侵袭和转移中发挥着重要的作用[7]。研究[8]表明蛋白水解酶可以促进基底细胞膜和ECM的降解以及组织的重组。所以水解酶可能涉及肿瘤发生发展的所有阶段,包括肿瘤的生长、侵袭、转移、血管发生和患者的存活时间。
丝氨酸蛋白酶家族的大部分成员一种是分泌型蛋白酶,即蛋白合成后就迅速转移至胞外;一种在胞质细胞器内贮存等待调节信号的刺激分泌释放。最近,Ⅱ型跨膜丝氨酸蛋白酶(typeⅡ transmembrane serine proteases,TTSP)被认定为丝氨酸家族的新亚型,其成员都拥有蛋白水解区域、跨膜区域、短的胞质区域和可变长度的调节结构区域[9]。Wallrapp et al[2]通过对比胰腺癌和正常胰腺组织发现TMPRSS4这一新的TTSP家族的成员,通过研究发现 TMPRSS4在胰腺癌中的表达远高于正常的胰腺组织,并且与胰腺癌细胞株转移潜能呈正相关,猜测其与肿瘤的侵袭转移有关。但是目前TMPRSS4在肿瘤中的生物学功能尚不明确。近期研究[2,4,10-12]显示TMPRSS4可在胰腺癌、甲状腺癌、肺癌、乳腺癌、结直肠癌和胃癌中表达。本实验通过免疫组化发现其在胃癌组织中的表达明显高于其对应癌旁组织。Nguyen et al[11]通过实时定量 RT-PCR、免疫组织化学法和免疫印迹法来检测肺非小细胞癌(non small cell lung cancer,NSCLC)和正常肺组织以及NSCLC细胞株 COS-1的 mRNA和蛋白表达水平。发现TMPRSS4在NSCLC中的mRNA和蛋白表达显著高于正常肺组织,但是在COS-1中TMPRSS4的mRNA呈高水平表达却没有检测到对应的蛋白高表达,而经过缺氧环境培养的COS-1细胞株却能增加TMPRSS4的蛋白表达。说明肺癌组织中的缺氧环境可能增强TMPRSS4的蛋白表达,而其mRNA的高水平并不一定能代表其蛋白也高表达。Luo et al[12]研究发现TMPRSS4在胃癌中的表达与患者的淋巴结转移和TNM分期有关,其在胃癌组织中的表达明显高于其对应癌旁组织,说明TMPRSS4与胃癌癌细胞的侵袭和转移有关,其阳性患者的五年生存率低于其阴性患者。与本实验的结论相同。此外Luo et al[12]还发现TMPRSS4的表达与胃癌患者肿块大小和浸润深度有关,并通过多元统计分析认为TMPRSS4可以独立作为胃癌预后的判断指标。本实验由于标本数量有限,未发现上述结论。
EMT是指上皮细胞受到各种刺激,失去了细胞极性,其表型向间质细胞表型转化的复杂过程[13]。EMT的研究重点在于其在恶性肿瘤演进过程中的作用。目前认为EMT的发生可以促进肿瘤细胞的侵袭与转移。在EMT的过程中,细胞的表型发生变化,与表型相关分子量也会随之改变。其中最主要的改变是E-cadherin的减少甚至丢失,这不仅被认为是癌细胞失去上皮表型的标志,也被认为是促进肿瘤转移的最主要表现。而主要由角蛋白构成的细胞骨架逐步转变为由Vimentin为主构成的细胞骨架,此外还常常出现间质表型分子数量的增加,如N-cadherin、α-平滑肌动蛋白(smooth muscle actin,SMA)等[14]。TMPRSS4的生物学功能和在肿瘤中的潜在机制还没探究清楚,但是其在上皮细胞来源的肿瘤的侵袭和转移中发挥的作用已经得到肯定。目前关于其与肿瘤细胞侵袭转移的相关研究集中于其在EMT中的发生机制上。Jung et al[4]首次在结肠癌中发现高表达的TMPRSS4可以诱导E-cadherin蛋白表达的缺失从而导致EMT的发生,其中包括形态学的改变和肌钙蛋白的重组。Kim et al[15]发现TMPRSS4可以经由整合蛋白α5的上调来激活黏着斑激酶(focal adhesin kinase,FAK)信号途径和细胞外 信 号 调 节 激 酶 (extracellular signal-regulated kinase,ERK)导致EMT和肿瘤侵袭的发生。本实验也表明TMPRSS4在胃癌中的表达与E-cadherin的表达呈负相关,而与Vimentin的表达呈正相关。该结果提示TMPRSS4可能通过诱导EMT的发生引起肿瘤细胞的转移,从而影响患者的生存时间。
综上所述,TMPRSS4可在胃癌组织中表达并与EMT之间存在密切关联,TMPRSS4可能通过诱导EMT促进胃癌组织的侵袭和转移。联合检测3种蛋白可以帮助判断胃癌的恶性程度及预后。但是关于TMPRSS4诱导EMT的发生机制尚不清楚,为此仍需进一步确定其相关分子机制从而提高胃癌的治疗效果,改善预后。
[1]Yang L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17 - 20.
[2]Wallrapp C,Hahnel S,Mttler-Pillasch F,et al.A novel trans-membrane sarine protease(TMPRSS3)overexpressed in pancreatic cancer[J].Cancer Res,2000,60(10):2602 -6.
[3]Tsuji T,Ibaragi S,Hu G F.Epithelial-mesenchymal transition and cell cooperativity in metastasis[J].Cancer Res,2009,69(18):7135-9.
[4]Jung H,Lee K P,Park S J,et al.TMPRSS4 promotes invasion,migration and metastasis of human tumor cells by facilitating an epithelial-mesenchymal transition[J].Oncogene,2008,27(18):2635-47.
[5]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(2):229 -31.
[6]Stetler-stevenson W G.The role of matrix metalloproteinases in tumor invasion,metastasis,and angiogenesis[J].Surg Oncol Clin N Am,2001,10(2):383-92.
[7]Duffy M J.Proteases as prognostic markers in cancer[J].Clin Cancer Res,1996,2(16):613 -8.
[8]List K,Bugge T H,Szabo R.Matriptase:potent proteolysis on the cell surface[J].Mol Med,2006,12(1 -3):1 -7.
[9]Hooper J D,Clements J A,Quigley J P,et al.Type II transmembrane serine proteases.Insights into an emerging class of cell surface proteolytic enzymes[J].J Biol Chem,2001,276(2):857 -60.
[10]Kebebew E,Peng M,Reiff E,et al.ECM1 and TMPRSS4 are diagnostic markers of malignant thyroid neoplasms and improve the accuracy of fine needle aspiration biopsy [J].Ann Surg,2005,242(3):353-61.
[11]Nguyen T H,Weber W,Havari E,et al.Expression of TMPRSS4 in non-small cell lung cancer and its modulation by hypoxia[J].Int J Oncol,2012,41(3):829 -38.
[12]Luo Z Y,Wang Y Y,Zhao Z S,et al.The expression of TMPRSS4 and Erk1 correlates with metastasis and poor prognosis in Chinese patients with gastric cancer[J].PLoS One,2013,8(7):e70311.
[13]Thiery J P,Acloque H,Huang R Y,et al.Epithelial-mesenchymal transition in development and disease[J].Cell,2009,139(5):871-90.
[14]Kalluri R,Weinberg R A.The basics of Epithelial-mesenchymal transition [J].J Clin Invest,2009,119(6):1420 - 8.
[15]Kim S,Kang H Y,Nam E H,et al.TMPRSS4 induces invasion and epithelial-mesenchymal transition through upregulation of integrin a5 and its signaling pathways[J].Carcinogenesis,2010,31(4):597-606.
