ADAMTS-4与TAK1在骨关节炎软骨组织中表达的相关性研究
2014-07-25张琪琪阙玉康
张琪琪,胡 勇,周 定,丁 辉,阙玉康,魏 伟
骨关节炎(osteoarthritis,OA)是一种进行性关节软骨退变性疾病,其病理特征为关节软骨破坏和关节周围骨赘的形成。聚蛋白多糖的丢失引起软骨细胞外基质(extracellular matrix,ECM)合成与分解代谢的失衡是OA软骨破坏的重要机制之一[1]。近年来研究[2]显示ADAMTS-4,即带有血小板凝血酶敏感蛋白样模体的解整链蛋白金属蛋白酶-4,在人OA的聚蛋白多糖的降解中起着主要作用。许多信号通路参与OA的发病过程,这些信号通路通过级联放大作用,导致ECM中相关蛋白酶及炎性成分变化引起软骨破坏;其中丝裂原活性蛋白激酶(mitogen activated protein kinases,MAPKs)途径和核因子-κB(nuclear factor-κB,NF-κB)途径在 OA 发病中发挥重要作用[3]。转化生长因子β激活激酶1(mitogen-activated protein kinase,TAK1)是 MAP3K 家族的成员之一,其处于这两条信号通路的上游分支点上,可被多种促炎性细胞因子激活[4]。该研究旨在探讨ADAMTS-4、TAK1在OA和正常软骨中的表达情况,了解二者在OA软骨中的发病作用及相互关系,探讨OA发病机制。
1 材料与方法
1.1 研究对象 收集2012年8月~2013年4月在安徽医科大学第一附属医院骨科二病区的住院患者。①OA组:因膝骨关节炎而行全膝关节置换术中取材的关节软骨标本,共20例(男5例,女15例),年龄49~82(65.9±9.22)岁。纳入标准:OA患者诊断符合美国风湿病学会(ACR)2001年推荐的膝关节OA诊断标准[5]。② 正常对照组:因股骨颈骨折而行全髋关节置换术或者因急性外伤致下肢截肢术中取材的软骨标本,共10例(男3例,女7例),年龄52~76(64.2±9.44)岁。纳入标准:术前X线检查关节软骨面光滑,并术后病理学诊断关节无病变。所有新鲜标本一部分以10%中性福尔马林液固定,另外一部分标本离体后置于生理盐水的标本盒中,迅速转移到-80℃冰箱保存备用。
1.2 试剂与仪器 兔抗ADAMTS-4多克隆抗体(英国Abcam公司);兔抗TAK1多克隆抗体(美国Santa Cruz公司);Elivision免疫组化两步法检测试剂盒(福建迈新公司);RIPA组织裂解液和SDSPAGE加样缓冲液(中国碧云天生物技术研究所);山羊抗兔二抗、山羊抗鼠二抗(北京中杉金桥生物技术有限公司);ECL显影液(美国Thermo公司);Bioshine ChemiQ4600荧光及化学发光成像系统(中国Bioshine公司);Motic BA600 Mot-7.5型自动显微镜(中国Motic公司)。
1.3 免疫组织化学检测ADAMTS-4、TAK1表达及分布特点
1.3.1 免疫组化步骤 福尔马林固定后的关节软骨经10%EDTA脱钙后,常规脱水,石蜡包埋,以3~4 μm厚度连续切片,制备HE及免疫组化切片。其中免疫组化操作步骤如下:65℃烤箱烤24 h,二甲苯、梯度乙醇脱蜡水化;胰酶37℃下行抗原修复30 min,滴加内源性过氧化物阻滞剂过氧化氢(H2O2)、分别滴加一抗(ADAMTS-4稀释浓度为1∶200,TAK1稀释浓度为1∶300),4℃冰箱过夜;滴加生物素标记的二抗,DAB显色,苏木精复染,乙醇脱水,二甲苯透明,封片,镜下观察。
1.3.2 免疫组化结果判断 使用 Motic BA600 Mot-7.5型自动显微镜对各组免疫组化结果进行扫描拍照,再采用Image-Pro Plus 6.0图像分析软件对各免疫组化结果图片进行积分光密度(integral optical density,IOD)检测和分析。每张切片随机选取5个高倍镜视野(×200),选取细胞质呈棕黄色颗粒的软骨细胞为阳性结果进行标记,以此自动检测所有视野的阳性结果。以参数平均积分光密度(integrated optical density average,IA)代表蛋白的颗粒密度。
1.4 Western blot法检测软骨中 ADAMTS-4、TAK1表达 在冰浴条件下,0.05 g软骨组织在499 μl RIPA组织裂解液、1 μl苯甲磺酰氟中研磨、裂解30 min。将裂解液移至1.5 ml EP管中,14 000 r/min 离心15 min,取上清液 100 μl,加入 25 μl 5 ×SDS上样缓冲液,煮沸10 min,用10%的SDS-PAGE凝胶电泳2 h,蛋白质转移至PVDF膜上,5%脱脂牛奶37℃封闭1.5 h,加入兔抗 ADAMTS-4一抗(1∶200)、兔抗TAK1一抗(1∶300)及鼠抗β-actin一抗(1∶500)孵育,4℃过夜,加入山羊抗兔标记二抗(1∶40 000)、山羊抗鼠标记二抗(1∶50 000)孵育2 h,TPBS清洗3次及PBS清洗1次后加ECL液显影,扫描仪中成像。运用Image J软件分析各组Western blot条带计算灰度值。以β-actin蛋白的灰度值为内参,计算二者比值即为灰度值比值。
1.5 统计学处理 采用SPSS 13.0统计软件进行分析,数据分析结果以±s表示,组间均数比较采用t检验,两种指标之间的关系采用Spearman秩相关性分析。
2 结果
2.1ADAMTS-4和TAK1在软骨组织中的表达HE染色结果显示:正常对照组软骨表面光滑,软骨细胞位于软骨陷窝内,逐层呈规则排列。而OA组软骨表面不平整,有裂隙,软骨细胞排列紊乱,外形不规则,可见簇集的软骨细胞和退变肥大的软骨细胞。免疫组化结果显示:在OA软骨组织中,ADAMTS-4主要表达于软骨细胞胞质内,可见大量棕黄色颗粒,细胞膜黄染,特别是固缩退变的软骨细胞更明显。而正常对照组阳性细胞数量明显减少,其表达量较低,二者比较差异有统计学意义(t=7.81,P<0.01)。TAK1在OA软骨细胞、一些炎性细胞内均有表达,细胞内可见棕黄色颗粒。在正常对照组软骨的分布部位与OA组相似,但数量明显减少,染色强度明显降低,二者比较差异有统计学意义(t=4.58,P <0.01)。见图1、2 和表1。

图1 正常对照组和OA组软骨HE染色结果 HE×200

图2 正常对照组和OA组软骨中ADAMTS-4和TAK1的表达 Elivision×200
表1 ADAMTS-4和TAK1在正常对照组及OA组软骨中的表达(IA,±s)
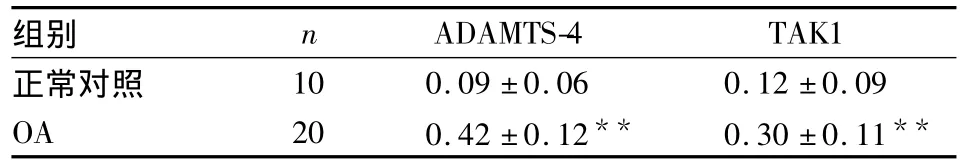
表1 ADAMTS-4和TAK1在正常对照组及OA组软骨中的表达(IA,±s)
与正常对照组比较:**P<0.01
?
Western blot法结果提示:OA患者软骨组织中ADAMTS-4表达高于正常对照组,经统计学分析,OA组与正常对照组灰度值比值比较,差异有统计学意义(t=5.27,P<0.01);TAK1在OA软骨组织中表达也高于正常对照组,经统计学分析,两组灰度值比值比较差异有统计学意义(t=6.25,P<0.01)。部分OA组和正常对照组电泳结果见图3。

图3 Western blot法检测ADAMTS-4和TAK1在正常对照组及OA组软骨中的表达
2.2ADAMTS-4和TAK1在OA软骨组织中表达的相关性分析 OA软骨中ADAMTS-4及TAK1的IA值明显高于正常对照组(P<0.01)。20例OA患者软骨组织中,TAK1阳性表达的IA值为0.30±0.11,ADAMTS-4阳性表达的IA值为0.42±0.12,经相关分析结果表明,在OA软骨组织中TAK1和ADAMTS-4的表达呈正相关(r=0.469,P<0.05)。见表1。
3 讨论
多因素造成ECM构成成分的改变引起关节软骨的退变及破坏是OA发病机制之一。而ECM主要由胶原纤维和聚蛋白多糖构成。有文献[1]报道,聚蛋白多糖使关节软骨具有很好的弹性和抗压性,聚蛋白多糖的丢失被认为在OA的发病中起着重要的启动作用。基质金属蛋白酶(matrix metalloproteinases,MMPs)能够特异性的降解关节软骨ECM中的Ⅱ型胶原、弹力纤维等,长期以来被认为在OA进展中起着重要作用[6];随着对OA发病机制的深入研究,发现早期引起软骨降解的酶是聚蛋白多糖酶,而MMPs在晚期才起作用。其中ADAMTS-4是被广泛认可,具有强大的聚蛋白多糖降解能力[7]。ADAMTS-4主要通过作用于软骨蛋白聚糖核心蛋白球间区(IGD)的蛋白水解分裂位点Glu373-Ala374发挥作用。有研究[8]显示,正常者和OA患者的软骨组织中均有ADAMTS-4表达,且在OA软骨组织中表达明显增多,此外ADAMTS-4与关节软骨破坏的程度有直接的关系,因此认为ADAMTS-4是引起人OA软骨降解的主要聚蛋白多糖酶。本研究结果表明ADAMTS-4在OA组较正常对照组高表达,阳性细胞主要分布于关节软骨浅层及中层退变软骨细胞中;提示ADAMTS-4在OA的发生发展中起着重要作用。通过特异性抑制ADAMTS-4能够有效控制OA的病情进展。
在OA病程中,白细胞介素1(interleukin-1,IL-1)、IL-6、IL-17、IL-18、肿瘤坏死因子-α(TNF-α)等是参与关节病变的主要促炎性细胞因子[9]。这些促炎性细胞因子主要是通过多条细胞内信号通路的级联放大作用导致蛋白酶、前炎症因子变化,使软骨ECM分解代谢超过合成代谢,引起关节软骨破坏。而在众多的信号转导途径中,MAPKs信号通路和NF-κB信号通路在OA发生发展中起了很重要的作用。Lea et al[10]研究发现 TAK1 是 MAPKs信号通路和骨形态蛋白(BMP)信号转导的关键调节分子并且在骨和关节发育中起着一定作用。TAK1可被上述多种促炎性细胞因子应激信号刺激所激活。在MAPKs信号通路中,激活的TAK1通过MEKK3/6、MEKK4/7调节JNK和p38蛋白激酶的活性,最终活化核转录因子激活蛋白-1(AP-1),从而引起靶基因的表达;而在NF-κB信号通路中,活化的TAK1激活NF-κB诱导激酶(NIK)和 IKB激酶(IKK),进而磷酸化IκB介导NF-κB进入细胞核内,影响目的基因的表达。
研究[11-14]显示在人软骨细胞内,NF-κB 和MAPKs可以上调由TNF-α或IL-1β介导的MMP-1、MMP-13、ADAMTS-4基因和蛋白的表达,抑制MAPK-ERK1/2活性可以降低ADAMTs和MMPs的高表达。Klatt et al[15]研究发现在OA软骨细胞中TAK1有一定的表达,抑制TAK1基因可以减少下游炎性细胞因子及相关蛋白酶的表达,TAK1对AP-1及NF-κB的活性起着更关键作用。本研究结果显示,20例OA患者TAK1表达明显高于正常对照组,且发现浅层软骨细胞呈阳性反应较多,而深层软骨细胞只有少数呈阳性反应或者未见阳性细胞。由此可以推断,TAK1作为炎症反应中MAPKs细胞信号通路和NF-κB信号通路上游重要的激酶,在OA发病中可能起着重要作用。
本研究对OA软骨组织中的ADAMTS-4和TAK1的表达进行了相关性分析,初步证实两者呈正相关,提示ADAMTS-4与TAK1在OA软骨病变的发生发展中具有协同作用,这可能与活化的TAK1具有调节ADAMTS-4表达作用有关。通过干预上游信号分子TAK1的活性,将有助于减少相关炎性细胞因子和蛋白酶类等对OA病理生理的影响,因此TAK1可以作为OA治疗的新靶点,为OA的治疗提供新的思路。
综上所述,软骨组织中ADAMTS-4和TAK1的高表达与OA的发生发展有关,活化的TAK1可能致OA软骨中ADAMTS-4的高表达。但ADAMTS-4和TAK1之间具体的相互作用机制尚不清楚,且OA是多因素作用的结果,有待进一步研究。
[1]Martel-Pelletier J,Boileau C,Pelletier J P,et al.Cartilage in normal and osteoarthritis conditions[J].Best Pract Res Clin Rheumatol,2008,22(2):351 -84.
[2]Naito S,Shiomi T,Okada A,et al.Expression of ADAMTS4(aggrecanas-1)in human osteoarthritic cartilage[J].Pathol Int,2007,57(11):703-11.
[3]Berenbaum F.Signaling transduction:target in osteoarthritis[J].Curr OpinRheum,2004,16(5):616-22.
[4]Johnson G L,Lapadat R.Mitogen-activated protein kinase pathways mediaed by ERK,JNK,and p38 protein kinases[J].Science,2002,298(5600):1911-2.
[5]陈百成,张 静.骨关节炎[M].北京:人民卫生出版社,2004:18.
[6]Takaishi H,Kimura T,Dalal S,et al.Joint diseases and matrix metallopro teinases:a role for MMP-13[J].Curr Pharm Biotech,2008,9(1):47-54.
[7]Verma P,Dalal K.ADAMTS-4 and ADAMTS-5:key enzymes in osteoarthritis[J].Cell Biochem,2011,112(12):3507-14.
[8]Yatabe T,Mochizuki S,Takizawa M,et al.Hyaluronan inhibits expression of ADAMTS4(aggrecanase-1)in human osteoarthritic chondrocytes[J].Ann Rheum Dis,2009,68(6):1051 - 8.
[9]Charles J M.Anticytokine therapy for osteoarthritis[J].Drug Aging,2010,27(2):95 -115.
[10]Lea M G,Jennifer H J,Loiselle A E,et al.TAK1 regulate’s cartilage and joint development via the MAPK and BMP signaling pathways[J].J Bone Miner Res,2010,25(8):1784 -97.
[11]Sondergaard B C,Schultz N,Madsen S H,et al.MAPKs are essential upstream signaling pathways in proteolytic cartilage degradation-divergence in pathways leading to aggrecanase and MMP-mediated articular cartilage degradation[J].Osteoarthritis Cartilage,2010,18(3):279-88.
[12]Da Silva M A,Yamada N,Clarke N M,et al.Cellular and epigenetic features of a young healthy and a young osteoarthritic cartilage compared with aged control and OA cartilage[J].J Orthop Res,2009,27(5):593 -601.
[13]Rasheed A,Judith A,Sylvester J,et al.Adaptor Proteins and Ras synergistically regulate IL-1-induced ADAMTS-4 expression in Human chondrocytes[J].J Immunol,2009,182(8):5081 -7.
[14]Prasadam I,Crawford R,Xiao Y.Aggravation of ADAMTS and matrix metalloproteinas production and role of ERK1/2 pathway in the interaction of osteoarthritic subchondral bone osteoblasts and articular cartilage chondrocytes-possible pathogenic role in osteoarthritis[J].J Rheumatol,2012,39(3):621 -34.
[15]Klatt A R,Klinger G,Neumüller O,et al.TAK1 downregulation reduces IL-1β induced expression of MMP13,MMP1 and TNF-alpha[J].Biomed Pharmacother,2006,60(2):55 -61.
