乙肝病毒HBx基因稳转细胞系的建立及其诱导的内质网应激
2014-07-25姜同翠沈玉君沈玉先方圣云
陆 鹏,姜同翠,陈 露,沈玉君,沈玉先,方圣云
乙肝病毒(hepatitis B virus,HBV)感染引起的慢性乙型肝炎被普遍认为是导致肝癌发生的重要因素。据统计,我国半数以上的肝癌患者有慢性乙肝病史。研究[1-3]显示亚洲和北美地区乙肝抗原阳性携带者罹患肝癌的比例是非感染人群的25~37倍。HBV是嗜肝DNA病毒家族的溶原性病毒,基因组呈双链环状结构,含有4个开放读码框架,分别为S、P、C、X区,其中 X区所编码的产物 HBx蛋白(hepatitis B virus X protein)是一种多功能的调节蛋白,具有广泛的反式激活功能。内质网(endoplasmic reticulum,ER)应激是真核细胞的一种保护性应激反应,是通过激活未折叠蛋白反应通路,以此来减少细胞内蛋白的异常聚集,起到细胞保护作用。近年来ER应激相关调节因子参与肿瘤的发生和发展受到广泛关注,但关于HBV病毒HBx蛋白的过度表达在肝癌的发生发展中的作用,目前仍不清楚。该实验通过克隆HBx基因并建立稳定表达HBx蛋白的肝癌细胞系,观察HBx的过度表达是否可引起ER应激及对肝癌细胞增殖活性的影响,为后续相关机制研究提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞株、菌株及质粒 人肝癌细胞株HepG2购自中国科学院上海细胞库;表达HBV全基因组的肝癌细胞株HepG2.2.15为沈继龙教授惠赠;菌株E.coli DH5α 为本实验室保存;质粒 pcDNA3.1 Vector为美国马里兰大学方圣云教授惠赠;真核表达重组质粒pcDNA3.1-HBx由本实验室构建。
1.1.2 主要试剂 DMEM培养基、opti-MEM购自美国Gibco公司;胎牛血清购自杭州四季青公司;胶回收试剂盒、质粒小量提取试剂盒购自美国Axygen公司;质粒大量提取试剂盒购自北京康为世纪生物科技有限公司;G418购自上海生工生物工程有限公司;脂质体Lipofectamine 2000购自美国Invitrogen公司;DNA连接酶、ExTaq和各种限制性内切酶购自日本TaKaRa公司;其他试剂均为国产或进口分析纯。
1.1.3 引物 引物均由上海生工生物工程有限公司合成,见表1。
1.1.4 抗体 乙型肝炎病毒X蛋白(HBxAg)抗体购自美国BBI公司。
1.2 方法
1.2.1 PCR引物设计 实验所需的引物使用Primer premier 5.0软件设计,由上海生工生物工程有限公司合成。根据GenBank上HBx基因序列设计一对引物,HBx-F包含了HindⅢ酶切位点(表1中下划线标注),引物HBx-R包含了EcoRⅠ酶切位点,见表1。
1.2.2 质粒构建 以 HepG2.2.15细胞 DNA 为模板,使用上游引物HBxF和下游引物HBxR,PCR扩增HBx序列。反应条件:95℃预变性5 min,95℃45 s,60 ℃ 45 s,72 ℃ 1 min,共 35 个循环,末次循环后72℃10 min反应结束。将PCR产物用1%琼脂糖凝胶电泳分离,用胶回收试剂盒进行纯化。将回收的PCR产物和pcDNA3.1载体分别进行双酶切,限制性内切酶为HindⅢ和EcoRⅠ。酶切后将扩增片段连接入pcDNA3.1载体并转化DH5α感受态细胞,提取质粒后再使用HindⅢ和EcoRⅠ酶切鉴定。酶切片段正确的pcDNA3.1-HBx质粒由美国Invitrogen公司测序。

表1 PCR引物序列
1.2.3 稳转细胞株的建立及HBx蛋白表达的鉴定将HepG2细胞接种到培养板上,待汇合度达80%~90%进行转染。50 μl Opti-MEM 稀释 1 μg pcDNA3.1-HBx质粒混匀,同样稀释 2 μl脂质体 lipofectamine 2000于Opti-MEM中,具体操作按说明书进行。48 h后用G418进行筛选,浓度选择0.5 g/L。同理转染pcDNA3.1空载体作对照。该细胞系生长稳定后收集细胞进行Western blot实验,用HBx抗体进行检测。
1.2.4 HBx对HepG2细胞增殖的影响 将处于对数生长期的HepG2细胞、稳转空载体的HepG2细胞、稳转HBx蛋白的HepG2细胞按1×104/孔的密度接种到96孔板里,设立不接种细胞的空白对照,每组设6个复孔,置于37℃ CO2培养箱中培养72 h后,每孔各加入100 μl MTT(5 g/L),37 ℃继续培养,4 h后终止培养。小心吸去培养液,每孔加入150 μl DMSO,测定前震荡10 min,使结晶充分溶解。以空白对照调零,于酶联免疫检测仪570 nm波长处测定各孔的光密度(optical density,OD)值。
1.2.5 HBx诱导的ER应激 选取ER应激相关基因,包括 PERK、BIP、MANF、ATF-6、XBP-1 和 CHOP,用RT-PCR方法检测其在HepG2细胞中和过表达HBx蛋白的HepG2细胞中的表达量。
1.3 统计学处理 采用SPSS 16.0统计软件分析,数据以±s表示,多组间比较采用方差分析,组间两两比较采用Dunnett’s T法,检验水准α=0.05。
2 结果
2.1 HBx基因的克隆及真核表达质粒的构建 收集培养的HepG2.2.15细胞,提取DNA,PCR扩增产物经1%的琼脂糖凝胶电泳后,在约500 bp处可见明显的扩增产物条带,见图1A,该电泳结果和理论预测值相符。将PCR产物进行EcoRⅠ和HindⅢ双酶切,然后连接到pcDNA3.1载体上以构建pcDNA3.1-HBx真核表达质粒,pcDNA3.1载体上有氨苄青霉素抗性基因(AmpR),见图2。该质粒转化DH5α,收集细菌抽提质粒,经过EcoRⅠ和HindⅢ双酶切后,在465 bp处有一条带,见图1B,与基因PCR产物的大小一致,表明目的基因已成功插入pcDNA3.1质粒中,重组表达质粒 pcDNA3.1-HBx构建成功。测得的序列在Pubmed里用BLAST检测与预期序列一致。

图1 PCR产物琼脂糖凝胶电泳及重组质粒酶切鉴定
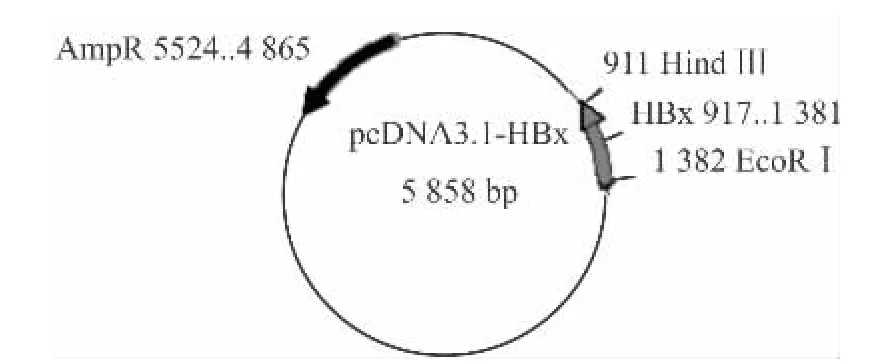
图2 质粒pcDNA3.1-HBx的图谱
2.2 HBx稳转细胞系的建立及HBx蛋白表达的鉴定 将构建的pcDNA3.1-HBx质粒转染 HepG2细胞,用G418(0.5 g/L)筛选,然后将细胞充分稀释以便克隆挑选。挑取单个克隆,见图3A,转至6孔板中培养,用G418维持筛选以建立稳转细胞系。收集细胞并提取蛋白质进行PAGE胶电泳,用抗HBx抗体检测,结果显示,转染HBx的HepG2细胞和HepG2.2.15细胞中有HBx蛋白表达,见图3B。
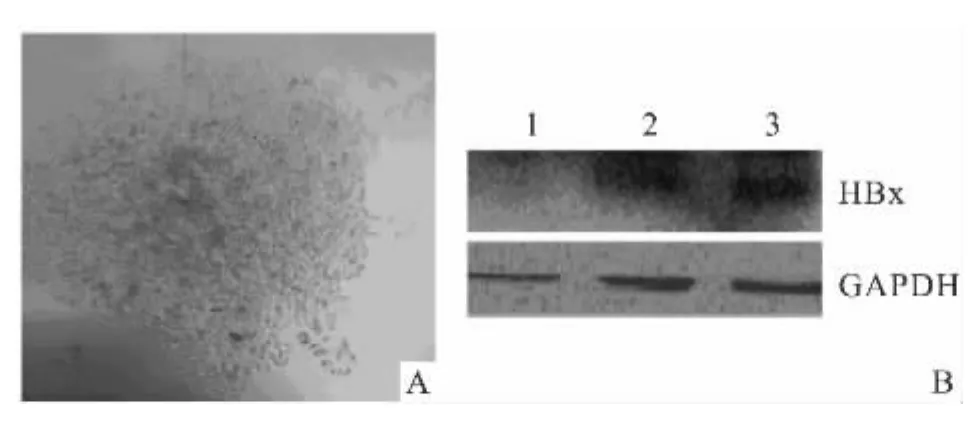
图3 HBx稳转细胞株的建立及HBx蛋白表达的鉴定
2.3 HBx的表达对HepG2细胞增殖活性的影响用MTT法对各组细胞的增殖活性进行检查,结果显示,HepG2.2.15细胞和转染空白载体的 HepG2细胞在培养72 h时,其增殖活性与HepG2细胞差异无统计学意义(P>0.05),而稳转HBx的HepG2细胞在培养72 h时其增殖活性明显高于稳转空白载体的HepG2细胞,差异有统计学意义(F=13.542,P <0.01),见图4。
2.4 HBx对ER应激相关基因表达的影响 用RT-PCR方法检测稳转细胞系中ER应激相关基因的表达情况,结果显示,稳定表达 HBx蛋白的HepG2 细胞中,BIP、PERK、ATF-6、XBP-1 和 MANF表达上调,而CHOP则表达下调,见图5。这些结果提示HBx蛋白的过表达可能引起ER应激。
3 讨论
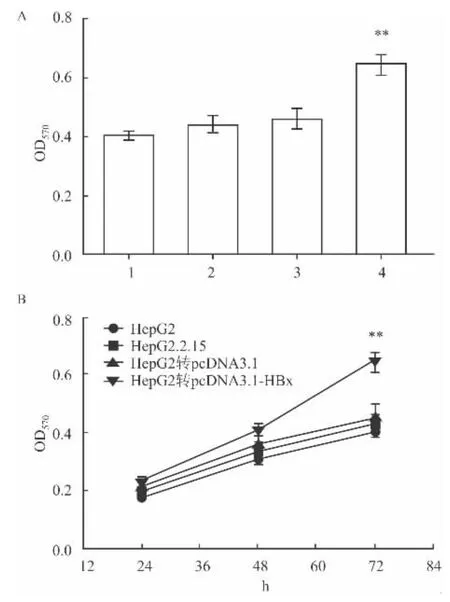
图4 HBx的表达对HepG2细胞增殖活性的影响
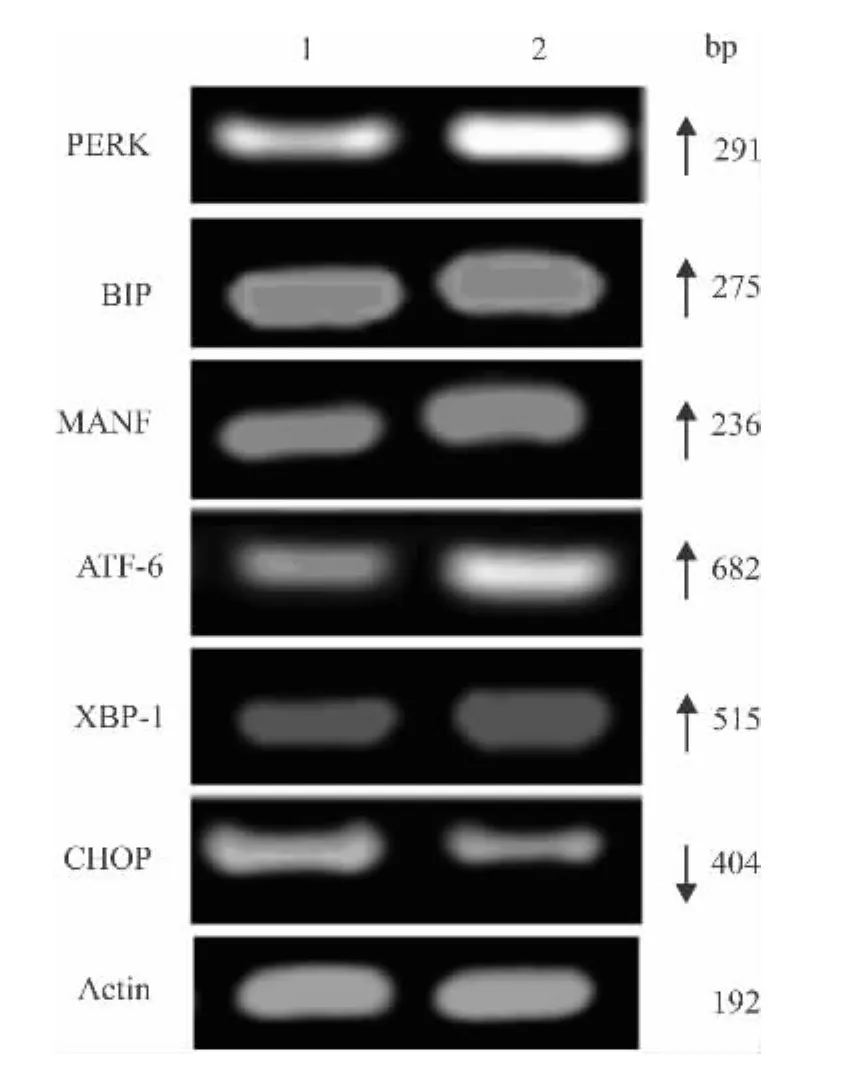
图5 HBx的表达对ER应激相关基因表达的影响
HBx蛋白在激活HBV转录调控过程中发挥重要的作用[4],其能够参与肝细胞转化,在细胞周期调控、细胞信号传导通路和DNA修复中发挥多种功能[5-7]。然而,关于HBV感染导致肝硬化和肝癌的分子机制仍存在争议,包括HBx蛋白如何促进肝硬化和肝癌的发生发展。HBV基因组编码的X蛋白被认为是肝炎病毒侵入宿主后介导HBV基因组整合和促进HBV复制过程的主要调节因子[8]。X蛋白转基因动物可发生肝癌;患者体内X蛋白的表达量与肝癌的发生呈明显的相关性;这些研究[1,8-9]结果提示X蛋白是促进肝癌发生的主要因素之一。研究[8,10]表明X蛋白在某种状况下入核,影响体内多种转录因子的活性,如 AP-1、NF-κB、STAT3 和CREB/ATF等,使得TNF、TGF-β等基因的表达发生变化,以此促进炎症向肿瘤的转化、增殖和转移。其中TGF-β被认为是促进肝脏纤维化乃至肝硬化的重要调节因子[11]。但也有研究[12]显示 HBx蛋白可以通过影响细胞凋亡蛋白酶的活性和线粒体的功能促进细胞的凋亡。
HBV表达可以诱发ER应激反应并激活IRE1-XBP1 通路[13-14]。进一步研究[15]显示,HBV 表面抗原pre-S2突变体蛋白会引起ER应激。pre-S是HBV的一种表面蛋白,其突变型可以逃避宿主免疫攻击,在ER腔内大量聚集,产生严重而持久的ER应激反应,其存在使患者发展为肝癌的概率大大增加,这也提示ER应激反应与肝癌发生之间的密切关系[16]。炎症反应、氧化应激和ER应激间会相互促进,HBV感染后引起宿主的先天免疫反应和炎症反应,其炎症细胞分泌大量的细胞因子、趋化因子、糖类或脂类代谢产物,并产生大量活性氧成分,可引起ER应激反应。而ER应激反应又可通过释放钙离子作用于线粒体促进活性氧的产生,加重炎症反应,氧化应激和炎症反应的加剧可促进正常肝细胞的恶性转化[17]。
本研究显示,HBx的过表达可促进肝癌细胞的增殖。同时也发现UPR相关基因对过表达HBx的反应性不同,HBx蛋白可引起 PERK、BIP、MANF、ATF-6和XBP-1表达升高,而使CHOP表达降低,提示HBx通过作用于不同的UPR通路介导肝细胞的损伤和促使肝细胞的恶性转化。CHOP是一个促凋亡基因,其低表达可能参与了肝癌细胞的过度增殖。至于HBx对UPR基因差异性调节的原因,可能与ER应激本身具有促增殖和促凋亡的两重性有关。由此推测ER应激及UPR通路的激活/抑制贯穿于肝炎到肝癌的全过程,各通路间可能存在平衡和补偿机制。
[1]Neuveut C,Wei Y,Buendia M A.Mechanisms of HBV-related hepatocarcinogenesis[J].J Hepatol,2010,52(4):594 -604.
[2]Hassan M M,Hwang L Y,Hatten C J,et al.Risk factors for hepatocellular carcinoma:synergism of alcohol with viral hepatitis and diabetes mellitus[J].Hepatology,2002,36(5):1206 -13.
[3]Sun C A,Wu D M,Lin C C,et al.Incidence and cofactors of hepatitis C virus-related hepatocellular carcinoma:a prospective study of 12,008 men in Taiwan[J].Am J Epidemiol,2003,157(8):674-82.
[4]Andrisani O M,Barnabas S.The transcriptional function of the hepatitis B virus X protein and its role in hepatocarcinogenesis(Review)[J].Int J Oncol,1999,15(2):373 -9.
[5]Tang H,Delgermaa L,Huang F,et al.The transcriptional transactivation function of HBx protein is important for its augmentation role in hepatitis B virus replication [J].J Virol,2005,79(9):5548-56.
[6]Bouchard M J,Schneider R J.The enigmatic X gene of hepatitis B virus[J].J Virol,2004,78(23):12725 -34.
[7]Tang H,Oishi N,Kaneko S,et al.Molecular functions and biological roles of hepatitis B virus x protein[J].Cancer Sci,2006,97(10):977-83.
[8]Kew M C.Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma[J].J Gastroenterol Hepatol,2011,26 Suppl 1:144 -52.
[9]Kim C M,Koike K,Saito I,et al.HBx gene of hepatitis B virus induces liver cancer in transgenic mice[J].Nature,1991,351(6324):317-20.
[10]Keasler V V,Hodgson A J,Madden C R,et al.Hepatitis B virus HBx protein localized to the nucleus restores HBx-deficient virus replication in HepG2 cells and in vivo in hydrodynamically-injected mice[J].Virology,2009,390(1):122 -9.
[11]Matsuzaki K.Modulation of TGF-beta signaling during progression of chronic liver diseases[J].Front Biosci,2009,14:2923 -34.
[12]Terradillos O,Pollicino T,Lecoeur H,et al.P53-independent apoptotic effects of the hepatitis B virus HBx protein in vivo and in vitro[J].Oncogene,1998,17(16):2115 -23.
[13]Christen V,Treves S,Duong F H,et al.Activation of endoplasmic reticulum stress response by hepatitis viruses up-regulates protein phosphatase 2A[J].Hepatology,2007,46(2):558 -65.
[14]Lazar C,Macovei A,Petrescu S,et al.Activation of ERAD pathway by human hepatitis B virus modulates viral and subviral particle production[J].PLoS One,2012,7(3):e34169.
[15]Hsieh Y H,Su I J,Wang H C,et al.Hepatitis B virus pre-S2 mutant surface antigen induces degradation of cyclin-dependent kinase inhibitor p27Kip1 through c-Jun activation domain-binding protein 1 [J].Mol Cancer Res,2007,5(10):1063 -72.
[16]Kim S Y,Lee P Y,Shin H J,et al.Proteomic analysis of liver tissue from HBx-transgenic mice at early stages of hepatocarcinogenesis[J].Proteomics,2009,9(22):5056 -66.
[17]Zhu H,Wang Y,Chen J,et al.Transgenic mice expressing hepatitis B virus X protein are more susceptible to carcinogen induced hepatocarcinogenesis[J].Exp Mol Pathol,2004,76(1):44 -50.
