肝癌患者血清miR-106b的表达变化及其临床意义
2014-07-25孟凡龙荚卫东许戈良李建生孙其恺
孟凡龙,荚卫东,许戈良,李建生,王 伟,孙其恺
肝细胞癌(简称肝癌)是世界范围内第五大常见肿瘤,在肿瘤相关死亡原因中居第3位[1],由于传统检查手段对肝癌的诊断效率并不令人满意,多数患者因出现症状而就诊时已失去了手术治疗的机会,导致肝癌的总体预后很差,因此寻找新的更灵敏特异的肝癌标志物具有重要意义。近来研究[2-3]显示循环miRNA在肿瘤等疾病的诊断及预后中具有重要应用价值,正成为疾病标志物研究的热点。有研究[4-5]报道 miR-106b在肝癌组织中表达升高,且与肝癌的增殖及侵袭转移相关,但其在血清中的表达情况尚未见报道。因此,该研究拟通过应用实时荧光定量 PCR(quantitative real-time polymerase chain reaction,qRT-PCR)法检测miR-106b在肝癌患者血清中的表达情况并分析其与肝癌临床病理特征的相关性,初步探讨其是否具有成为肝癌诊断及预后的标志物的可能性。
1 材料与方法
1.1 研究对象 收集2012年8月~2013年3月安徽医科大学附属省立医院收治的47例经术后病理确诊的乙肝阳性肝癌患者(肝癌组),其中男37例,女10例,年龄(55.4±10.7)岁;22例慢性乙肝或慢性乙肝后肝硬化患者(慢性肝病组),其中男17例,女5例,年龄(53.6±11.8)岁;31例各项指标均正常且自述无肿瘤相关病史的健康体检者(正常对照组),其中男24例,女7例,年龄(51.8±12.3)岁。
1.2 主要试剂与仪器 血清/血浆RNA提取试剂盒、miRNA逆转录试剂盒、miRNA SYBR Green PCR检测试剂盒及Spike-In Control试剂盒均购自德国QIAGEN公司;miR-106b特异性上游引物是根据miRBase数据库(网址 http://www.mirbase.org/)公布的序列,应用Oligo 7软件设计并由Invitrogen(美国)公司合成的,序列为5’-TAAAGTGCTGACAGTGCAGAT-3’;普通 PCR仪购自德国 Biometra公司;ABI 7500 Real Time PCR仪购自美国Applied Biosystems公司。
1.3 方法
1.3.1 血清样本的收集 采集患者清晨空腹静脉血3~4 ml,室温静置30 min充分凝结,4℃ 下3 100 r/min离心15 min,将上清液于4℃ 下13 200 r/min离心10 min去除残余细胞成分,将所获血清以300 μl/管分装后置于-80℃保存备用。
1.3.2 血清总RNA提取 从-80℃冰箱取出血清样本后迅速置于37℃水浴1 min解冻,取200 μl血清按照血清RNA提取试剂盒操作说明书提取血清总RNA,立即进行逆转录。
1.3.3 cDNA第一链合成 按照逆转录试剂盒说明书进行加尾法逆转录,反应结束后将获得的10 μl cDNA以5 μl/管分装于EP管后置于-80℃保存备用。
1.3.4 Real Time-PCR 按照 miRNA SYBR Green PCR检测试剂盒说明书操作,反应体系共20 μl,反应条件为:95℃ 15 min后,以94℃ 15 s,55℃ 30 s,70℃ 34 s进行40个循环,70℃时采集荧光信号,循环结束后绘制熔解曲线并对产物行琼脂糖凝胶电泳。每个反应均重复3次取平均值。根据文献[6]报道,以提取RNA时所加外参Cel-miR-39作为定量参照,以 2-ΔCt法计算血清中目标miRNA的相对表达量,其中ΔCt=Ct(miR-106b)-Ct(Cel-miR-39)。
1.4 统计学处理 采用SPSS 13.0软件进行分析,所有数据均以中位数(四分位数)表示,各组数据经对数转化后基本符合正态分布,多组间比较采用方差分析,进一步两两比较采用LSD检验,两组数据的比较采用独立样本t检验。采用Medcalc软件绘制血清miR-106b用于肝癌区分对照组的ROC曲线并计算曲线下面积(AUC)、敏感度及特异度。
2 结果
2.1 qRT-PCR法检测结果 所有样本均可检出Cel-miR-39及miR-106b,两种产物熔解曲线均为单峰,Tm值分别为75.75℃与75.51℃,产物琼脂糖凝胶电泳条带均位于80~100 bp,见图1。
2.2 各组血清miR-106b表达情况 肝癌组、慢性肝病组及正常对照组间血清miR-106b比较差异有统计学意义(F=25.454,P<0.01),肝癌组血清miR-106b相对表达量[5.469×10-3(3.362×10-3,11.840×10-3)]分别较正常对照组[1.572×10-3(0.698×10-3,2.634 ×10-3)]及慢性肝病组[2.430 ×10-3(1.389 ×10-3,3.974 ×10-3)]显著升高(P<0.01),慢性肝病组患者血清miR-106b相对表达量较正常对照组有升高趋势,但差异无统计学意义,见图2。
2.3 血清miR-106b表达量与肝癌临床病理特征的关系 统计分析结果显示肿瘤细胞低分化者较中高分化者血清miR-106b相对表达量高(P<0.05),有脉管侵犯者较无脉管侵犯者相对表达量高(P<0.05),TNM分期Ⅲ/Ⅳ期患者较Ⅰ/Ⅱ期患者相对表达量高(P<0.05)。而与患者年龄、性别、病灶多少、肿瘤大小及血清AFP水平均无明显相关性,见表1。

图1 qRT-PCR法检测结果
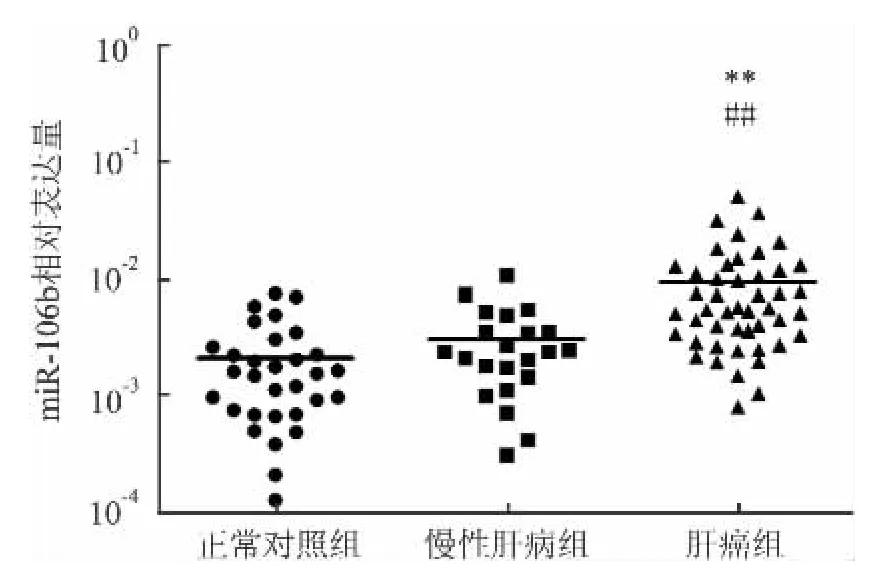
图2 血清miR-106b在各组间的相对表达量(横线代表均值)
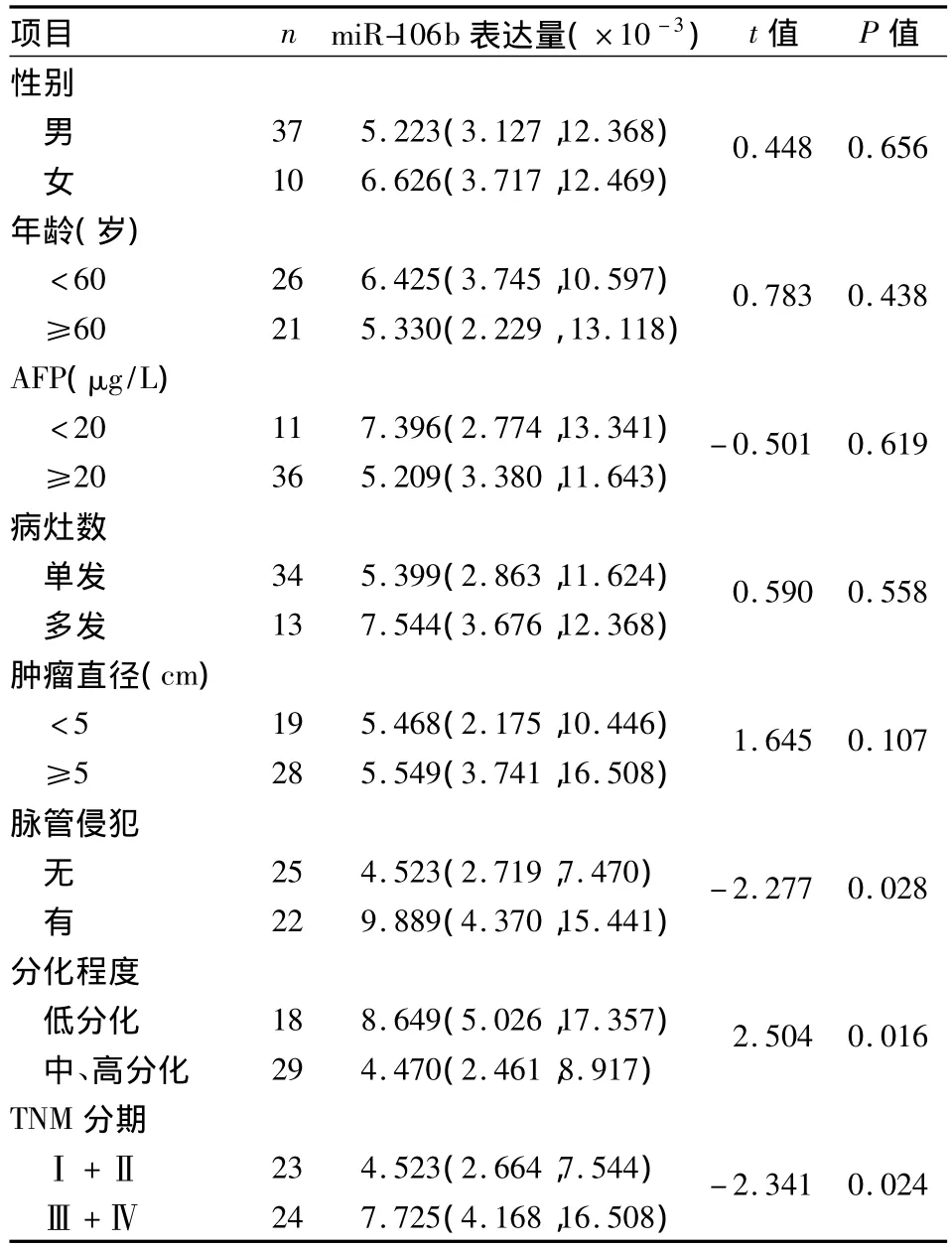
表1 肝癌患者血清miR-106b相对表达量与临床病理特征的关系
2.4 血清miR-106b的诊断价值 ROC曲线分析显示,血清miR-106b区分肝癌患者与正常人AUC为0.868(95%CI:0.773 ~0.934,P <0.01),截断值取2.262×10-3时,敏感度与特异度分别为87.2%与74.2%;血清miR-106b区分肝癌患者于慢性肝病患者的AUC为0.791(95%CI:0.676~0.880,P <0.01),截断值取3.629 ×10-3时,敏感度与特异度分别为72.3%与77.3%。血清miR-106b区分慢性肝病与正常对照的AUC值为0.654(95%CI:0.511~0.779,P <0.05),截断值取 2.067×10-3时,敏感度与特异度分别为63.6%与67.7%,见图3。
3 讨论
微小RNA(miRNA)是新发现的一类短链非编码RNA,可以对基因表达进行转录后调控,在细胞各项正常生命活动及包括肿瘤在内的各种疾病的发生发展中发挥重要调节作用。Lawrie et al[7]首次在血清中发现miRNA,之后越来越多的研究证实外周血及其他体液中含有稳定存在的miRNA,提示其可能成为理想的血清学标志物,在肿瘤等疾病的诊断及预后中具有重要的应用前景。肝癌在全球发病率高、预后差,而目前最主要的诊断标记物AFP的敏感度较低,且区分肝癌与乙型肝炎或肝硬化的能力较差,因此,探究循环miRNA在肝癌诊断及预测预后方面的应用价值正日益成为研究的热点。
miR-106b基因位于人第7号染色体长臂上,是miR-106b~93~25簇的组成部分,目前已有文献报道其在神经胶质瘤[8]、前列腺癌[9]等多种肿瘤中表达上调,提示其发挥着癌基因的作用。在肝癌方面,Shen et al[4]研究发现 miR-106b在肝癌细胞系及肝癌组织中相对于正常肝细胞及正常肝组织表达均显著升高,并可以抑制APC基因表达促进肝癌细胞的增殖。而Yau et al[5]进一步研究发现miR-106b的高表达与E-Cadherin等上皮细胞标志物的低表达及N-Cadherin等间质细胞标志物的高表达相关,提示其可能通过促使肝癌细胞发生上皮间质转化(EMT)进而促进肝癌的侵袭及转移。但上述研究均是基于肝癌组织及细胞系,miR-106b在肝癌患者血清中表达是否异常,以及其能否作为肝癌诊断及预后标志物,国内外尚未见相关报道。

图3 血清miR-106b ROC图
本研究成功检测了血清中miR-106b的表达量,实验产物各项特征均与试剂盒说明书提供的参考值一致。结果显示,血清miR-106b表达水平在肝癌患者中较正常对照组及慢性肝病组均显著升高,与之前报道在肝癌组织及细胞系中的表达情况一致。分析表明血清miR-106b在TNM分期较晚、分化程度较低及有脉管侵犯等预后不良患者中表达更高,提示其可能是患者预后的敏感指标。ROC曲线分析显示血清miR-106b用于区分肝癌与正常人时敏感度及特异度分别达到87.3%及74.2%,而文献[10]统计显示AFP诊断敏感度与特异度约为70%与89%,比较而言血清miR-106b敏感度较高,但特异度较低,而本研究显示患者AFP水平与血清miR-106b表达量之间并无相关性,提示两者在诊断肝癌方面可能存在一定互补性,进一步研究可以尝试联合检测血清miR-106b与AFP以提高诊断敏感度与特异度。值得注意的是,miR-106b在区分肝癌与慢性肝病患者时也具有较高的敏感度及特异度,提示其可用于慢性肝炎及肝硬化患者等肝癌高危人群的筛查,以提高肝癌早期诊断率。
[1]Parkin D M.Global cancer statistics in the year 2000[J].Lancet Oncol,2001,2(9):533 -43.
[2]Mitchell P S,Parkin R K,Kroh E M,et al.Circulating microRNAs as stable blood-based markers for cancer detection [J].Proc Natl Acad Sci U S A,2008,105(30):10513-8.
[3]Li J,Wang Y,Yu W,et al.Expression of serum miR-221 in human hepatocellular carcinoma and its prognostic significance[J].Biochem Biophys Res Commun,2011,406(1):70-3.
[4]Shen G,Jia H,Tai Q,et al.miR-106b downregulates adenomatous polyposis coli and promotes cell proliferation in human hepatocellular carcinoma[J].Carcinogenesis,2013,34(1):211 -9.
[5]Yau W L,Lam C S,Ng L,et al.Over-expression of miR-106b promotes cell migration and metastasis in hepatocellular carcinoma by activating epithelial-mesenchymal transition process[J].PLoS One,2013,8(3):e57882.
[6]Scheffer A R,Holdenrieder S,Kristiansen G,et al.Circulating microRNAs in serum:novel biomarkers for patients with bladder cancer[J].World J Urol,2012:Epub ahead of print.
[7]Lawrie C H,Gal S,Dunlop H M,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma[J].Br J Haematol,2008,141(5):672-5.
[8]Zhang A,Hao J,Wang K,et al.Down-regulation of miR-106b suppresses the growth of human glioma cells[J].J Neurooncol,2013,112(2):179-89.
[9]Hudson R S,Yi M,Esposito D,et al.MicroRNA-106b-25 cluster expression is associated with early disease recurrence and targets caspase-7 and focal adhesion in human prostate cancer[J].Oncogene,2013,32(35):4139 -47.
[10]Zhou Y,Yin X,Ying J,et al.Golgi protein 73 versus alpha-fetoprotein as a biomarker for hepatocellular carcinoma:a diagnostic meta-analysis[J].BMC Cancer,2012,12:17.
