膀胱尿路上皮癌中MIF与VEGF的表达及其临床意义
2014-07-25陈远哲
张 珺,吴 奎,肖 峻,陈远哲,熊 宇
巨噬细胞移动抑制因子(microphage migration inhibitor factor,MIF)主要由活化T淋巴细胞分泌,早期发现与炎症反应及免疫应答有关的细胞因子。近年来研究[1]显示,MIF在肿瘤的发生发展过程中具有重要的作用,具体表现在促进细胞的增殖、分化、肿瘤血管的形成、肿瘤侵袭能力,甚至抑制肿瘤细胞的凋亡等。实体肿瘤血管的形成是其生长和迁徙的基础,血管内皮生长因子(vascular endothelial growth factor,VEGF)是新生血管形成过程中最重要的刺激因子之一,它能够通过诱导肿瘤血管的形成促进肿瘤的浸润转移。研究[2]显示VEGF与膀胱移形细胞癌的侵袭能力有关,并可能作为判断预后的指标。该研究主要探讨MIF与VEGF在膀胱尿路上皮癌(bladder transitional cell carcinoma,BTCC)组织中的表达及其临床意义,并分析二者之间可能存在的关系。
1 材料与方法
1.1 病例资料 收集2011年2月~2012年6月在安徽医科大学附属省立医院泌尿外科接受手术治疗的BTCC患者75例,男45例,女30例,年龄16~81(58.30±22.61)岁。根据国际抗癌协会2009年第7版TNM病理临床分期和2004年WHO病理分级标准进行组织学分级和分期,其中表浅性(Ta~T1期)50例,浸润性(T2~T4期)25例。低度恶性倾向尿路上皮乳头状瘤28例,低分级BTCC 26例,高分级BTCC 21例。伴有淋巴结转移患者21例,无淋巴结转移患者54例。患者均行手术治疗,其中,经尿道膀胱肿瘤电切术47例,膀胱部分切除术24例,全膀胱术4例。另取12例正常膀胱黏膜组织作为对照组。标本取材后分两部分,一部分立即放入RNA组织保护液中,4℃过夜,-80℃保存用于RT-qPCR;另一部分经过10%甲醛溶液固定,石蜡包埋,连续切片后用于免疫组化染色。
1.2 主要试剂 抗人MIF单克隆抗体购自北京博奥森生物制药公司;抗人VEGF、CD31单克隆抗体、S-P试剂盒(含二抗、DAB显色剂)购自北京中杉金桥生物技术有限公司;荧光定量PCR检测系统购自德国 Biometra;TRIzol Reagent、RNase抑制剂、反转录酶(含 buffer)、dNTP、SYBR Green qPCR mix购自大连宝生物工程公司;引物由上海生工生物工程公司合成。
1.3 实时荧光定量PCR(RT-qPCR)检测mRNA表达 按照TRIzol说明书对所取组织进行RNA提取,并经紫外分光光度计测定A260/A280比值定量在1.8~2.0之间,以其为模板逆转录合成cDNA;MIF正向引物:5'-CCATGCCTATGTTCATCGTG-3',反向引物为5'-GAACAGCGGTGCAGGTAAGTG-3';VEGF正向引物为:5'-ACGTCTGCGGATCTTGGACA-3',反向引物为:5'-GGGCTGCTGCAATGATGAAG-3';所选内参为 β-actin,正向引物为:5'-CCAAGGCCAAC-CGCGAGAAGATGAC-3',反向引物为:5'-AGGGTACATGGTGGTGGCGCCAGAC-3';RT-qPCR总反应体系为 25 μl,SYBR Green mix 12.5 μl,正反向引物各1 μl,ddH2O 8 μl,cDNA 2.5 μl,进行扩增并采用2-ΔCT计算mRNA相对表达量。反应条件:94℃ 3 min,1 个循环;94 ℃30 s、55 ℃30 s、72 ℃1 min,40个循环。
1.4 免疫组化染色 石蜡包埋组织4 μm连续切片,常规37℃烘烤30 min,后二甲苯、乙醇脱蜡、水化,3%过氧化氢溶液浸泡10 min,阻断内源性过氧化物酶活性。VEGF采用高温抗原修复20 min,MIF、CD31采用微波枸橼酸盐抗原修复,缓慢复温至室温水洗后PBS清洗3次,每次3 min,正常血清封闭15 min后加一抗(VEGF浓度为1∶400;MIF浓度为1∶400;CD31浓度为1∶500),4℃过夜,PBS清洗3次,每次3 min。加生物素标记二抗,37℃孵育15 min,PBS洗涤3次,每次3 min;加DAB显色剂,苏木精复染,乙醇脱水,封片。用PBS代替一抗作为阴性对照组。
1.5 结果判定 RT-qPCR完成后采用2-ΔCT计算mRNA相对表达量,并计算平均表达量。MIF和VEGF阳性型号均位于胞质内,细胞质、部分细胞膜、细胞核呈棕黄色为阳性细胞,每张切片在×400高倍视野下随机选择4个视野,计数阳性细胞数。“-”为不表达或者<30%细胞表达,“+”阳性细胞数为30% ~50%,“”阳性细胞数为50% ~70%,“”阳性细胞数为>70%。微血管密度(microvascular density,MVD)计数:先在低倍镜(×100)下选择出微血管最密集的区域,然后于高倍镜(×400)下计数5个视野的微血管数目,取平均值作为该病例的MVD值。所有切片均经3位病理医师在不清楚患者任何临床资料的情况下独立完成。
1.6 统计学处理 采用SPSS 17.0统计软件分析,数据以±s表示,各指标与患者临床病理资料的关系采用独立样本t检验和χ2检验进行比较分析,各指标间的关系采用Spearman相关分析进行检测。
2 结果
2.1 MIF、VEGF mRNA的表达差异 实验结果显示MIF的PCR产物长度为368 bp,VEGF的PCR产物长度为380 bp,溶解温度较均一,峰形也较锐利。分析mRNA表达情况,其中膀胱癌组织中MIF、VEGF mRNA的平均相对表达量与正常黏膜组织比较差异均有统计学意义(P=0.002,P=0.008);浸润性癌组织中mRNA的表达量与表浅性癌组织比较差异有统计学意义(P=0.045,P=0.018),见表1。
表1 MIF、VEGF mRNA的表达(±s)
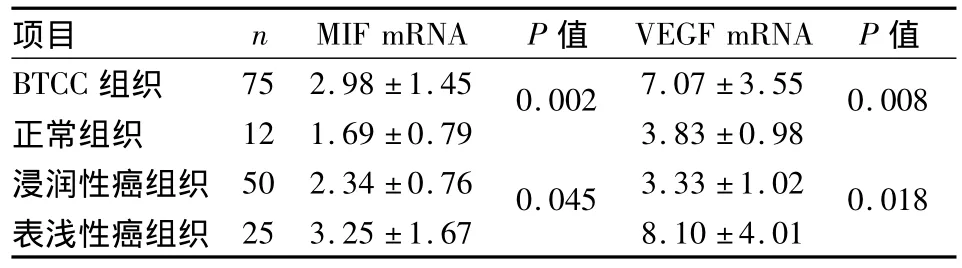
表1 MIF、VEGF mRNA的表达(±s)
?
2.2 MIF在BTCC组织中的表达 MIF阳性信号主要位于癌细胞胞质内(图1),75例BTCC组织中,53例呈阳性,MIF阳性率为70.6%。12例正常膀胱组织中MIF阳性1例,阳性率为8.3%,差异有统计学意义(P=0.000)。伴有淋巴结转移的癌组织中MIF表达水平(20/21,95.5%)与无淋巴结转移的癌组织(33/54,61.6%)比较,差异有统计学意义(P=0.004)。随着BTCC临床分期的增高,MIF阳性率呈上升趋势,在浅表性和浸润性癌组织中阳性率分别为66%、80%,差异有统计学意义(P=0.209)。随着病理分级的增加,MIF阳性率分别为G1(53.6%)、G2(73.0%)、G3(90.4%),且差异有统计学意义(P=0.018)。复发性癌组织中MIF阳性率高于初发性,差异有统计学意义(P=0.019)。MIF阳性表达率在性别、年龄、肿瘤大小及肿瘤数量的患者之间,差异无统计学意义(P>0.05),见表2。

图1 BTCC及正常膀胱黏膜组织中CD31、MIF和VEGF的表达 SP×400
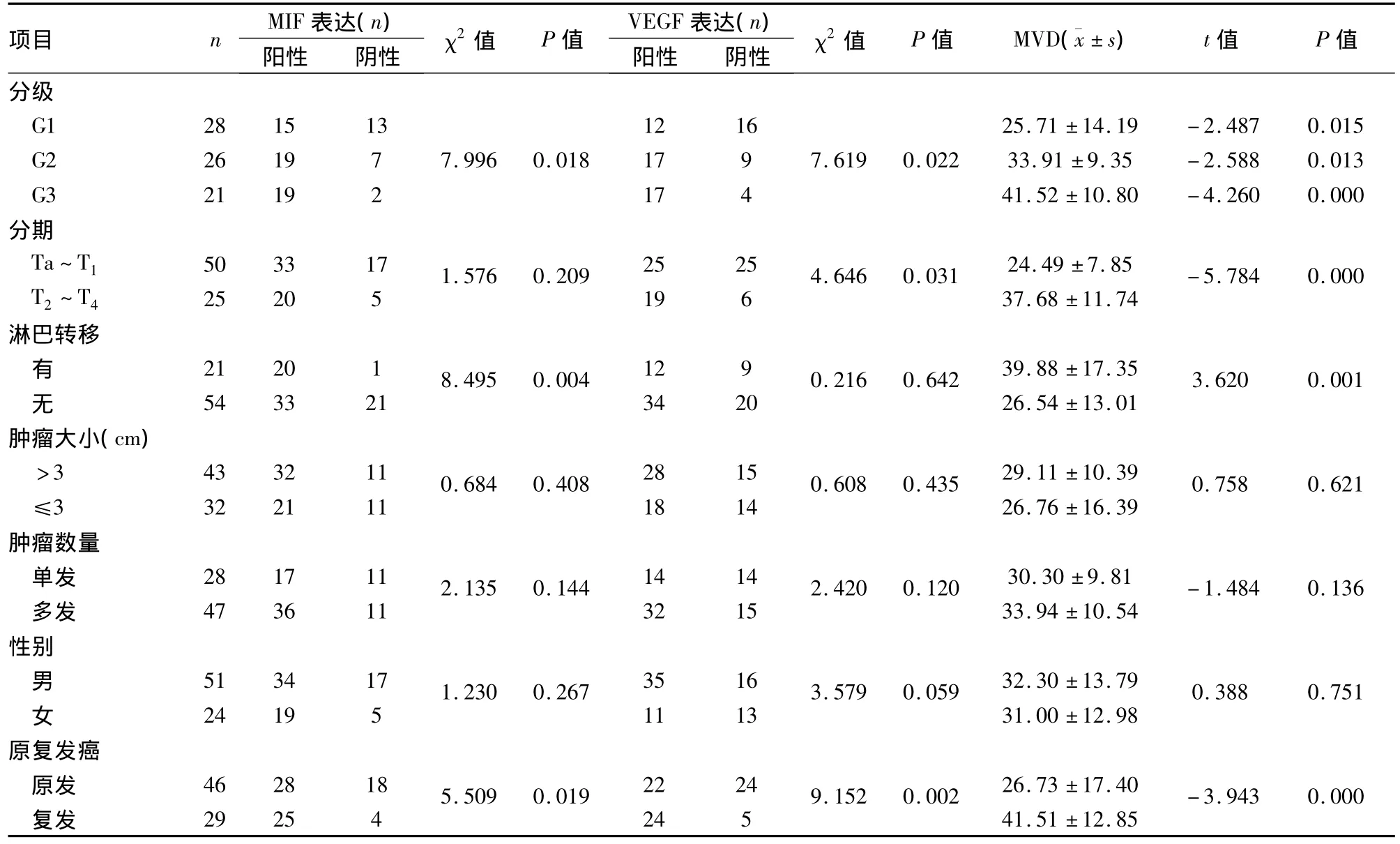
表2 MIF、VEGF表达与膀胱癌临床病理特征的关系
2.3 VEGF在BTCC组织中的表达 VEGF阳性信号主要位于癌细胞胞质中(图1),75例BTCC组织中,46例癌细胞呈阳性,MIF阳性率为61.3%。12例正常膀胱组织中均无表达,差异有统计学意义(P=0.000)。伴有淋巴结转移的癌组织中VEGF表达水平(12/21,57.1%)与无淋巴结转移的癌组织(34/54,63.0%)比较,差异无统计学意义(P=0.642)。随着BTCC临床分期的增高,VEGF阳性率呈上升趋势,在浅表性和浸润性癌组织中阳性率分别为50%、76%,差异有统计学意义(P=0.031)。随着病理分级的增加,MIF阳性率分别为 G1(42.9%)、G2(65.4%)、G3(80.9%),差异有统计学意义(P=0.022)。复发性癌组织中MIF阳性率明显高于初发性,差异有统计学意义(P=0.002)。VEGF阳性表达率在性别、年龄、肿瘤大小及数量的患者之间,差异无统计学意义(P>0.05),见表2。
2.4 MIF与VEGF的相关性 75例 BTCC组织中,两者均表达阳性的有38例,均无表达的有14例。采用Spearman秩相关分析后,两者在BTCC组织中表达呈正相关(rs=0.330,P=0.004),见表3。
2.5MIF、VEGF与MVD的关系 实验结果显示MIF、VEGF阳性例数MVD值高于阴性例数,差异有统计学意义(P=0.000,P=0.001),见表4。
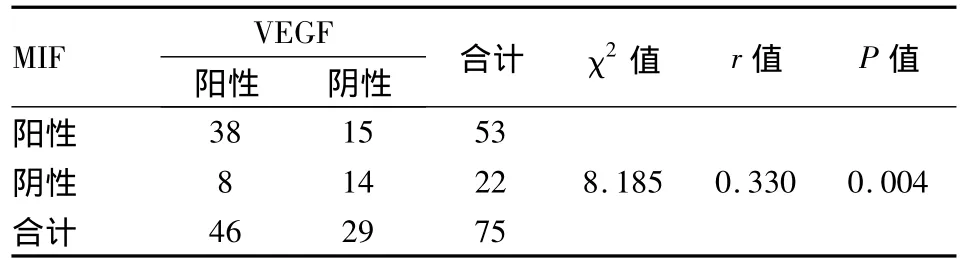
表3 MIF与VEGF在BTCC中的表达(n)
表4 MIF、VEGF与MVD的关系(±s)

表4 MIF、VEGF与MVD的关系(±s)
?
3 讨论
近年来,研究[1]表明MIF在肿瘤演变过程中发挥着重要作用,无论在肿瘤细胞增殖、分化、迁移还是肿瘤血管形成过程中都扮演着重要角色。Meyer-Siegler et al[3]发现膀胱癌细胞株 HT-1376 中存在MIF高表达现象;而通过对细胞加以外源性的MIF抗体或抑制剂后,其分泌受到抑制,同时该肿瘤细胞增殖明显减弱,这表明MIF可能在促进BTCC癌细胞的增殖过程中起重要作用。Liu et al[4]研究亦发现,MIF高表达与肿瘤的远处转移有关,经MIF抑制剂处理后肿瘤细胞的转移和侵袭能力明显降低。此外,相关研究[5-6]显示多种肿瘤中MIF的表达水平同P53蛋白、VEGF蛋白等的表达呈正相关,而这些蛋白均被认为在肿瘤的增殖、分化及血管形成等过程中扮演着重要角色。
本研究采用RT-qPCR、免疫组化方法分别检测MIF在BTCC中的表达情况,结果显示MIF在膀胱癌组织中的表达水平明显高于正常黏膜组织。通过对免疫组化染色结果进一步分析显示,MIF的表达水平在有淋巴结转移癌组织中明显高于无淋巴结转移组织,高级别明显高于低级别。这间接提示MIF蛋白在BTCC组织的生长、分化以及转移等生物学行为过程可能发挥着重要作用,高浓度的MIF有可能促进上述一系列过程的发生。目前,RT-qPCR结果显示MIF mRNA表达量在进展期癌组织中明显高于早期癌组织,而免疫组化则显示MIF蛋白表达水平与临床分期无关。因此,在BTCC组织中MIF mRNA的表达与MIF蛋白的表达并非完全一致,这一现象在许多基因中普遍存在[7]。
实体肿瘤的生长有赖于肿瘤新生血管的形成,并且肿瘤新生血管的形成也是其转移的病理生理基础。血管形成是一个非常复杂的过程,在此过程中需要诸多因素的参与,如VEGF、血管生成素、碱性成纤维生长因子(bFGF)及环氧合酶-2等,其中VEGF所扮演的角色最为重要,它能够与血管内皮特异性相结合,促进血管内皮细胞分裂增生、增强血管通透性,是作用最强的血管生成因子之一[8]。因此,其在肿瘤的生长、浸润及转移中起着重要作用。本研究RT-qPCR结果显示,癌组织中VEGF mRNA的平均表达量高于正常组织,且浸润性癌组织中mRNA平均表达量高于表浅性。免疫组化法结果显示在不同分期、分级的肿瘤组织中,VEGF的表达水平存在差异,即分化越低、分期越晚的肿瘤组织中其含量越高。且对于复发性癌组织,VEGF表达明显高于初发性,提示VEGF在BTCC复发时血管的形成和肿瘤发展同样具有重要作用;但VEGF表达水平与有无淋巴结转移无明显相关性。笔者推测,这与肿瘤细胞淋巴结转移机制相对复杂有关,单一因素并不能反映出其主要生物学特性,此外,本研究样本量相对较少也可能是影响因素之一。
在MIF表达阳性组织中,VEGF和MVD表达均明显增高,Spearman相关分析显示MIF与二者呈正相关关系。提示MIF可能促进BTCC组织中VEGF的表达,从而达到间接促进肿瘤组织微血管形成的作用。Cheng et al[6]在宫颈癌的研究中发现,MIF与其受体CD74的高表达能够增加VEGF的表达,并指出MIF在宫颈癌的肿瘤血管形成中扮演着重要的角色。Rubio et al[9]研究指出,肿瘤组织中 MVD可能成为淋巴结转移以及患者预后的一个新的指标。本研究显示MVD与淋巴结转移相关,而另一方面,MIF与淋巴结转移和微血管形成均成明显的正相关性。因此,MVD是否能够直接促进淋巴结转移尚不明确,可能为一个伴随关系,两者之间相互作用关系仍需进一步研究。
综上所述,MIF与VEGF的高表达且协同作用可能在BTCC的发生发展、浸润转移及复发方面具有重要作用,且MIF可能是影响BTCC肿瘤组织淋巴转移、微血管形成和VEGF表达的重要因素,进一步研究其作用机制可能成为BTCC分子靶向治疗中新的切入点。
[1]Babu S N,Chetal G,Kumar S.Macrophage migration inhibitory factor:a potential marker for cancer diagnosis and therapy[J].A-sian Pac J Cancer Prev,2012,13(5):1737-44.
[2]Sato K,Sasaki R,Ogura Y,et al.Expression of vascular endothelial growth factor gene and its receptor(flt-1)gene in urinary bladder cancer[J].Tohoku J Exp Med,1998,185(3):173 -84.
[3]Meyer-Siegler K L,Leifheit E C,Vera P L.Inhibition of macrophage migration inhibitory factor decreases proliferation and cytokine expression in bladder cancer cells[J].BMC Cancer,2004,4:34.
[4]Liu H,Chen G,Zhang W,et al.Overexpression of macrophage migration inhibitory factor in adenoid cystic carcinoma:correlation with enhanced metastatic potential[J].J Cancer Res Clin Oncol,2013,139(2):287-95.
[5]庞国福,李解方,丁 平,等.P53和MIF在前列腺癌组织中的表达及临床意义[J].南华大学学报,2008,36(4):452-4.
[6]Cheng R J,Deng W G,Niu C B,et al.Expression of macrophage migration inhibitory factor and CD74 in cervical squamous cell carcinoma[J].Int J Gynecol Cancer,2011,21(6):1004 -12.
[7]Ostlund G,Sonnhammer E L.Quality criteria for finding genes with high mRNA-protein expression correlation and coexpression correlation[J].Gene,2012,497(2):228 -36.
[8]Kraizer Y,Mawasi N,Seagal J,et al.Vascular endothelial growth factor and angiopoietin in liver regeneration[J].Biochem Biophvs Res Commun,2001,287(2):209 -15.
[9]Rubio L,Burgo J S,Morera C,et al.Morphometric study of tumor angiogenesis as a new prognostic factor in nasopharyngeal carcinoma patients[J].Pathol Oncol Res,2000,6(3):210 -6.
