基质金属蛋白酶-8在急性Stanford A型主动脉夹层中的表达及临床意义
2014-07-25严中亚章庆春宋晓蓉
王 峦,严中亚,章庆春,宋晓蓉
急性Stanford A型主动脉夹层是一种病情凶险、病死率极高的心血管疾病。随着生活水平提升及检测手段的增加,其发病率呈上升趋势,但其发病机制目前仍不清楚[1]。基质金属酶是一个Zn2+依赖性,参与细胞外基质降解代谢的酶家族。其在血管重塑过程中发挥重要作用[2]。研究[3]表明,在主动脉夹层中金属蛋白酶家族许多成员表达升高,而关于基质金属蛋白酶8(matrix metalloproteinase-8,MMP-8)在主动脉夹层中的相关表达报道较少。该研究分析MMP-8在实验组和对照组血浆及主动脉壁中层的表达,初步探讨其在急性Stanford A型主动脉夹层发生发展中的可能作用。
1 材料与方法
1.1 材料
1.1.1 病例资料 收集2011年8月~2013年6月安徽医科大学附属省立医院心脏外科Stanford A型主动脉夹层患者30例为实验组,其中男18例,女12例,年龄34~67(49.7±11.2)岁。选取同期住院单纯主动脉瓣病变患者30例为对照组,男16例,女14例,年龄35~74(49±11.1)岁。患者经主动脉CTA、超声心动、冠脉造影检查确诊。入选患者标准:排除胸部损伤感染、炎症、主动脉瓣二叶畸形、马凡综合征、冠心病、升主动脉内径>40 mm。以上研究对象在年龄、性别方面等均匹配,具有可比性。术前所有患者均签署知情同意书,并报我院伦理委员会批准。
1.1.2 主要试剂 ELISA试剂盒购自武汉优尔生科技股份有限公司;兔抗人MMP-8多克隆抗体购自武汉博士德生物有限公司;通用型二抗PV6000工作液购自北京中杉金桥生物技术有限公司;β-actin抗体和兔抗人MMP-8单克隆抗体均购自美国Santa Cruz公司。
1.2 实验方法
1.2.1 ELISA法检测血浆中MMP-8的含量 采集患者入院首次空腹静脉血,所有血液样本均4℃、4 000 r/min离心20 min分离血清,-80℃冰箱中保存备用。所有样本按ELISA试剂盒说明书提供的方法检测血清中MMP-8的含量。
1.2.2 HE染色 Stanford A型主动脉夹层手术标本取材方法:经右腋动脉联合右心房上下腔静脉建立体外循环。术中可见升主动脉内膜撕裂,升主动脉壁二层分离。根据主动脉瓣瓣叶受累及程度行单纯升主动脉置换(或Bentall术或David术)联合单分支覆膜支架置入术。取材位置距主动脉瓣瓣环约3 cm处,取材包括与主动脉壁撕裂部位相延续的2 cm正常血管壁组织。对照组取材相应部位的血管壁全层组织。手术标本取下后立即放入4%甲醛溶液中固定24 h后,冲洗、脱水、浸蜡、包埋,以4 μm厚度连续切片备用。HE染色:观察对照组主动脉壁的组织学形态与实验组主动脉壁的病理改变。
1.2.3 Western blot法检测主动脉夹层主动脉及正
常主动脉血管组织中MMP-8表达水平 取约5 g冻存升主动脉组织冰上裂解后煮沸5 min,于4℃、10 000 r/min离心5 min,取上清液备用。上样,聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,电转至PVDF膜上,室温下TBS洗膜5 min,膜置于含5%脱脂奶粉的TBS-T封闭1 h,TBS-T洗3次(5 min/次)。加入一抗(1∶500)4℃过夜,取出膜在TBS-T洗3次(5 min/次),加入辣根过氧化物酶耦联的二抗(1∶1 000),室温下振荡孵育1 h,室温下TBS-T洗3次(5 min/次),TBS洗1次,增强的化学发光剂显色曝光。
1.2.4 免疫组化法检测MMP-8的表达 采用免疫组化SP法,严格按照试剂盒说明书操作。烘片后脱蜡,PBS洗涤,灭除内源性过氧化物酶,滴加正常山羊血清封闭液。滴加一抗4℃过夜,PBS洗涤后加入二抗,滴加辣根酶标记链霉卵白素,DAB显色。苏木精复染,盐酸酒精分化,脱水、透明、封片、烤片、显微镜拍照。使用Nikon80i荧光显微镜及图像采集软件进行图像采集分析。400倍显微视野下分别选取10个视野,计算阳性细胞占整个视野细胞百分比。评估标准[4]:0~5%为阴性(-),6% ~25%为弱阳性(+),26% ~50%为阳性(),>50%为强阳性()。
1.3 统计学处理 采用SPSS 13.0软件包进行分析,数据以±s表示,定量变量组间差异采用t检验,定性变量组间差异采用秩和检验。
2 结果
2.1 血浆中MMP-8的含量 实验组患者血浆中MMP-8的表达[(106.51±28.27)ng/ml]明显高于对照组[(25.65±12.95)ng/ml],差异有统计学意义(P<0.05)。
2.2 升主动脉组织HE染色 实验组主动脉壁弹性纤维与胶原纤维层变性,排列杂乱无序,并伴有不同程度的炎性细胞浸润。而对照组主动脉壁结构完整,弹性纤维与胶原纤维排列紧密有序。见图1。
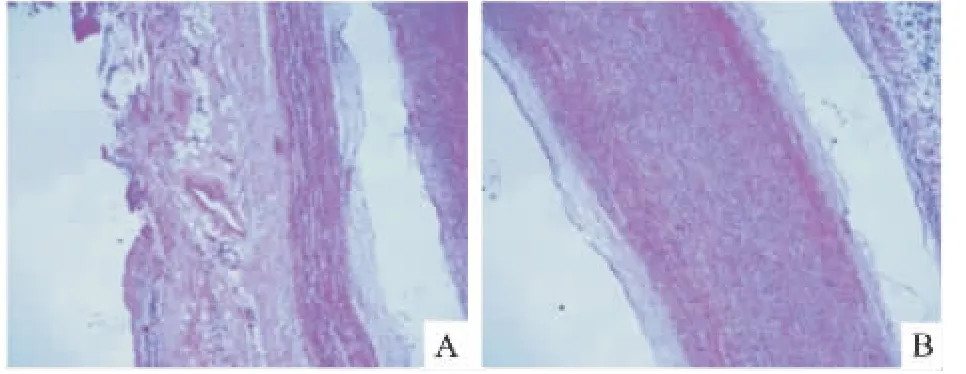
图1 升主动脉壁HE染色 ×40
2.3 MMP-8的蛋白表达
2.3.1 Western blot法检测 Western blot结果显示,MMP-8在实验组及对照组患者血管组织中均有表达,但实验组患者升主动脉中MMP-8(灰度相对值1.04±0.11)水平明显高于对照组(灰度相对值0.60±0.16),差异有统计学意义(P<0.05),见图2。

图2 MMP-8在升主动脉中的表达
2.3.2 免疫组织化学检测 免疫组化阳性表达为细胞胞质棕黄色颗粒样或片状阴影。30例主动脉夹层中有24例MMP-8阳性表达,阳性率80%,其中强阳性表达4例。病变在弹力纤维与胶原纤维变性、排列紊乱的升主动脉壁中层,MMP-8高表达,可见大量棕黄色物质呈片状分布,而在残余的正常组织内MMP-8低表达。对照组30例中4例阳性表达,阳性率13.3%,且阳性表达为弱阳性。升主动脉壁中层弹力纤维与胶原纤维排列整齐有序,MMP-8低表达或不表达,仅散在染色点。见图3。两组比较,差异有统计学意义(P<0.05),见表1。

表1 MMP-8在实验组与对照组主动脉壁中的表达(例,n=30)
3 讨论
目前研究[5]显示血流动力学因素与主动脉壁薄弱因素共同作用导致夹层的发生。升主动脉壁中层在维持主动脉力学结构中最重要,其完整性依赖于细胞外基质(extracellular matrix,ECM)合成与降解的动态平衡。升主动脉中层ECM主要由胶原纤维与弹性纤维组成,弹性纤维维持血管的扩张与收缩,胶原纤维韧性大,抗拉力强,起维持血管张力作用[6]。研究[7]显示弹性蛋白酶的减少是引起主动脉瘤形成的重要原因,而胶原蛋白酶的减少引起主动脉的破裂。报道[8]表明主动脉壁病理改变与主动脉机械性能改变的主因是ECM的改变,而MMPs是降解ECM最主要的酶,MMP-8属胶原酶,能裂解Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型间质胶原蛋白的天然螺旋结构,参与并促进主动脉中层胶原蛋白与弹性蛋白的降解。本研究表明,主动脉夹层患者升主动脉壁中层弹性纤维与胶原纤维稀疏断裂,杂乱无序,病变区MMP-8高表达。推测其可能在升主动脉夹层的发生发展中发挥作用。
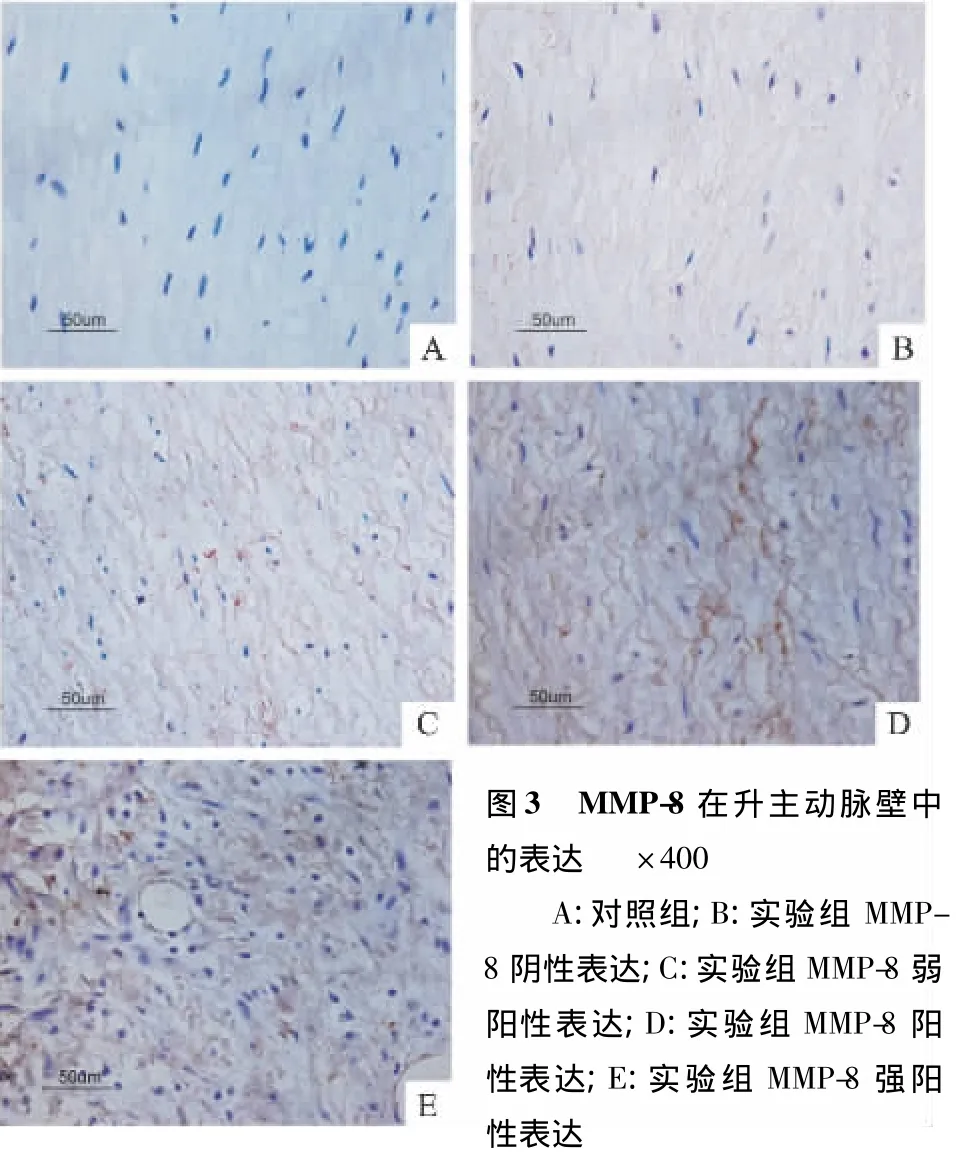
本研究中急性Stanford A型主动脉夹层患者组织切片中,24例为阳性表达,阳性率80%,其中阳性15例,强阳性4例。而30例对照组组织切片中,4例为阳性表达,阳性率13.3%,且表达为弱阳性。实验组免疫组化显示,MMP-8的强阳性表达主要集中于主动脉壁中膜,夹层撕裂边缘。主动脉壁中Ⅰ型胶原蛋白的含量远高于其他型,且MMP-8降解Ⅰ型胶原蛋白的能力是最强的[9]。各种病理因素作用下MMP-8表达增加,活性增强,导致主动脉壁中层胶原纤维与弹性纤维降解增加,使主动脉壁纤维网络受损,抗张力下降,主动脉发生中层退行性变或囊性坏死,升主动脉血管结构完整性受损,在高压、高速的血流冲击下,夹层发生易感性增加。根据本实验结果,MMP-8在病变升主动脉中膜层表达明显升高,且其高表达处胶原纤维与弹性纤维破坏严重,杂乱无序。由此推测MMP-8的含量升高与升主动脉结构的破坏存在相关性。Rahkonen et al[10]认为摘除小鼠调控Ⅰ型胶原纤维生长的Collal基因,小鼠主动脉夹层的发生率上升。也与本研究观点一致。MMP-8不仅作用于ECM还可以通过活化MMP-2、MMP-3及MMP-9等其他蛋白,加速ECM的降解[11]。而对照组中MMP-8不表达或仅有少量表达,则反映生理状态下,MMP/TIMPs(金属蛋白酶组织抑制因子)存在平衡。本实验显示实验组患者血清中MMP-8水平明显高于对照组。MMP-8在主动脉患者血浆中表达增高,其也可以作为急性Stanford A型主动脉夹层诊断的一个指标因子。
综上所述,主动脉夹层患者血清及主动脉壁中MMP-8的表达升高,此种改变直接影响ECM的结构改变。因此推测MMP-8可作为急性Stanford A型主动脉夹层诊断的一个指标,而MMP-8特异性抑制剂可能有助于修复或保持升主动脉中层结构完整性,对于升主动脉增宽的患者,可预防主动脉病或夹层的形成,具有一定的临床意义。
[1]Nienaber C A,Eagle K A.Aortic dissection:new frontiers in diagnosis and management:partⅠ:from etiology to diagnostic strategies[J].Circulation,2003,108(5):628 -35.
[2]Zhang X,Shen Y H,Lemaire S A.Thoracic aortic dissection:are matrix metalloproteinases involved?[J].Vascular,2009,17(3):147-57.
[3]魏 涛,洪 涛,胡朝晖,等.急性升主动脉夹层基质金属蛋白酶-9的表达和血管平滑肌细胞病变[J].中华胸心血管外科杂志,2010,26(3):176 -9.
[4]Liu L K,Jiang X Y,Zhou X X,et al.Upregulation of vimentin and aberrant expression of E-cadherin/beta-catenin complex in oral squamous cell carcinomas:correlation with the clinicopathological features and patient outcome [J].Mod Pathol,2010,23(2):213-24.
[5]Khalil A,Helmy T,Porembka D T,et al.Aortic pathology:aortic trauma,debris,dissection,and aneurysm[J].Crit Care Med,2007,35(8 Suppl):S392-400.
[6]林吉进,罗建方,黄文晖,等.基质金属蛋白酶13在主动脉夹层患者表达水平研究[J].岭南心血管病杂志,2010,16(3):193 -4,203.
[7]杨守国,王春生,陈 昊,等.胸主动脉夹层动脉壁TGF-β1表达与细胞外基质分布[J].中华胸心血管外科杂志,2010,26(1):33-6.
[8]Barbetseas J,Alexopoulos N,Brili S,et al.Atherosclerosis of the aorta in patients with acute thoracic aortic dissection[J].Circ J,2008,72(11):1773-6.
[9]许 飙,李 云,吴海卫,等.基质金属蛋白酶-1、-8、-13在急性胸主动脉夹层中的表达及意义[J].医学研究生学报,2010,23(8):848-51.
[10]Rahkonen O,Su M,Hakovirta H,et al.Mice with a deletion in the first intron of the Collal gene develop age-dependent aortic dissection and rupture[J].Circ Res,2004,94(1):83 - 90.
[11]Sukhova G K,Schonbeck U,Rabkin E,et al.Evidence for increased collagenolysis by interstitial collagenasas-1 and-3 in vulnerable human atheromatous plaques[J].Circulation,1999,99(19):2503-9.
