基于核磁共振的甲状腺乳头状癌患者血浆的代谢组学研究
2014-07-13阿布都沙拉木阿布力艾力赛丁哈力木拉提木尔扎提热娜米吉提阿布来提麦麦提艾力夏米西努尔伊力克
阿布都沙拉木·阿布力, 艾力·赛丁, 哈力木拉提·木尔扎提, 热娜·米吉提,阿布来提·麦麦提艾力, 夏米西努尔·伊力克
(1新疆医科大学基础医学院生物学教研室, 乌鲁木齐 830011; 2新疆维吾尔自治区人民医院乳腺甲状腺外科, 乌鲁木齐 830001;新疆医科大学3第一附属医院甲状腺外科, 乌鲁木齐 830054; 4第二附属医院核医学科, 乌鲁木齐 830028)
甲状腺癌(thyroid carcinoma, TC) 是指甲状腺组织的癌变,约占全身肿瘤的2%[1]。近年甲状腺癌在全球发病率有逐年上升的趋势,美国每年诊断的分化型甲状腺癌(differentiated thyroid carcinoma,DTC)为23 500 例,年发病率逐渐增加,主要是乳头状甲状腺癌发病率增加[2-3]。甲状腺癌分为甲状腺乳头状癌(PTC)、甲状腺滤泡状癌和甲状腺髓样癌等,其中PTC最为常见,占65%~75%,容易导致声音嘶哑、吞咽困难、咳嗽、咯血等并发症,严重影响患者的生命健康,因而需要加强对甲状腺癌的诊断和治疗[4]。临床上术前诊断甲状腺癌主要的方法是常规的细针穿刺(FNA) 分析,此方法被认为是最准确、经济有效的诊断方法,但还有30%的病例不能明确诊断[5],使得很多患者遭受不必要的手术,从而无法真正实现癌症早期准确诊断。临床上需要找到更为敏感、可靠的诊断方法和肿瘤标记物,以便于做出早期诊断。代谢组学是转录组学和蛋白质组学之后发展起来的新兴组学。其着重研究肿瘤诊断、肿瘤分级、肿瘤复发诊断等方面[6-9]。代谢组学有独特的优势,其从代谢物层面来探究生命活动,反映已经发生的生物学事件,其可通过研究生物样品内代谢物的水平及变化,了解不同生物系统的复杂生理及病理状况[10-13]。
核磁共振技术在代谢组学研究方法中具有使用广泛、检测谱广、方法简便及对样品进行快速、无创、无偏向性分析等优点[14]。本研究采用核磁共振氢谱(1H-NMR)法检测甲状腺乳头状癌患者和健康人血浆中的代谢物,比较分析两组血浆差异性代谢物。同时利用最小二乘判别分析(OPLS-DA)对NMR谱数据进行模式识别分析,鉴别两组受试者,并分析对鉴别两组受试者有帮助的代谢标志物,以期作为早期诊断甲状腺乳头状癌的一种方式。
1 材料与方法
1.1试剂与仪器Inova600型核磁共振波谱仪(美国Varian公司),电子天平(北京赛多克斯天平有限公司),低温超速离心机(美国Beckman公司),低温冰箱(中国海尔公司),核磁管(美国 Wilmad Lab Glass公司),重水(美国Sigma公司),NaCl,K2HPO4,NaH2PO4,蒸馏水。
1.2样品收集收集2012年11月-2013年8月新疆医科大学第一、第二附属医院和新疆维吾尔自治区人民医院31例甲状腺乳头状癌患者(甲状腺乳头状癌组)和29例健康人(健康对照组)血液样品。2 h内4℃、10 000 r/min离心15 min,取上清液(血浆),置-80℃冰箱保存待用。
1.3样品预处理将-80℃冰箱里的血浆放置室温自行融化,随后取200 μL放入1.5 mL的 EP管,再加400 μL重水配置的缓冲液(0.045 M NaH2PO4+0.045 M K2HPO4+NaCl溶于20%重水+80%蒸馏水)后混合,以10 000 r/min离心10 min后取上清550 μL灌入5 mL的核磁管,放入4℃冰箱待用。
1.4核磁共振实验在核磁共振波谱仪上调整脉冲序列对样品进行测定。采用预饱和方式抑制水峰信号,饱和时间为2 s, 谱宽10 000 Hz, 采样点数32 768 k, 扫描次数为128次, 每次扫描时间为1.638 s, 实验温度25.0℃。选取一维氢谱质量较高的样品进行二维谱测试,
1.5谱图预处理采用TOPSPIN2.0 软件对谱图进行手动基线调整,所有样品谱图的α-葡萄糖左峰作为标准进行定标,谱图中的位置设为5.233。对所有谱图进行自动积分,积分区间设为0.003 ppm。将处理后的数据导入Exel文件中,取出4.680~5.202 ppm的抑制水峰引起谱图差异的数据。为了消除不同浓度的样品所致的误差,对剩下的所有数据进行归一化处理。
1.6模式识别分析采用SIMCA-P 软件对两组血浆的核磁共振实验数据进行最小二乘判别分析(Orthogonal Partial Least-Squares Discriminate Analysis, OPLS-DA),得到两组样品相应的散点图和三维图。
1.7统计学处理为了分析甲状腺乳头状癌组血浆与健康对照组血浆样品的特异性代谢物,采用PCA方法对样品的数据进行统计分析。通过OPLS-DA获得的每一个积分段所代表的代谢物相关系数(r)来确定各组人血浆中有差异性的代谢成分,检验水准α=0.05。本研究中,根据皮尔森相关系数显著性差异检测,确定|r|值>0.349(样品数n=30)所代表的代谢物是有差异性(P<0.05)的代谢物,临界值|r|值越大表示差异性越大,反之越小。与健康对照组相比,差异性代谢物中相关系数为正值的代谢物是在甲状腺乳头状癌组血浆中含量增高的代谢物,相关系数为负值的代谢物是在甲状腺乳头状癌组血浆中含量降低的代谢物。
2 结果
2.1两组血浆样品的1H-NMR分析结果甲状腺乳头状癌组血浆与健康对照组血浆样品1H-NMR谱图所示的1~26为有差异的26种代谢物(图1)。
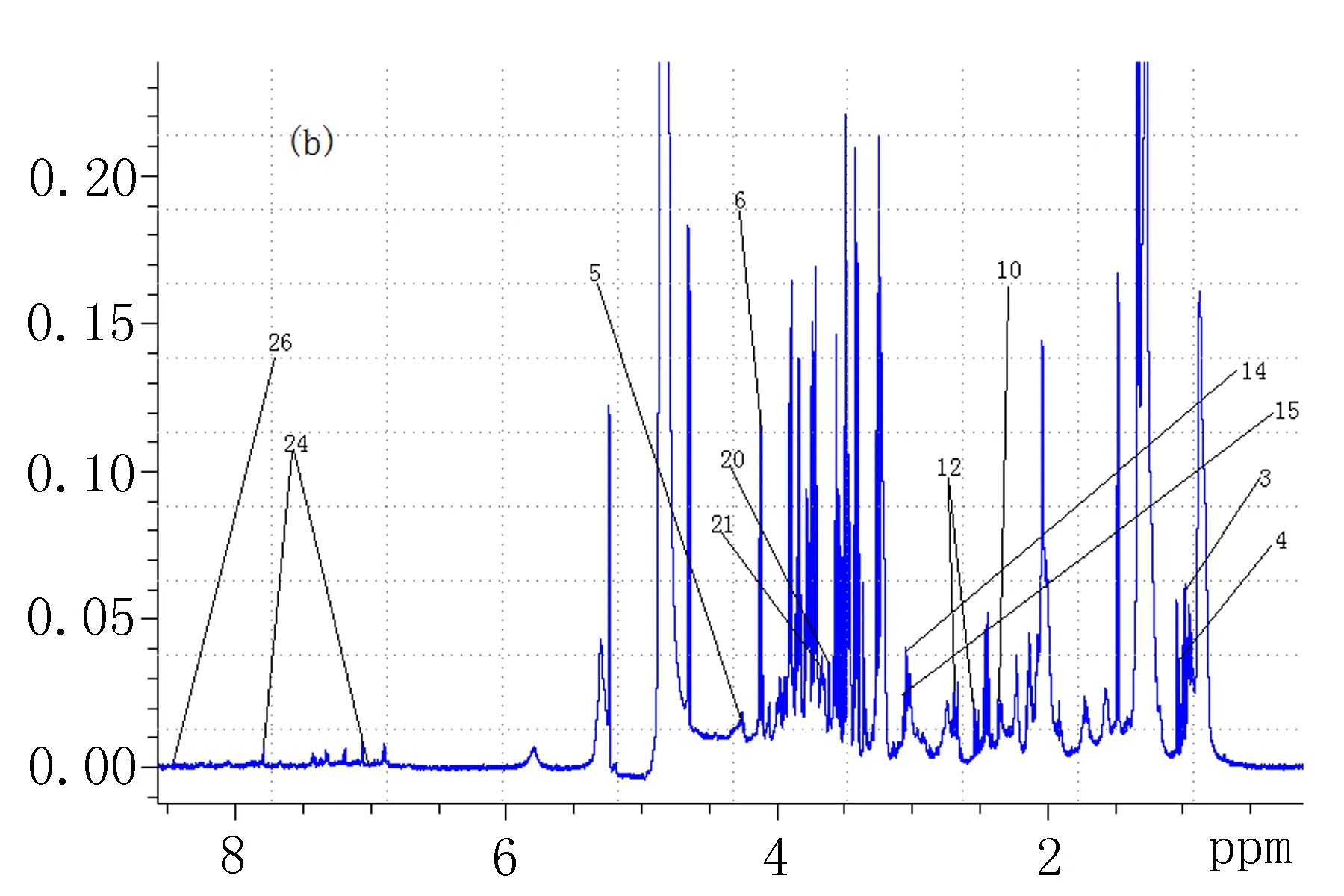
b: 甲状腺乳头状癌组
2.2OPLS-DA分析结果PCA积分值散点图(图2a)和其三维图(图2b)显示两组间的分离分布趋势很清晰。OPLS-DA分析结果显示甲状腺乳头状癌组与健康对照组血浆代谢物有明显差异。对应的载荷图显示,有一部分成分离原点分布比较远,表示这些成分有明显差异,如β-Glu(3.49 ppm)、鲨肌醇(3.35 ppm)、α-Glu(3.72 ppm)、胆碱(3.21 ppm)、甘氨酸(3.55 ppm)、肌醇(3.65 ppm)、甲基组氨酸(7.05 ppm)、苯丙氨酸(7.32 ppm)、丙酮酸(2.36 ppm)、不饱和脂类(5.28 ppm)、酪氨酸(7.18 ppm)、低密度脂蛋白(LDL,1.25 ppm,4.25 ppm)、乳酸(1.33 ppm)、极低密度脂蛋白(VLDL,0.86 ppm)(图2c)。
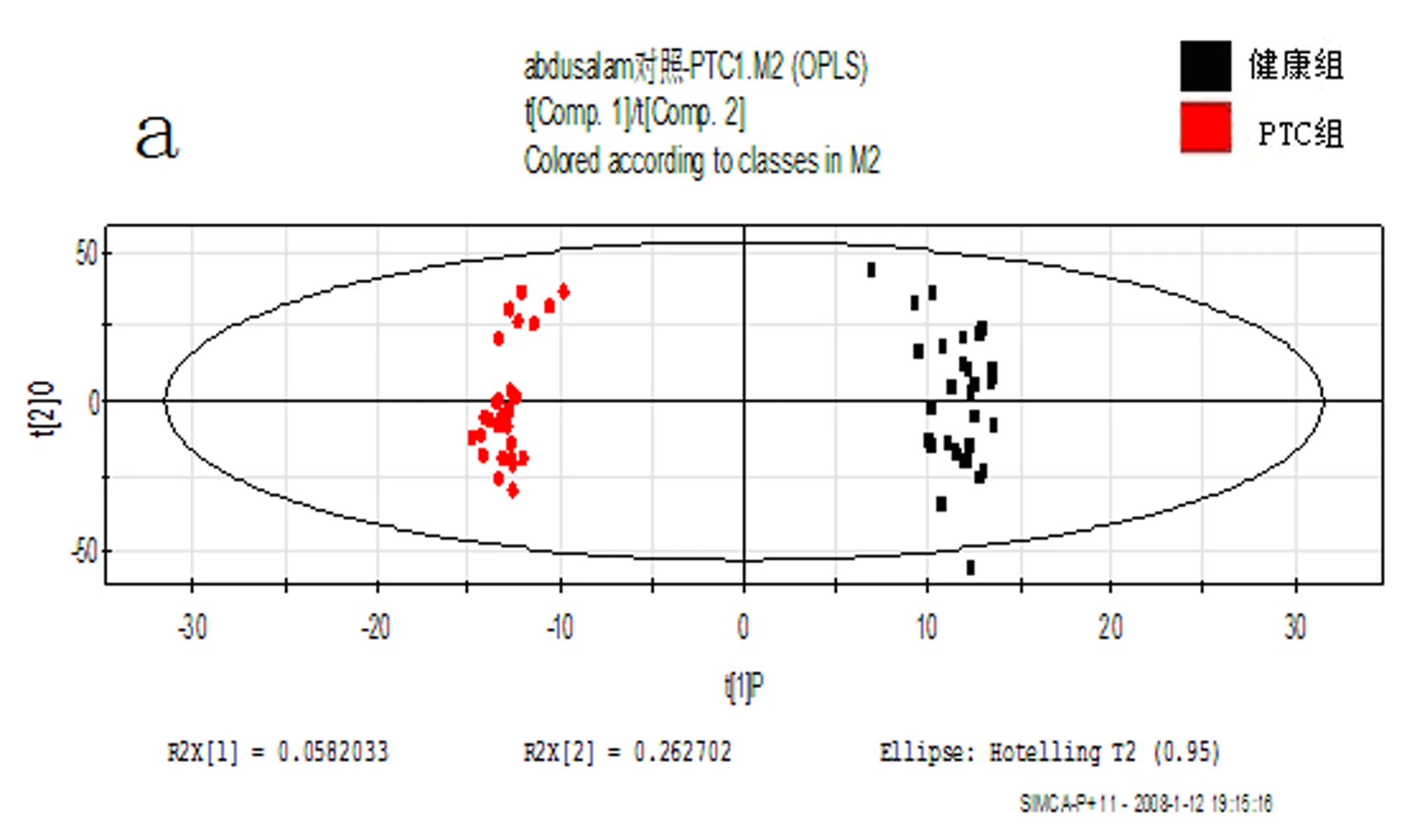
a: OPLS-DA分析散点图;
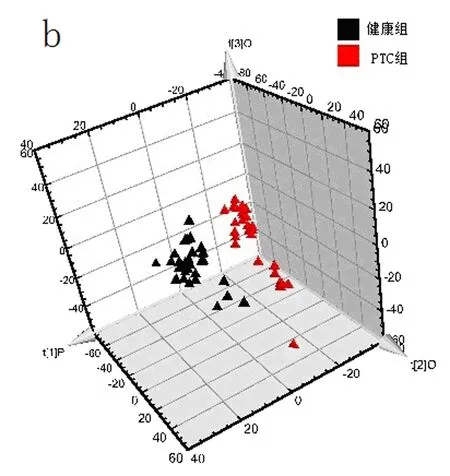
2b: 三维图;
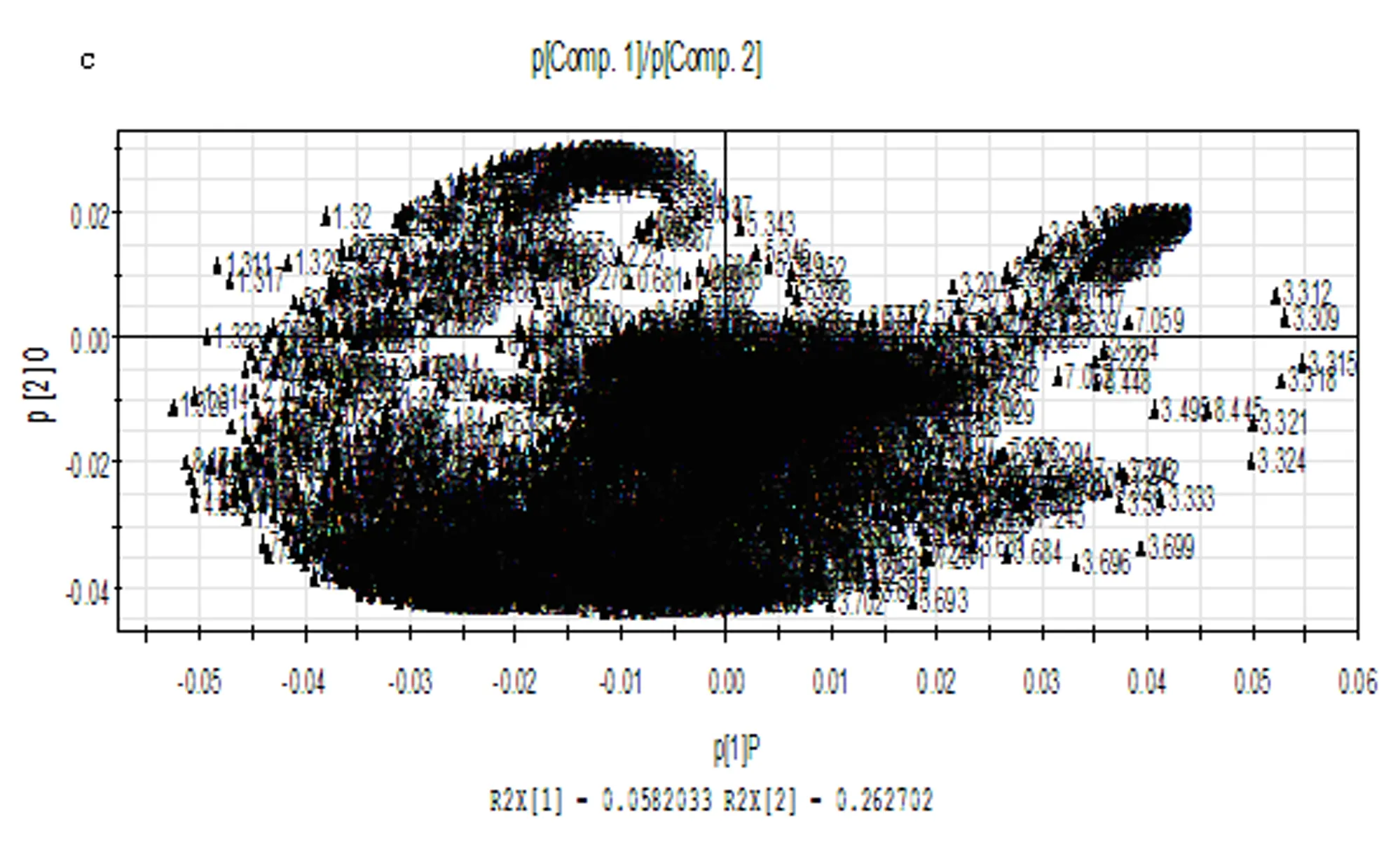
2c: 载荷图
2.3差异性代谢物的相关系数分析根据以上信息及用H1-H1同核相关谱(COSY谱)、质子全相关谱(TOCSY谱)、J-分解谱等二维谱技术确定了两组血浆代谢物有差异性,与健康对照组相比,甲状腺乳头状癌组血浆中极低密度脂蛋白、异亮氨酸、亮氨酸、缬氨酸、低密度脂蛋白、乳酸、丙氨酸、糖蛋白、谷氨酰胺、肉碱、α-酮戊二酸、肌酸、甘氨酸、不饱和脂类、酪氨酸、甲基组氨酸、苯丙氨酸的含量降低,同时丙酮酸、柠檬酸、肌酸酐、胆碱、鲨肌醇、β-葡萄糖、肌醇、α-葡萄糖和甲酸的含量增高,差异有统计学意义(P<0.05),见表1。
3 讨论
本研究运用核磁共振代谢组学技术分析了健康对照组和甲状腺乳头状癌组血浆中有差异的代谢物,从PCA结果分析,健康对照组和甲状腺乳头状癌组在积分散点图上很明显地分开。用代谢组学的方法对体液进行分析可获得与内环境变化有关的生物标志物及这种变化的机制信息 。用二维谱技术确定了差异性代谢物,如患者血中α-葡萄糖、β-葡萄糖的含量均有所增加,可能是患者体内糖异生作用增强的结果,糖代谢的场所是肝脏,肝糖原加速分解和其他非糖物质的糖异生作用产生的葡萄糖使血糖含量增高。

表1 健康对照组与甲状腺乳头状癌组血浆主要差异性代谢物及相关系数
肉碱与免疫系统的功能有关,并可能参与支链氨基酸的新陈代谢。本研究显示甲状腺乳头状癌组血浆中肉碱含量减少,可能导致患者免疫力下降。甲状腺乳头状癌组血浆中肌醇和鲨肌醇的含量升高,其有代谢脂肪和胆固醇的作用,可降低胆固醇。本研究结果同样显示甲状腺乳头状癌组血浆中低密度脂蛋白和极低密度脂蛋白等脂质的含量降低。可能与甲状腺乳头状癌会引起脂类代谢的紊乱及血脂清除率增加有关[15-20]。
α-酮戊二酸有生成氨基酸的功能(α-酮戊二酸能够通过转氨基作用生成谷氨酸),还有各类氨基酸如异亮氨酸、亮氨酸、缬氨酸、丙氨酸、谷氨酰胺、甘氨酸、甲基组氨酸、苯丙氨酸在甲状腺乳头状癌组血浆中的含量降低,表明甲状腺乳头状癌患者体内氨基酸代谢分解加强,原因可能是甲状腺乳头状癌使患者体内某些氨基酸的酶活性增加,导致氨基酸含量降低。
甲状腺乳头状癌组血浆中的柠檬酸含量增高,三羧酸循环中柠檬酸的发酵机理逐渐被人们所认识。已经证明,糖质生成柠檬酸的生化过程中,由糖变成柠檬酸并进入三羧酸循环途径,甲状腺乳头状癌可能加速了糖质的利用。
此外,胆碱的代谢包含胆碱和磷脂酰胆碱,是细胞膜和磷脂脂蛋白的组成成分,对细胞膜的完整性和脂类的代谢发挥着重要的作用。与危阳洋等[20]对甲亢血清的研究相比,甲状腺乳头状癌组血浆中胆碱的含量增加,同样可能破坏细胞膜的通透性,导致对细胞结构产生了损伤。
本研究从代谢产物水平对甲状腺乳头状癌组以及健康对照组血浆代谢物特征进行了研究,并得到一组差异性的血浆代谢物,而非单个代谢物,结合OPLS-DA模式识别技术能够将两组人群分离开来,这种组学技术可能为临床甲状腺乳头状癌的早期诊断和早期治疗提供一种思路。
参考文献:
[1] Greenlee RT, Hill-Harmon MB, Murray T, et al. Cancer statistics, 2001[J]. CA Cancer Clin, 2001, 51(1):15-36.
[2] 张跃武, 高维生, 詹伟松.应更好地规范甲状腺癌的初次手术[J]. 中国普外基础与临床杂志, 2006,13(3):254-255.
[3] Hegedus L.Clinical practice:the thyroid nodule[J]. N Engl Med, 2004, 35(1):1764-1771.
[4] 王征新, 杨波. 结节性甲状腺肿合并甲状腺癌20例临床探析[J].临床与实践, 2013,17(17):2224-2225.
[5] Moses W, Weng J, Sansano I, et al. Molecular testing for somatic mutations improves the accuracy of thyroid fine-needle aspiration biopsy[J].World J Surg, 2010, 34(11):2589-2594.
[6] Kunle O,Robert M,Christine B,et al.Detection of epithelial ovarian cancer using H-NMR based metabonomics[J]. Int J Cancer, 2005, 113(5):782-788.
[7] Thysell E,Pohjianen E,Lindberg J,et al.Reliable profile detection in comparative metabolomics[J].OMICS, 2007, 11(2):209-224.
[8] Duarte IF, Goodfellow BJ, Barros A, et al. Metabolic characterization of plasma injuveniles with glycogen storage disease type la (GSDla)by high-resolution 1H-NMR spectroscopy[J]. NMR Biomed, 2007, 20(1):401-412.
[9] Hu C, van der Heijden R, Wang M, et al. Analytical strategies in lipidomics and applications in disease biomarker discovery[J] . Chromatography B, 2009, 877(26):2836-2846.
[10] Yuan KL, Kong HW, Guan YF, et al. GC-MS Based Plasma Metabolic Profiling of Type 2 Diabetes Mellitus[J]. Chromatography B, 2007, 850(10):236-240.
[11] Xu J,Zhang J,Dong JY,et al. Metabonomics studies of intact hepatic and renal cortical tissues from diabetic db/db mice using high-resolution magic-angle spinning 1H-NMR spectroscopy[J]. Anal Bioanal Chem , 2009, 393(10):1657-1668.
[12] Akira K, Imachi M, Hashimoto T. Investigations into biochemical changes of genetic hypertensive rats using 1H nuclear magnetic resonance-based metabonomics[J]. Hypertension Res, 2005, 28(5):425-430.
[13] Dumas ME, Barton RH, Toye A, et al. Metabolic profiling reveals a contribution of gut microbiota to fatty liver phenotype in insulin-resistant mice[J]. Proc Natl Acad Sci USA, 2006, 103(33):12511-12516.
[14] Gowda GAN, Zhang S, Gu H, et a1. Metabolomics-based methods for early disease diagnostics:a review[J]. Expert Rev Mol Diagn, 2008, 8(5):617-633.
[15] Guerrero A, Pamplona R, Portero-Otin M, et al. Effect of thyroid status on lipid composition and peroxidation in the mouse liver[J].Free Radic Biol Med,1999,26(1):73-80.
[16] Costantini F, Pierdomenico SD, De Cesare D, et al. Effect of thyroid function on LDL oxidation[J]. Arterioscler Thromb Vasc Biol, 1998,18(5):732-737.
[17] Magsino CH, Hamouda W, Ghanim H, et al. Effect of triiodothyronine on reactive oxygen species generation by leukocytes, indices of oxidative damage, and antioxidant reserve[J]. Metab Clin Exp, 2000, 49(6):799-803.
[18] Gredilla R, Barja G, Lopez-Torres M . Effect of short-term caloric restriction on H2O2 production and oxidative DNA damage in rat liver mitochondria and location of the free radical source[J]. Bioenerg Biomembr, 2001, 33(4):279-287.
[19] Nedvidkova J, Haluzik M, Baak V, et al. Proceedings of the 8th Symposium on Catecholamines and other Neurotransmitters in Stress[J]. New York Acad Sci, 2003,37(2):81-136.
[20] 危阳洋, 王彩虹, 李伟, 董继扬, 陈忠, 甲亢患者血清和尿液的核磁共振[J]. 高等学校化学学报, 2010, 2(2):279-284.
