发酵驼乳源生物活性肽的提取分离和免疫调节活性评价
2014-07-13巴合提乌拉孜别克刘红梅新华那比
巴合提·乌拉孜别克,刘红梅,新华·那比
(新疆医科大学 a.药理教研室;b.高职学院机能教研室,乌鲁木齐 830011)
0 引 言
发酵制品食用在中亚具有悠久历史,是哈萨克族及蒙古族等游牧民族常作为药食兼用的功能性食品。本课题组历尽十年研究发现乳酪乳清(哈族传统制作的发酵食品)富含益生菌及生物活性肽具有抗动脉粥样硬化作用。发酵驼乳也是传统乳饮品。民间用于辅助治疗结核病和糖尿病[1]。
本课题组研究结果显示发酵驼乳具有抗炎作用,可能与其免疫调节作用有关[2],免疫学发展使得食品中特定的天然功能因子对调节免疫功能、抵抗慢性炎症和损伤的作用越来越清楚。利用食品功能因子调节免疫系统成为一个重要的研究内容。本研究提取分离发酵驼乳中不同的组分,并研究其对淋巴细胞增殖和细胞因子的影响,为其免疫调节机制提供初步的理论依据。
1 实 验
1.1 材料
1.1.1 新疆传统发酵驼乳样品来源
新疆传统发酵驼乳购于新疆维吾尔自治区昌吉州呼图壁县牧区。
1.1.2 动物来源
体重20±2 g,雄性,昆明种小鼠[SCXK(新)2003-0001]购自新疆医科大学动物中心。
1.1.3 仪器与试剂
超滤装置,超滤膜(内压式Ps-10,分子量截留值为10 000);Sephadex G-50,RE-52型旋转蒸发仪,冷冻干燥机,超净操作台,5%CO2培养箱;96孔培养板,RPMI-1640培养基,细胞计数试剂盒-8(CCK-8),淋巴细胞分离液,胎牛血清(FBS),磷酸缓冲溶液(PBS),小鼠IFN-γ和IL-4 ELISA试剂盒。
1.2 方法
1.2.1 乳清的分离及超滤
发酵驼乳以3 000 r/min,离心45 min,分离得到乳清。采用分子量截留值为10kua的超滤膜对乳清进行超滤,并将超滤液浓缩,冷冻干燥得到粗品。
1.2.2 超滤物的凝胶层析
采用Sephadex G-50凝胶层析柱分离分子量10 ku以下粗品。首先用蒸馏水溶胀Sephadex G-50粉末,装住,平衡。设柱体积:1.7 cm×85 cm,流动相与洗脱液均为蒸馏水;超滤冻干粉质量浓度为1 g/L。确定最佳流速与上样量:(1)流速的选择:0.3,0.5,0.8 mL/min对样品进行洗脱,对照洗脱图谱选择合适的流速。(2)选择上样量为2,3.5,5 mL进行试验,对照洗脱图谱选择合适的上样量。进行分离,每3 mL收集液在紫外检测器测定214 nm处吸收值,合并出峰时间相同收集液,浓缩,冷冻干燥,保存于-20℃。
1.2.3 小鼠脾淋巴细胞悬液的制备[3]
取(20±2)g,雄性,昆明小鼠眼球放血,处死,无菌超净台上取出脾脏,置200目尼龙筛上,用无菌注射器芯研磨,过筛的细胞收集于盛有磷酸缓冲液(PBS)的无菌培养皿中。加入适量淋巴细胞分离液,在室温下以2 000 r/min,水平离心30 min,用吸管吸取淋巴细胞云雾层移入另一离心管中,用PBS洗涤3次。重悬于含10%热灭活胎牛血清,浓度为2.05 mmol/L左旋谷氨酰胺,0.1%青-链双抗溶液的完全RPMI-1640培养液中,细胞悬液浓度调至1×105mL-1,并用胎盘蓝溶液测定细胞存活率。
1.2.4 各凝胶层析组分细胞增殖活性的评价[4]
分别设立空白对照组,阳性对照组和实验组(组分a,b,c,d), 检测不同组分对脾脏淋巴细胞增殖的影响。备好的小鼠脾淋巴细胞悬液接种于96孔培养板(100 μL/孔)上述每组6孔,在质量分数为5%CO2,37℃的培养箱中预孵育4小时。将各凝胶层析组分溶于蒸馏水中,每组分备两个质量浓度(0.1,0.25 g/L和0.5g/L),用0.22 μm虑膜过滤,加至实验组(100 μL/孔)。阳性对照组加入终质量浓度为5 mg/L的ConA(100 μL/孔), 空白对照组加入等体积RPMI-1640培养液。继续孵育44小时后,无菌,避光条件下每孔加入10 μL ccK-8溶液,再培养4 h,用酶标仪测定450 nm处光密度(OD),计算刺激指数(SI)。各组分对淋巴细胞的刺激指数(SI)=实验孔或阳性对照孔OD值/空白对照孔OD值[5]。
1.2.5 测定肽段C对淋巴细胞表达IFN-γ与IL-4水平的影响
采用酶联免疫 (Enzyme-Linked Immunosorbent Assay,ELISA)法[6]评价肽段C对小鼠脾淋巴细胞表达IFN-γ与IL-4的影响。按照1.2.4所述淋巴细胞培养48 h后,以1 500 r/min离心10 mins细胞悬液,收集上清,严格按照ELISA试剂盒说明书操作,测定细胞上清IFN-γ与IL-4质量浓度。分别设提取物C组(0.1,0.25 g/L和0.5 g/L),空白对照组和阳性对照组。
1.2.6 统计分析
实验数据用x±S表示,采用SPSS 13.0统计软件进行统计分析。单因素方差分析后进行组间t检验,检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果与分析
2.1 凝胶层析分离超滤物
离心发酵驼乳分离乳清,进一步采用超滤法得到小于10 ku分子量的粗品,浓缩,冷冻干燥。考察Sephadex G-50柱分离条件并确定:流速0.5 mL/mim,上样量2 mL。共得到4个组分,结果如图1~图3所示。

图1 凝胶层析上样量对组分分离的影响

图2 凝胶层析流速对组分分离的影响

图3 凝胶层析分离所得的各组分
2.2 各凝胶层系组分的促淋巴细胞增殖活性
发酵驼乳源生物活性物质对小鼠脾淋巴细胞增殖能力的影响:与空白对照组比较,凝胶层析肽段c组(0.25,0.5 mg/L)OD值为0.58±0.014,0.59±0.018,(P<0.05), 淋巴细胞的刺激指数分别为1.26±0.015,1.3±0.010(P<0.05)。说明肽段C脾淋巴细胞增殖能力显著增高于空白组以及其余肽段刺激组。结果如表1和图4所示。
表1 凝胶层析各组分对小鼠脾淋巴细胞增值率的影响(±s)
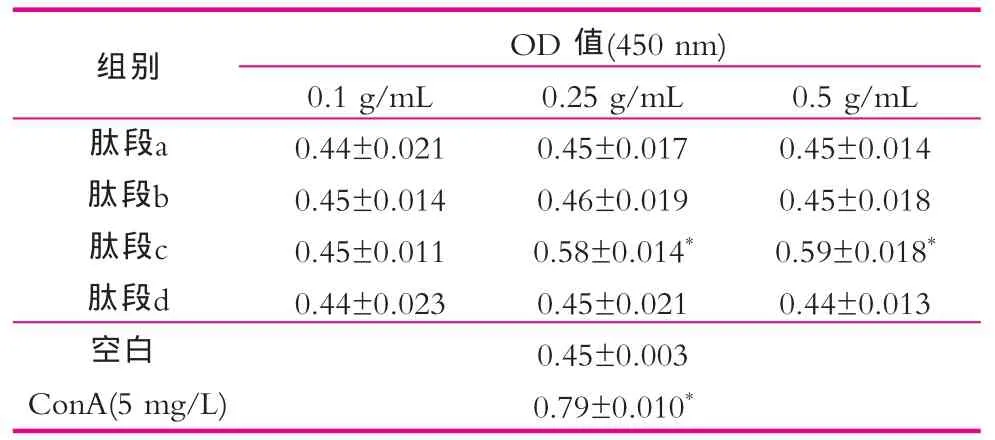
表1 凝胶层析各组分对小鼠脾淋巴细胞增值率的影响(±s)
注:*为与其他组相比,有统计学差异,n=6。下同。
?
表2 凝胶层析各组分刺激小鼠脾淋巴细胞指数(±s)

表2 凝胶层析各组分刺激小鼠脾淋巴细胞指数(±s)
注:*为与其他组相比,有统计学差异,n=6。
组别肽段a肽段b肽段c肽段d空白ConA(5 mg/L)SI值(实验组OD/空白组OD)0.1 g/mL 0.97±0.024 0.99±0.020 1.01±0.021 0.99±0.047 0.25 g/mL 0.99±0.012 1.00±0.012 1.26±0.015*1.00±0.003 1.00±0.002 1.76±0.013*0.5 g/mL 1.01±0.014 0.98±0.017 1.30±0.010*0.99±0.001

图4 各组分对小鼠脾淋巴细胞增殖的影响
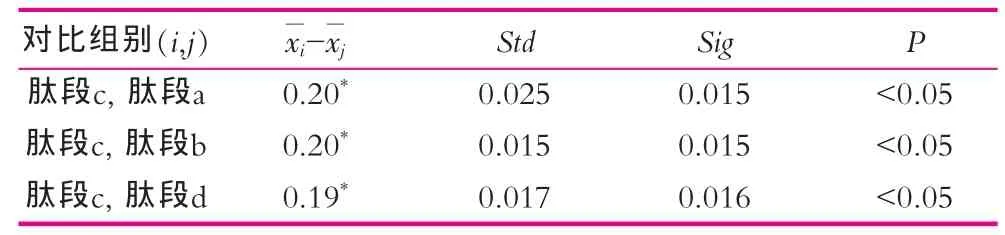
表3 凝胶层析各组间小鼠脾淋巴细胞刺激指数差异(x±s)
肽段c与其余各肽段之间差异有统计学意义(P<0.05)
2.3 肽段C对淋巴细胞表达IFN-γ与IL-4水平的影响
ELISA法测得肽段C组和空白对照组,阳性对照组IFN-γ与IL-4表达水平。组间比较,肽段C组IFN-γ含量相对于空白对照组明显增高(P<0.05),而两组IL-4表达无统计学差异(P>0.05),结果如表4所示。
表4 肽段C对细胞上清IFN-γ与IL-4含量的影响(±s)

表4 肽段C对细胞上清IFN-γ与IL-4含量的影响(±s)
注:*为与其他组相比,有统计学差异,n=6。
肽段c组0.1 g/L 0.25 g/L 0.5 g/L空白组ConA组IFN-γ 0.14±0.020 0.22±0.021觹0.23±0.015觹0.15±0.014 0.61±0.012觹IL-4 0.13±0.015 0.13±0.023 0.14±0.011 0.13±0.017 0.23±0.018觹
3 结 论
本研究主要针对发酵驼乳源生物活性肽的提取分离,并通过体外细胞培养方法测定各肽段免疫调节活性。其免疫调节活性的评价即测定各肽段对小鼠脾淋巴细胞增殖和细胞因子表达水平的影响[5]。细胞增殖性强弱反应细胞生存能力与功能状态。当细胞受到生理性与病理性因素损伤,机体免疫力下降时,首先表现出增殖活性的降低。而细胞因子IFN-γ能促进免疫应答,是抗结核感染免疫反应中的关键细胞因子[7]。
基于前期种种研究发现,本研究首先对发酵驼乳蛋白及小分子生物活性肽的部分提取工艺进行考察,并更深入探讨发酵驼乳蛋白及小分子生物活性物肽对小鼠脾淋巴细胞增殖以及细胞因子表达的影响。实验结果表明,部分发酵驼乳源生物活性肽对小鼠脾淋巴细胞的体外增值有一定的作用,并可以从细胞因子IFN-γ表达水平也可证明这一点,初步评价发酵驼乳在小鼠免疫反应中的调节作用。
[1]HE J X,Hasisurong,Narnbatu,Jirimutu Research Prosress in Health Care Function of Camel milk[J].Food Science.2009,30:504-506.
[2]古丽孜亚·卡克巴依,新华·那比.新疆哈萨克族传统发酵驼乳抗炎作用的初步研究[J],中国乳品工业,2006.35(9):8-10.
[3]江文正,金宁一,李子健,张立树金洪涛.共表达HIV.1 gpl20与IFN-仅重组鸡痘病毒诱导特异性CTL的初步研究.中国免疫学杂2005,21:254-256.
[4]XIAO G J,MING X L,YAN H,etal.Antitumorand immunododulatory activity of polysaccharide from fungus Coprinus comatus (Mull.Fr.)Gray [J].Interna tionalJournalofBiological Macromolecules 2013,58:349-353.
[5]张志敏,王建华,赵兴华,等.苦马豆素对小鼠细胞免疫功能的影响.西北农林科技大学学报[J].2008,36(2):61-66.
[6]谈旭华,孙松,朱婷婷,等.干眼患者外周血单核细胞培养上清液和泪液中白细胞介素一17和白细胞介素一22的变化.中华实验眼科杂志,2013,7(31):668-673.
[7]本付,庄斌,宋红梅,等.IFN-γ因多态性与肺结核易感性的配对病例对照研究.中华微生物学和免疫学[J].2009,29(8):723-726.
