毛白杨PtoeIF5A4的原核表达、纯化及鉴定
2014-07-12张杰伟管阳朱丹陈亚娟丁莉萍王宏芝魏建华
张杰伟 管阳 朱丹 陈亚娟 丁莉萍 王宏芝 魏建华
(北京市农林科学院 北京农业生物技术研究中心 农业基因资源与生物技术北京市重点实验室,北京 100097)
真核细胞翻译起始因子5A(eukaryotic translation initiation factor 5A,eIF5A)是真核生物中普遍存在的一类蛋白,也是目前发现的唯一含有羧腐胺赖氨酸残基的蛋白[1]。羧腐胺赖氨酸是由eIF5A翻译后特定位置的赖氨酸经两步酶促反应催化生成[2],被修饰后的eIF5A才能够在生物体内行使功能[3]。eIF5A最初被认为在蛋白翻译起始起重要作用,但最近的研究表明,其在所有细胞中蛋白延伸过程中发挥着重要作用[4,5]。Gutierrez等[6]利用酵母和体外模拟翻译试验表明,eIF5A不仅能增强核糖体肽基转移酶的活性,而且能提高酶与作用底物的反应性,从而在促进连续脯氨酸残基间的多肽联合的形成过程中起着重要作用。在植物细胞中,eIF5A参与了植物的生长发育、响应生物和非生物胁迫等生理过程[3,7]。如拟南芥中,eIF5A翻译后修饰关键酶——脱氧羧腐胺赖氨酸合酶(Deoxyhypusine synthase,DHS)抑制其活性后可延缓叶片衰老过程[1],AteIF5A1参与拟南芥次生木质部的发生过程[2],AteIF5A2参与拟南芥病原菌诱导的细胞死亡,AteIF5A3参与拟南芥的生长发育过程[8]。月季RceIF5A响应高温、渗透和氧化胁迫。过量表达RceIF5A的转基因拟南芥较野生型更加耐受渗透、过氧化和高温胁迫,而减量表达RceIF5A转基因拟南芥(拟南芥中所有eIF5A成员表达均下调)在渗透、过氧化和高温胁迫时较野生型更敏感[9]。杨树中过表达柽柳TaeIF5A1基因,在正常的生长条件下转基因与野生型杨树生长状态没有明显区别,但在0.6%的NaCl胁迫下,转基因杨树的株高和底面直径均比野生型高;且在山梨醇、硫酸铜和氯化铬等非生物胁迫下,转基因杨树均表现明显的耐受[3]。
我国现有杨树人工林757万hm2,因其生长速度快,基因组相对较小已成为林木研究的模式植物。在前期研究中,研究组从毛白杨中克隆了1个eIF5A基因的全长cDNA,依据其与已测序完成的毛果杨序列的同源性分析,将其命名为PtoeIF5A4。该基因在毛白杨不同组织中表达丰度不同,其在茎中的表达量最高,其次为叶片和根。根据PtoeIF5A4在毛白杨茎中的表达模式,推测其在林木次生生长中起关键作用[10]。为了进一步研究该基因在林木次生生长过程中的功能,本试验旨在通过构建已克隆的毛白杨PtoeIF5A4的原核表达载体,并诱导表达获得较高纯度的蛋白,以期为进一步分析该蛋白特性和生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 携带PtoeIF5A4全长cDNA的质粒pGEM-T Easy-PtoeIF5A4为本实验室构建保存;大肠杆菌BL21(DE3)、TOP10感受态细胞及原核表达载体pET-28a(+)为农业基因资源与生物技术北京市重点实验室保存。
1.1.2 试剂 T4 DNA连接酶购自美国NEB公司、Phusion DNA聚合酶购自美国Thermo公司;pGEM-T Easy载体快速连接试剂盒和DNA片段快速纯化/回收试剂盒购自美国Promega公司;限制性内切酶和标准蛋白质分子量Marker购自加拿大Fermentas公司。亲和填料Ni2+Chelating Sepharose Fast Flow购自美国GE公司;一抗鼠抗Histidine单克隆抗体购自美国Sigma公司;二抗辣根过氧化物酶偶联的羊抗鼠IgG购自中山金桥公司;显色底物购自瑞士Roche公司;X光片购自日本Kodak公司。IPTG、卡那霉素、氨苄青霉素其他试剂均为国产分析纯产品。
1.2 方法
1.2.1 毛白杨PtoeIF5A4基因原核表达载体的构建 用DNAMAN软件分析PtoeIF5A4cDNA编码区的酶切位点分布,结合表达载体pET28a(+)多克隆位点的酶切位点分析,设计扩增PtoeIF5A4基因进行原核表达的上游引物PtoeIF5A4-F(5'-CATATGTCGGACGAGGAGCACC-3')和下游引物PtoeIF5A4-B(5'-GTCGACTCAATTTTTTGGACCA-3'),分别在PtoeIF5A4的5'端和3'端引入NdeⅠ和SalⅠ酶切位点(下划线部分)。以实验室保存的pGEM-T Easy-PtoeIF5A4的质粒为模板,用Phusion DNA聚合酶进行PCR扩增,反应体系为20 μL:5×Phusion HF缓冲液(Mg2+)4.0 μL,2.5 mmol/L dNTPs 1.6 μL,2 U/μL Phusion DNA聚合酶0.1 μL,10 μmol/L的上下游引物各1.0 μL,DNA模板2.0 μL,ddH2O 10.3 μL。扩增条件为:98℃预变性30 s;98℃变性10 s,55℃退火30 s,72℃延伸50 s,共30个循环;72℃总延伸5 min。扩增产物经1.0%琼脂糖凝胶电泳,用凝胶回收试剂盒回收480 bp的目的条带并克隆到pBSK载体上,转化大肠杆菌TOP10,提取阳性克隆质粒,用NdeⅠ和SalⅠ双酶切检测质粒并送上海生工生物工程公司测序。分别用NdeⅠ和SalⅠ双酶切测序正确的pBSK-PtoeIF5A4和pET28a(+)载体质粒,并回收480 bp和5 kb的目的条带。
分别取回收后的目的片段及载体片段用T4 DNA连接酶连接,连接产物转化大肠杆菌TOP10感受态细胞,均匀涂布于含有Kan(50 μg/mL)的固体LB培养基,37℃温箱过夜培养,挑取阳性克隆,经菌落PCR及酶切鉴定后用于表达菌株的转化。
1.2.2 PtoeIF5A4重组蛋白的诱导表达及鉴定 将构建成功的重组质粒pET28a-PtoeIF5A4转化BL21(DE3)感受态细胞,涂布在含有Kan的固体LB培养基上,37℃温箱过夜培养,挑取重组质粒的单克隆菌落经菌落PCR鉴定后,选取单菌落接种于5 mL含Kan的LB液体培养基中,37℃培养过夜。取上述过夜菌液1 mL转接入不同100 mL含Kan的液体LB中,37℃振荡培养至OD为0.6-0.8时,分别加入1 mol/L IPTG至终浓度为0.1、0.2、0.5和1.0 mmol/L,28℃继续振荡培养4 h,同时设未经IPTG诱导的菌液作为对照。取1 mL诱导后菌液,6 000 g,离心10 min后收集菌体,分别用60 μL和90 μL 1×PBS 缓冲液(20 mmol/L Na3PO4,500 mmol/L NaCl,pH7.4)重悬,分别加入4×SDS上样缓冲液20 μL和30 μL,煮沸10 min,13 000 g离心3 min,取上清10 μL进行SDS-PAGE电泳(5%浓缩胶,12%分离胶),SDS-PAGE胶用考马斯亮蓝R250染色。1.2.3 PtoeIF5A4重组蛋白的纯化及电泳 每100 mL菌液收集的菌体中加入2 mL含1 mmol/L PMSF的1×PBS 缓冲液重悬菌体,冰上超声破碎(输出功率270 W,每超声20 s,间隔40 s,共15次)。4℃、13 000 g离心30 min,小心吸出上清液至另一离心管中。镍亲和填料按说明书进行处理及活化后,取1 mL装柱。用超声后离心的上清液2 mL上样,依次用5 mL洗脱液1(1×PBS 缓冲液+20 mmol/L咪唑),5 mL洗脱液2(1×PBS 缓冲液+200 mmol/L咪唑)洗涤,5 mL洗脱液3(1×PBS 缓冲液+500 mmol/L咪唑)洗涤,每管收集500 μL,12% SDSPAGE电泳检测各管蛋白并用考马斯亮蓝R250染色。1.2.4 PtoeIF5A4重组蛋白的免疫印迹 蛋白质免疫印迹参照Laemmli[11]的方法进行。采用Bio-Rad半干电转移系统,13 V转移30 min。转移蛋白后的PVDF膜经过丽春红染色检测转移效果。
转移蛋白后的PVDF膜在含5%脱脂奶粉的TBST缓冲液(50 mmol/L Tris-HCl,150 mmol/L NaCl,0.05% Tween 20,pH7.5)中室温封闭2 h;然后在含有0.5%脱脂奶粉的TBST缓冲液中加入一抗Anti-His(1∶10 000稀释),4℃孵育过夜;用TBST缓冲液洗涤PVDF膜3次,100 mL/次,10 min/次;然后在含有0.5%脱脂奶粉的TBST缓冲液中加入二抗山羊抗鼠(1∶10 000稀释)室温孵育1 h;继续用TBST缓冲液洗涤PVDF膜3次,100 mL/次,10 min/次;取出PVDF膜用化学发光显色试剂盒显色5 min,在暗室中对X光片曝光。
2 结果
2.1 重组原核表达载体pET28-PtoeIF5A4的构建与鉴定
以携带毛白杨PtoeIF5A4编码区(PtoeIF5A4-CDS)的质粒为模板,利用PCR扩增首先在PtoeIF5A4-CDS的5' 与3' 端分别添加NdeⅠ和SalⅠ酶切位点,获得480 bp的片段(图1)。PtoeIF5A4-CDS中没有NdeⅠ和SalⅠ酶切位点,同时在pET28a(+)的多克隆位点又存在这两个位点,因此,可将PtoeIF5A4-CDS克隆到pET28a(+)的这两个酶切位点之间,得到N端融合有组氨酸标签(His-Tag)的融合蛋白。
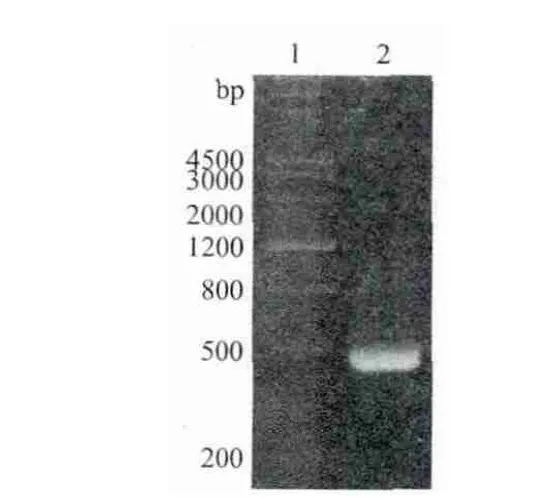
图 1 PtoeIF5A4基因PCR扩增结果
将添加酶切位点的PtoeIF5A4-CDS克隆到pBSK载体上,转化大肠杆菌TOP10,挑取阳性克隆,摇菌提取质粒(pBSK-PtoeIF5A4),经酶切鉴定及测序选择与原序列完全一致的阳性克隆,提起质粒,分别用NdeⅠ和SalⅠ双酶切pBSK-PtoeIF5A4及pET28a(+)载体,分别回收480 bp和5 kb的条带进行连接,将菌落PCR鉴定为阳性的4个重组子再进行双酶切鉴定,2个重组子经酶切鉴定后均得到两条目的带,大约为5 kb和480 bp(图2),恰好与预期的pET28a(+)载体和PtoeIF5A4片段的大小相符,说明已成功构建了毛白杨PtoeIF5A4的原核表达载体,命名为pET28-PtoeIF5A4。
2.2 pET28-PtoeIF5A4在BL21中的表达

图 2 酶切鉴定重组质粒pET28-PtoeIF5A4
将构建好的pET28-PtoeIF5A4转化大肠杆菌表达菌株BL21(DE3),挑取转化菌斑5个,用基因特异性引物(PtoeIF5A4-F和PtoeIF5A4-B)进行PCR扩增鉴定。选取鉴定正确的单菌落在37℃条件下振荡培养菌液至OD600为0.6-0.8时,在28℃条件下,分别用0.1、0.2、0.5和1.0 mmol/L的IPTG诱导4 h,然后SDS-PAGE检测未诱导及不同IPTG浓度诱导后的总蛋白,在0.1和0.2 mmol/L的IPTG诱导时,诱导后总蛋白在18 kD处明显比未诱导总蛋白的量大,其中0.1 mmol/L的IPTG诱导时该蛋白表达最多,而在0.5和1.0 mmol/L的IPTG诱导时,诱导后总蛋白在18 kD处仅比未诱导总蛋白的量略多(图3),该蛋白的大小与PtoeIF5A4的预测大小一致,初步推测诱导出的18 kD蛋白为目的蛋白。
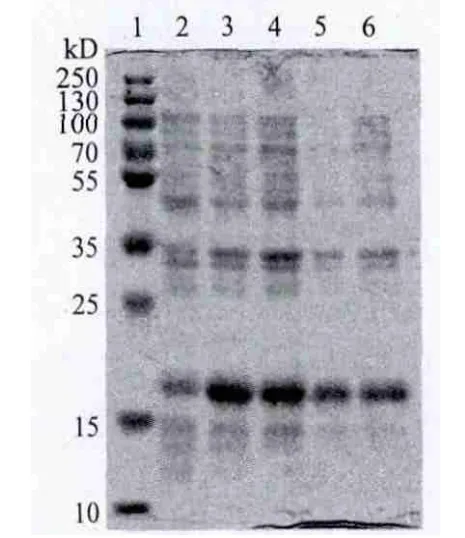
图 3 不同IPTG浓度pET28-PtoeIF5A4的表达分析
2.3 毛白杨pET28-PtoeIF5A4原核表达与纯化
因pET28-PtoeIF5A4重组蛋白在28℃条件下,0.1 mmol/L IPTG诱导4 h后的表达量最高,故选取该条件进行重组蛋白的表达,4℃收集菌体用1×PBS缓冲液重悬后经超声破碎菌体并离心后用12%的SDSPAGE电泳检测,在上清和包涵体部分均在18 kD处有一条明显的蛋白条带,用洗脱液2洗脱Ni2+亲和层析柱时可以从上清中纯化出18 kD的目的蛋白,且纯度大于95%(图4-A),Western blotting可见该重组蛋白能够与Anti-His单克隆抗体发生免疫交叉反应(图4-B),表明该纯化蛋白为融合有His标签的PtoeIF5A4。
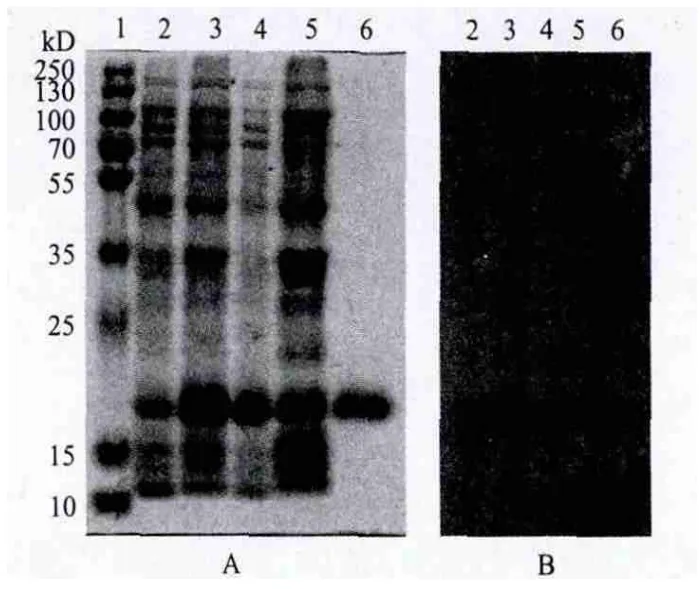
图 4 pET28-PtoeIF5A4的纯化(A)及(B)鉴定
3 讨论
本试验选用了pET原核表达系统,pET28a载体上的T7启动子与大肠杆菌BL21(DE3)中噬菌体编码的T7 RNA聚合酶特异结合,从而高效地启动下游目的基因的表达[12,13]。本研究中,构建的表达载体pET28a-PtoeIF5A4经序列测定表明,PtoeIF5A4基因插入位置、大小和读码框均正确,试验结果表明pET28-PtoeIF5A4融合蛋白在宿主菌能被正常表达。该载体带有His标签蛋白(6个组氨酸标记),可与目的蛋白的N 末端或C 末端形成融合蛋白,便于用组氨酸-Ni2+亲合层析法纯化目的蛋白,因此在本研究中选用了pET28a表达载体来表达杨树PtoeIF5A4蛋白,在PtoeIF5A4基因上游引物的起始密码子ATG 前引入了NdeⅠ酶切位点,下游引物的终止密码子后引入SalⅠ酶切位点。因此表达的蛋白质的N端含有6个组氨酸标签,本研究中,pET28-PtoeIF5A4融合蛋白经超声离心后上清可通过Ni2+亲和层析柱快速、简便和高效的纯化。本试验通过SDS-PAGE检测发现表达的融合蛋白相对分子质量为18 kD,与PtoeIF5A4预测分子量一致,Western blotting试验证明该重组蛋白能够与Anti-His单克隆抗体发生免疫交叉反应,表明本研究已经成功表达并纯化PtoeIF5A4融合蛋白。
前期的研究表明,IPTG 的浓度对外源蛋白的表达有着重要的影响,但是过高浓度的IPTG 往往对细胞产生毒性,同时也影响融合蛋白的表达效率和表达形式。本试验探索了不同浓度的IPTG对PtoeIF5A4融合蛋白表达的影响。 研究发现,在未加入IPTG时,PtoeIF5A4融合蛋白已有轻微的表达,当IPTG的诱导浓度为0.1 mmol/L,PtoeIF5A4融合蛋白的表达量最高,随着IPTG浓度的增加,PtoeIF5A4融合蛋白表达有轻微下降,当IPTG的浓度超过0.5 mmol/L时,融合蛋白表达明显下降。因此,后续的纯化试验选择0.1 mmol/L 为IPTG诱导的浓度。在28℃,0.1 mmol/L IPTG诱导4 h,PtoeIF5A4融合蛋白主要以可溶性的形式存在,主要分布在上清,而在沉淀中的分布较低。研究表明,烟草SKP1基因在无诱导剂IPTG时可以表达目的蛋白,而在0.01-1.0 mmol/L均无目的蛋白的表达[14]。梅竹等[15]研究发现,在0.2 mmol/L IPTG 诱导下,GSTSmad4融合蛋白主要以可溶性的形式存在。这些结果表明,不同的蛋白所需要的最适IPTG的诱导浓度各有不同,低浓度IPTG诱导有助于融合蛋白形成可溶性蛋白。
4 结论
利用pET28-PtoeIF5A4重组载体成功表达了融合有His标签的PtoeIF5A4重组蛋白,并且还对该融合蛋白进行了纯化及鉴定。利用纯化出的蛋白制备抗体进行免疫胶体金标记明确其在体内的亚细胞定位或通过免疫共沉淀筛选杨树PtoeIF5A4的互作蛋白。
[1] Duguay J, Jamal S, Liu Z, et al. Leaf specific suppression of deoxyhypusine synthase inArabidopsis thalianaenhances growth without negative pleiotropic effects[J] . J Plant Physiol, 2007, 164(4):408-420.
[2] Liu Z, Duguay J, Ma F, et al. Modulation of eIF5A1 expression alters xylem abundance inArabidopsis thaliana[J] . J Exp Bot, 2008, 59(4):939-950.
[3] Wang L, Xu C, Wang C, et al. Characterization of a eukaryotic translation initiation factor 5A homolog fromTamarix androssowiiinvolved in plant abiotic stress tolerance[J] . BMC Plant Biol,2012, 118(1):118.
[4] Dias CA, Gregio AP, Rossi D, et al. eIF5A interacts functionally with eEF2[J] . Amino Acids, 2012, 42(2-3):697-702.
[5] Doerfel LK, Wohlgemuth I, Kothe C, et al. EF-P is essential for rapid synthesis of proteins containing consecutive proline residues[J] .Science, 2013, 339(6115):85-88.
[6] Gutierrez E, Shin BS, Woolstenhulme CJ, et al. eIF5A Promotes translation of polyproline motifs[J] . Mol Cell, 2013, 51(1):35-45.
[7] Hopkins MT, Lampi Y, et al. eIF5A is involved in pathogen-induced cell death and development of disease symptoms inArabidopsis thaliana[J] . Plant Physiol, 2008, 148(1):479-489.
[8] Ma F, Liu Z, Wang T, et al.ArabidopsiseIF5A3 influences growth and the response to osmotic and nutrient stress[J] . Plant Cell Environ, 2010, 33(10):1682-1696.
[9] Xu J, Zhang B, et al. RceIF5A, encoding an eukaryotic translation initiation factor 5A inRosa chinensis, can enhance thermotolerance,oxidative and osmotic stress resistance ofArabidopsis thaliana[J] .Plant Mol Biol, 2011, 75(1-2):167-178.
[10] 张利姣, 张杰伟, 陈亚娟, 等. 毛白杨真核细胞翻译起始因子5A(PtoeIF5A4)基因的表达与分析[J] . 农业生物技术学报,2013, 21(8):949-956.
[11] Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J] . Nature, 1970, 227(5259):680-685.
[12] Bonner G, Lafer EM, Sousa R. Characterization of a set of T7 RNA polymerase active site mutants[J] . J Biol Chem, 1994, 269(40):25120-25128.
[13] Chamderlin M, Mcgrath J, Waskell L. New RNA polymerase fromEschericha coliinfected with bateriaphage T7[J] . Nature, 1970,228(5268):227-231.
[14] 张付云, 赵小明, 白雪芳, 等. 烟草SKP1基因的原核表达[J] .西北植物学报, 2009, 29(8):1544-1549.
[15] 梅竹, 杨予涛, 徐志卿. GST-Smad4 融合蛋白的表达与纯化[J] .生物技术通报, 2013(1):134-138.
