PD98059和LY294002对非酶糖基化终产物诱导人RPE细胞表达VEGF的影响△
2014-07-08杨晓春许建彪唐罗生
杨晓春 许建彪 唐罗生
血管内皮生长因子(vascular endothelial growth factor,VEGF)在糖尿病视网膜病变(diabetic retinopathy,DR)中起着重要的作用,它是DR血管生成和渗漏必不可少的诱导因子,涉及病变的各个阶段[1]。近年研究表明,DR患者体内的一种毒性物质非酶糖基化终产物(advanced glycation end-products,AGE)能促使视网膜色素上皮(retinal pigment epithelium,RPE)细胞表达VEGF增加[2]。P44/42 MAPK和PI3K/Akt是两个重要的细胞内信号转导通路,对VEGF的表达具有重要作用[3-4],但它们是否参与了AGE诱导的RPE细胞外VEGF的表达,目前尚未见相关报道。本文通过研究p44/42 MAPK阻断剂PD98059和PI3K/Akt阻断剂LY294002对AGE诱导的ARPE-19细胞外VEGF表达的影响,探讨AGE诱导VEGF表达的可能机制。
1 材料与方法
1.1材料人RPE细胞株ARPE-19由湖南大学生物实验室惠赠,SP法鉴定,取3-5代细胞用于本实验。无糖DMEM培养液购自Invitrogen公司;胎牛血清(FBS)购自杭州四季青生物工程技术有限公司;PD98059和LY294002购自Sigma公司(美国);VEGF试剂盒、链霉亲和素-生物素化-过氧化物酶购自武汉博士德生物技术有限公司;兔抗人磷酸化Akt单克隆抗体、鼠抗人磷酸化p44/42单克隆抗体为碧云天生物技术研究所进口分装;羊抗鼠抗兔二抗检测试剂盒购自中杉金桥生物技术有限公司。AGE及AGE对照物的制备同文献[5]。预实验确定试剂浓度及干预时间。
1.2方法实验分为对照组、AGE组(包括时间依赖组、剂量依赖组)、PD98059组、LY294002组和PD98059+LY294002组。人RPE细胞株ARPE-19细胞按100×103个接种于24孔板中,放入经体积分数4%多聚赖氨酸处理的盖玻片,以含体积分数15%FBS的无糖DMEM液培养至80%融合,换不含FBS的无糖DMEM液培养24 h。根据分组分别加入含下述试剂的培养液。
1.2.1AGE处理ARPE-19细胞时间依赖组加入100 mg·L-1AGE,每组在含体积分数5%CO2、37 ℃培养箱中分别培养2 h、6 h、8 h、12 h、24 h。剂量依赖组在培养箱中的培养时间为8 h,加入AGE浓度分别为50 mg·L-1、100 mg·L-1、200 mg·L-1、400 mg·L-1。同等浓度AGE对照物代替AGE作为对照组。
1.2.2PD98059和LY294002对ARPE-19细胞的干预剂量依赖组分四组,其中两组分别加入20 μmol·L-1PD98059和30 μmol·L-1LY294002,在含体积分数5%CO2、37 ℃培养箱中孵育1 h后,分别加入0 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1、400 mg·L-1的AGE,培养箱孵育8 h。另外两组分别加入0 μmol·L-1、10 μmol·L-1、20 μmol·L-1、40 μmol·L-1的PD98059和0 μmol·L-1、10 μmol·L-1、30 μmol·L-1、60 μmol·L-1的LY294002,孵育1 h后都加入100 mg·L-1AGE,孵育8 h。DMSO替代PD98059或LY294002作为空白对照组。时间依赖组分三组:分别加入20 μmol·L-1PD98059、30 μmol·L-1LY294002和同时加入上述两试剂,孵育1 h后加入100 mg·L-1AGE,分别培养2 h、6 h、8 h、12 h、24 h。AGE对照物替代AGE作为对照组。
1.2.3VEGF蛋白表达的测定吸取细胞培养上清液,按体积比12稀释。96孔酶标板中加入配制的标准品和经稀释的样品各100 μL,加上盖,37 ℃反应90 min。拍干板内液体,按每孔0.1 mL依次加入1100稀释的生物素标记人VEGF抗体,37 ℃反应60 min。去酶标板内液,PBS洗涤3次。按每孔0.1 mL依次加入1100稀释并在37 ℃平衡30 min的链霉亲和素-生物素化-过氧化物酶工作液,37 ℃反应30 min。PBS洗涤5次。按每孔90 μL加入37 ℃平衡30 min的TMB显色液,37 ℃避光反应20 min。每孔加0.1 mL TMB终止液。酶标仪在450 nm测定样品浓度值。
1.2.4P44/42、Akt信号分子表达的检测吸出细胞培养上清液,培养板各孔加入40 g·L-1多聚甲醛固定10 min。配好洗涤液:1 g·L-1Triton X-100、8 g·L-1NaCl、2.42 g·L-1Tris碱,兑H2O。培养板去固定液,摇床上洗涤液洗涤3次,每次5 min。正常山羊血清封闭60 min。去封闭液,抗体1100稀释,各实验组分别加入鼠抗人磷酸化p44/42 MAPK单克隆抗体,或兔抗人磷酸化Akt单克隆抗体。4 ℃湿盒过夜。去一抗,洗涤液洗3次。分别加结合FITC的山羊抗兔或抗鼠二抗(1100稀释),室温避光孵育60 min。洗涤液洗涤3次。取出细胞爬片。抗荧光淬片封片液封片。Zeiss 510 共焦显微镜分析免疫荧光结果。
1.3统计学方法本研究统计分析采用SPSS 13.0软件,组内比较用单因素方差分析(ANOVA),组间比较用SNK-q检验法。P<0.05为差异统计学意义。
2 结果
2.1AGE对ARPE-19细胞外VEGF表达的影响AGE处理ARPE-19细胞后,VEGF的表达改变见表1-表2。由表1-表2可见:随着AGE浓度或作用时间的增加,上清液中VEGF表达增加。当AGE浓度为100 mg·L-1或作用时间为8 h时,VEGF表达最高。AGE组VEGF水平与对照组比较差异均有统计学意义(均为P<0.01),各AGE组组间比较差异均有统计学意义(均为P<0.01)。细胞免疫荧光结果显示:加入AGE后,磷酸化p44/42和磷酸化Akt荧光增强,即表达增加(图1-图2)。

表1 AGE作用不同时间对VEGF表达的影响

表2 不同浓度AGE对VEGF表达的影响

Figure 1 Expression of AGE and phosphorylation p44/42.Green fluorescence directed by arrow was phosphorylated p44/42.A:Blank control group;B:100 mg·L-1 AGE group AGE与磷酸化p44/42的表达。箭头所指绿色荧光为磷酸化p44/42免疫标记荧光。A:空白对照组;B:100 mg·L-1 AGE组
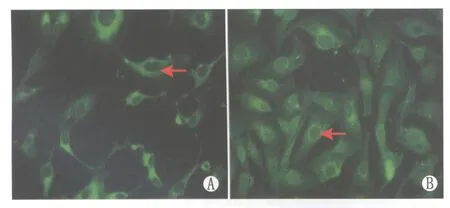
Figure 2 Expression of AGE and phosphorylation Akt.Green fluorescence directed by arrow was phosphorylated Akt.A:Blank control group;B:100 mg·L-1 AGE group AGE与磷酸化Akt的表达。箭头所指绿色荧光为磷酸化Akt免疫标记荧光。A:空白对照组;B:100 mg·L-1 AGE组
2.2PD98059和LY294002对AGE诱导的VEGF表达的影响加入PD98059或LY294002后,VEGF表达明显下降,加入0 μmol·L-1、10 μmol·L-1、20 μmol·L-1、40 μmol·L-1PD98059后,100 mg·L-1AGE诱导ARPE-19细胞VEGF表达分别为(201.40±7.63)pg·L-1、(107.13±4.60)pg·L-1、(57.35±5.29)pg·L-1、(75.77±3.62)pg·L-1;加入0 μmol·L-1、10 μmol·L-1、30 μmol·L-1、60 μmol·L-1LY294002后,100 mg·L-1AGE诱导ARPE-19细胞VEGF表达分别为(222.92±6.28)pg·L-1、(133.14±5.06)pg·L-1、(81.51±8.10)pg·L-1、(112.55±4.06)pg·L-1。磷酸化p44/42和磷酸化Akt表达也下降(图3-图4),其下降程度随阻断剂浓度增高而加大,即VEGF表达与PD98059和LY294002有剂量依赖关系(P<0.01)。但PD98059和LY294002不能完全阻断AGE诱导的VEGF表达,表现为单独加入PD98059或LY294002,VEGF表达仍与AGE剂量和作用时间呈依赖关系(P<0.01,表3-表4,图3)。同时加入PD98059和LY294002,VEGF表达与AGE作用时间无关(P>0.05,见图5)。

表3 PD98059作用下VEGF表达与AGE浓度的关系

表4 LY294002作用下VEGF表达与AGE浓度的关系
3 讨论
信号转导和调控的有序是高等动物发育、生长、进化的必要条件之一。如果信号转导控制失调,细胞的运行周期和基因表达就会失控而导致疾病发生。DR的发生涉及一系列信号分子的激活。p44/42 MAPK和PI3K/Akt是两个重要的细胞内信号转导途径,可被多种胞外刺激信号如生长因子、激素等激活。有研究表明它们在眼内的作用非常广泛,VEGF的许多生物学功能都需要它们的参与[6-7]。赵炜等[8]研究证实,p42/p44 MAPK信号转导通路参与了缺氧诱导的人RPE细胞VEGF的表达。Zhou等[9]研究发现,H2O2可以通过PI3K/Akt/NF-κB通路上调人脐静脉血内皮细胞VEGF的表达。组织缺氧和氧化应激是DR的重要病理生理机制[10-11],那么p42/p44 MAPK和PI3K/Akt两个信号通路是否参与了DR病变过程中VEGF的表达呢?

Figure 3 Expression of phosphorylation p44/42 induced by AGE with different concentrations of PD98059.Green fluorescence directed by arrow was phosphorylated p44/42.A:Blank control group;B,C,D:10 μmol·L-1,20 μmol·L-1,40 μmol·L-1 PD98059 group 不同浓度PD98059与AGE诱导下磷酸化p44/42的表达。箭头所指绿色荧光为磷酸化p44/42免疫标记荧光。A:空白对照组;B、C、D分别为10 μmol·L-1、20 μmol·L-1、40 μmol·L-1 PD98059组

Figure 4 Expression of phosphorylation Akt induced by AGE with different concentrations of LY294002.Green fluorescence directed by arrow was phosphorylated Akt.A:Blank control group;B,C,D:10 μmol·L-1,30 μmol·L-1,60 μmol·L-1 LY294002 group 不同浓度LY294002与AGE诱导下磷酸化Akt的表达。箭头所指绿色荧光为磷酸化Akt免疫标记荧光。A:空白对照组;B、C、D分别为10 μmol·L-1、30 μmol·L-1、60 μmol·L-1 LY294002组

Figure 5 Expression of VEGF at different time after blocked of p44/42 and/or PI3K 阻断p44/42和PI3K后不同时间点VEGF表达
本实验证实,AGE可以使ARPE-19细胞表达VEGF增加,同时磷酸化p44/42和Akt信号分子表达增强。加入p44/42阻断剂PD98059或PI3K阻断剂LY294002后,VEGF和两个信号分子的表达明显降低,说明p44/42 MAPK和PI3K/Akt信号通路参与了AGE诱导的ARPE-19细胞VEGF的表达。但只阻断一个通路,VEGF表达仍随AGE浓度和作用时间而增加,同时阻断两个信号通路,AGE介导的VEGF过表达被完全阻断,说明AGE诱导的ARPE-19细胞过表达VEGF是由p44/42 MAPK和PI3K/Akt两个信号通路介导的,只阻断一个通路,细胞仍能通过另一通路表达VEGF。本实验还发现PD98059和LY294002对人RPE细胞表达VEGF的抑制作用具有剂量依赖关系,但两者浓度分别到达40 μmol·L-1和60 μmol·L-1后,其对VEGF表达的抑制作用不再增强。
有研究发现抑制PI3K/P70S6K活化后,p44/42的活化也被抑制,反之不会出现类似结果,提示PI3K除作用于Akt外,还位于p44/42的上游,控制p44/42通路[8]。本实验中,我们比较分别阻断两个通路后AGE作用时间与VEGF表达的关系,差异无统计学意义(P>0.05)。可能在本过程中,PI3K对p44/42的激活作用并不显著。本实验证实,p44/42 MAPK和PI3K/Akt信号通路与AGE诱导的人RPE细胞表达VEGF具有显著相关性,p44/42 MAPK和PI3K/Akt信号通路很可能是DR患者新生血管生成和血管渗漏的重要机制。PD98059和LY294002可以阻断这一过程,但它们能否成为治疗DR的有效药物尚需进一步研究。
1 Ozturk BT,Bozkurt B,Kerimoglu H,Okka M,Kamis U,Gunduz K.Effect of serum cytokines and VEGF levels on diabetic retinopathy and macular thickness[J].MolVis,2009,19(15):1906-1914.
2 Kim YS,Jung DH,Lee IS,Choi SJ,Yu SY,Ku SK,etal.Effects of allium victorialis leaf extracts and its single compounds on aldose reductase,advanced glycation end products and TGF-β1 expression in mesangial cells[J].BMCComplementAlternMed,2013,3(13):251-254.
3 Binion DG,Otterson MF,Rafiee P.Curcumin inhibits VEGF-mediated angiogenesis in human intestinal microvascular endothelial cells through COX-2 and MAPK inhibition[J].Gut,2008,57(11):1509-1517.
4 Wu M,Xu T,Zhou Y,Lu H,Gu Z.Pressure and inflammatory stimulation induced increase of cadherin-11 is mediated by PI3K/Akt pathway in synovial fibroblasts from temporomandibular joint[J].OsteoarthrCartilage,2013,21(10):1605-1612.
5 Li W,Xu H,Hu Y,He P,Ni Z,Xu H,etal.Edaravone protected human brain microvascular endothelial cells from methylglyoxal-induced injury by inhibiting AGEs/RAGE/oxidative stress[J].PLoSOne,2013,8(9):e76025.
6 Yun SP,Lee MY,Ryu JM,Song CH,Han HJ.Role of HIF-1alpha and VEGF in human mesenchymal stem cell proliferation by 17beta-estradiol:involvement of PKC,PI3K/Akt,and MAPKs[J].AmJPhysiolCellPhysiol,2009,296(2):317-326.
7 Cheng Y,Jiang S,Hu R,Lv L.Potential mechanism for endothelial progenitor cell therapy in acute myocardial infarction:Activation of VEGF-PI3K/Akte-NOS pathway[J].AnnClinLabSci,2013,43(4):395-401.
8 赵炜,王雨生,张瑞,张鹏,惠延年.p42/44 MAPK信号转导通路在缺氧诱导的人视网膜色素上皮细胞VEGF表达中的作用[J].眼科新进展,2004,24(2):109-112.
9 Zhou M,Song X,Huang Y,Wei L,Li Z,You Q,etal.Wogonin inhibits H2O2-induced angiogenesis via suppressing PI3K/Akt /NF-κB signaling pathway[J].VasculPharmacol,2014,60(3):110-119.
10 Rodrigues M,Xin X,Jee K,Babapoor-Farrokhran S,Kashiwabuchi F,Ma T,etal.VEGF secreted by hypoxic müller cells induces MMP-2 expression and activity in endothelial cells to promote retinal neovascularization in proliferative diabetic retinopathy[J].Diabetes,2013,62(11):3863-3873.
11 Tarr JM,Kaul K,Chopra M,Kohner EM,Chibber R.Pathophysiology of diabetic retinopathy[J].ISRNOphthalmol,2013,2013:343560.
12 Zubilewicz A,Hecquet C,Jeanny J,Soubrane G,Courtois Y,Mascarelli F.Proliferation of CECs requires dual signalling through both MAPK/ERK and PI3K/AKt pathways[J].InvestOphthalmolVisSci,2001,42(2):488-496.
