新型异亮氨酸双加氧酶及其重组大肠杆菌合成羟基异亮氨酸
2014-07-05付敏杰聂尧穆晓清徐岩肖荣
付敏杰, 聂尧, 穆晓清, 徐岩,2, 肖荣
(1江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122;2江南大学食品生物技术国家重点实验室,江苏 无锡 214122;3罗格斯大学高级生物技术与医学中心,新泽西州 08854,美国)
新型异亮氨酸双加氧酶及其重组大肠杆菌合成羟基异亮氨酸
付敏杰1, 聂尧1, 穆晓清1, 徐岩1,2, 肖荣3
(1江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122;2江南大学食品生物技术国家重点实验室,江苏 无锡 214122;3罗格斯大学高级生物技术与医学中心,新泽西州 08854,美国)
异亮氨酸双加氧酶(IDO)可特异性的转化底物L-异亮氨酸(L-Ile)生成4-羟基-L-异亮氨酸(4-HIL),该产物具有促进胰岛素分泌的功能,可用于抗糖尿病、降胆固醇等。本研究结合了酶标显色和薄层层析(TLC)的方法从自然界中筛到了具有IDO活性的菌株,并将该菌株中的目的基因ido克隆到大肠杆菌中,获得重组表达菌株,并且验证该菌具有IDO的转化功能。本研究优化了转化反应体系和条件,同时通过30℃过夜温育菌体细胞的方法,使该菌株全细胞转化合成4-HIL的产率达到85%以上。
异亮氨酸双加氧酶;异亮氨酸;羟基异亮氨酸; 生物转化; 重组表达
4-羟基-L-异亮氨酸(4-HIL)是一种新型胰岛素分泌促进剂,可用于治疗Ⅱ型糖尿病。而关于4-HIL的合成已有一些相关报道,Wang等[1]研究了一种有效的八步合成4-HIL的方法,其转化总产率为39%,该方法的关键步骤是利用Geotrichum candidum生物转化2-甲基乙酰乙酸乙酯生成(2S,3R)-2-甲基-3-羟基丁酸已酯,接着将上述反应的产物作不对称斯特雷克尔合成(是一种从α-羟基腈制备氨基酸的合成法)。Rolland-Fulcrand等[2]研究了有6个步骤完全控制立体化学酶合成4-HIL的方法,该方法最后一步是利用商业化应用的固定化青霉素酰化酶G酶解拆分(N)-苯乙酰内酯衍生物。Smirnov等[3-4]利用4-羟基-3-甲基-2-酮基-戊酸盐醛缩酶和支链氨基酸氨基转移酶的双酶偶联,经过两步反应将乙醛、α-酮基丁酸盐和L-谷氨酸转化生成4-HIL。
Haefelé等[5]发现在葫芦巴种子中4-羟基-L-异亮氨酸的合成过程中有双加氧酶,当有Fe2+、α-酮戊二酸(α-KG)、抗坏血酸和氧气存在时,该酶可一步催化合成4-HIL,此后关于该酶的研究才开始逐渐深入。Kodera等[6]从Bacillus thuringiensis中发现了可一步催化合成4-HIL的L-异亮氨酸双加氧酶(IDO),即L-异亮氨酸羟基化酶,探索该酶催化合成4-HIL的路线,如图1所示,IDO催化底物L-异亮氨酸发生羟基化,生成4-HIL;该研究通过质谱分析发现,芽孢杆菌产羟基化酶催化底物L-异亮氨酸,转化产物为4-HIL。

图1 合成4-羟基-L-异亮氨酸的新型路径
Ogawa等[6-9]筛选得到了一株产IDO的苏云金芽孢杆菌,并对该菌中IDO的酶学性质和生物转化代谢过程进行了研究,进而将该酶的基因ido克隆到E. coli中进行表达,并从基因水平对表达进行了调控,最终使得IDO催化Ile生产4-HIL的产率最高达82%。
虽然已有开展生物催化转化羟基异亮氨酸研究的相关报道,但能够羟基化脂肪族氨基酸的双加氧酶的资源仍然有限。目前,只有日本的一个研究小组有此方面相关报道,而且其在基因水平上调控的克隆菌株的转化反应水平也较为有限。本研究致力于开发新型催化剂,设计新的筛菌方案,结合酶标显色检测和薄层层析检测两种筛选方法,从自然界筛选有双加氧酶基因的菌株,并对其功能基因进行克隆,通过诱导使重组酶获得表达,得到的重组菌用于全细胞不对称转化,并对转化条件和体系进行优化,使得无基因修饰的原始重组菌的转化水平高于已有的报道,探索得到了更经济的生物转化条件。
1 材料和方法
1.1 材料
1.1.1 菌种和质粒
含双加氧酶基因的菌株Bacillussp.从各地采集的土样中筛选得到;大肠杆菌E. coliJM109、BL21 (DE3)感受态细胞由本文作者所在实验室保藏。
pET-28a(+)质粒,本文作者所在实验室保藏。
1.1.2 主要试剂与仪器
LATaqDNA Polymerase、T4 DNA Ligase、限制性内切酶SalI和NcoI、DNA marker,TaKaRa公司;Isopropylβ-D-1-Thiogalactopyranoside(IPTG),上海生工生物工程公司;细菌基因组提取试剂盒,北京天根生化科技有限公司;质粒提取试剂盒、胶回收试剂盒,OMEGA BIO-TEK。引物由上海生工生物工程公司合成。
标准品L-异亮氨酸(L-Ile)、4-羟基-L-异亮氨酸(4-HIL)为色谱纯;乙腈、甲醇为色谱级;其他试剂药品均为分析纯。
恒温水浴锅,上海华连医疗器械有限公司;PCR仪、DNA电泳仪、蛋白电泳仪、凝胶成像仪,购自Bio-Rad公司;酶标仪,Thermo公司;高效液相色谱仪,Waters公司。超声清洗机SB-25-12D,宁波新芝生物科技股份有限公司。
1.1.3 培养基
LB培养基:蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,pH7.0(固体培养基加入15%琼脂)。
营养琼脂培养基:牛肉膏3g/L,蛋白胨10g/L,NaCl 5g/L,琼脂15%,pH7.0。
发酵培养基:可溶性淀粉4g/L,酵母提取物4g/L,麦芽提取物10g/L,底物L-Ile 2g/L,pH7.0。
IDO肉汤培养基:可溶性淀粉4g/L,葡萄糖4g/L,MgSO4·7H2O 0.11g/L,CaCl20.11g/L,底物L-Ile 2,pH7.0。
1.2 菌株筛选方法
1.2.1 芽孢杆菌的筛选
将从各地采集的10份土样各取0.5g于5 mL生理盐水中充分打散,制成悬浮液,在70~80℃水浴中热处理15~20min后,将悬浮液静置取上清为100梯度,再将其稀释成10-1、10-2梯度,这3个梯度的土壤悬液涂布到营养琼脂平板上,37℃培养。挑取单菌落,即为芽孢杆菌,作进一步筛选。
1.2.2 酶标显色检测方法
根据文献[10],加氧酶生物转化的产物经过酸化后转化成的酚,可与Gibbs试剂作用显色,并且有明显的吸收光谱,因此可通过酶标板用Gibbs试剂对加氧酶活性进行筛选。本研究根据这一原理设计了如下检测方法。
接种针挑取芽孢杆菌单菌落接种到含500μL发酵培养基的96孔酶标板中,37℃、200r/min振荡培养2 天,然后加入500μL溶有15mmol/L氯苯的发酵培养基,用膜包住板,于37℃、200r/min振荡培养,12 h后将板离心,取上清100μL加入到酶标板孔中,再加入100μL 0.1mmol/L HCl,将酶标板于37℃静置30min,然后分别加入20μL 1mol/L Tris-HCl(pH8.5)和25μL 0.4% Gibbs乙醇溶液,于室温下反应40min后,用酶标仪检测在652nm下的吸光度值。
1.2.3 薄层层析(TLC)检测方法
根据氨基酸薄层层析茚三酮显色方法的原理,本研究采用硅胶板薄层分配层析来分离检测氨基酸,当展开剂随着点过样的层析板迁移时,由于样品中不同氨基酸在展开剂中的分配系数不同,迁移速度也不同,从而达到分离的目的。层析结束后,将层析板置于烘箱中烘干至板上出现氨基酸斑点。
将筛到的芽孢杆菌接种到96孔板中的1mL发酵培养基中,28℃、200r/min振荡培养2 天,培养液离心,取上清0.25μL点样进行层析。展开剂∶正丁醇∶乙酸∶水=4∶1∶0.5(质量比),显色剂为0.3%茚三酮,溶于展开剂中。
1.3 基因组DNA提取和质粒的提取
芽孢杆菌基因组的提取参照细菌基因组提取试剂盒说明书方法(北京天根生化科技有限公司)。
质粒提取参照质粒提取试剂盒说明书的方法(TaKaRa公司)。
1.4 目的基因ido的克隆
根据已报道的IDO双加氧酶基因(GenBank Accession No. KC884243.1),在NCBI上BLAST后,根据相关基因的同源性设计了以下简并引物。
上游引物I-F-NcoⅠ为

下游引物I-R-SalⅠ为
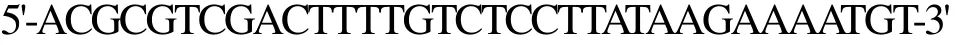
以筛选到的芽孢杆菌基因组为模板,采用PCR方法扩增ido基因,扩增条件为:95℃预变性5min; 95℃ 1min,56℃ 1min,72℃ 1min,进行30个循环;72℃延伸10min。取5μL PCR产物,用1%琼脂糖凝胶电泳检测。PCR产物经胶回收纯化后与pMD19-T在16℃下连接4 h,连接产物用热激发转化到E. coliJM109感受态细胞中,转化细胞经培养后,提取质粒酶切验证,获得阳性重组质粒pMD19-T-ido。基因测序由上海生工生物工程公司完成。
1.5 重组表达载体的构建
根据上述测序结果,设计以下表达引物用于PCR。
上游引物I-F-NcoⅠ为

下游引物I-R-SalⅠ为

PCR产物纯化后用限制性内切酶NcoI和SalI酶切,同时双酶切载体pET-28a,胶回收pET-28a的线性质粒和目的基因,用T4 DNA Ligase连接载体和目的基因在16℃下过夜,连接产物转化E. coliBL21(DE3)感受态细胞,涂布卡那抗生素平板,通过对转化子酶切验证和测序,确认获得阳性克隆E. coliBL21/pET-28a-ido。
1.6 目的基因ido诱导表达
重组菌的单菌落接种到含有卡那抗生素的3mL LB液体培养基中,37℃、200r/min振荡培养过夜。取1mL种子液转接至含有卡那抗生素的LB液体培养基中,于37℃、200r/min振荡培养至OD600约为0.6~0.8。向培养基中加入终浓为0.5mmol/L的IPTG,于30℃、200r/min进行诱导培养过夜。细胞总蛋白和胞内蛋白含量经SDS-PAGE检测。
1.7 重组菌生物转化反应
发酵获得的菌体,经生理盐水洗涤2次后,用50mmol/L pH8.0的Tris-HCl缓冲液悬浮备用。
生物转化反应体系(2mL):20%的湿菌体,10mmol/L L-Ile底物,10mmol/Lα-KG,0.5mmol/L FeSO4·7H2O,10mmol/L 抗坏血酸,50mmol/L pH8.0 的Tris-HCl缓冲液。
生物转化条件:28℃,200r/min反应1 h。
1.8 生物转化反应条件优化
1.8.1 转化反应体系优化
分别对1.7节中所述反应体系各物质进行单因素考察,单因素分别为菌体细胞(0~50%)、α-KG (0~50mmol/L)、FeSO4·7H2O(0~2mmol/L)、抗坏血酸(0~50mmol/L)、L-Ile(0~120mmol/L)。
1.8.2 转化反应条件优化
保持1.7节中反应体系成分不变的情况下,分别从不同反应pH值(7.5、8.0、8.5、9.0、9.5、10)和不同反应时间(1 h、5 h、10 h、15 h、20 h、25 h)上来比较重组酶IDO酶活水平,寻找最佳转化条件。
1.8.3 转化反应优化策略
根据文献[11],不同温度处理过的菌体用来作反应,转化效果更好。本研究将菌体悬浮液分别在20℃、30℃、37℃温育12 h,然后再做反应,同时将反应体系的物质浓度提高2倍,考察转化情况。
1.9 底物与产物的分析检测方法
1.9.1 反应液衍生化
反应结束后,反应液离心,取250μL上清转移到5mL离心管中,加入250μL 2mol/L pH9.2的硼酸缓冲液,再加入500μL 5倍过量的芴甲氧羰酰氯(Fmoc-Cl)乙腈溶液,待衍生化反应完成后加入500μL对Fmoc-Cl两倍过量的2-氨基金刚烷(ADAM)的乙腈/水(1∶1,体积比)溶液,阻止过量的Fmoc-Cl水解。溶液用0.22μm的有机膜过滤后用HPLC检测。1.9.2 HPLC检测条件
Diomansil C18柱(250mm×4.6mm),流速1.0mL/min,紫外检测器263nm,流动相A为50mmol/L 的NaAc-HAc 缓冲体系,pH值为4.2,流动相B为乙腈。采用50∶50等度洗脱。
2 结果与讨论
2.1 产双加氧酶菌株的筛选
根据文献,产双加氧酶的微生物种类较多,如Rhodococcus[12]、Pseudomonas[13-15]、Klebsiella[16]、Exophiala[17]、Bacillus[6,18-19]、Aspergillus[20]等,因为芽孢杆菌中的双加氧酶在转化羟基化方面酶活较高,转化性能较好[6,21-22],因此本研究利用专一性筛选芽孢杆菌的方法从土样中筛选获得芽孢杆菌,按1.2.1节的方法从自然界土样中共得到芽孢杆菌579株。
将得到的芽孢杆菌分别按照酶标显色检测和TLC检测两种筛选方法进行进一步的筛选,结果如图2所示。通过酶标显色方法共得到364株菌株,显色为深蓝色[如图2(a)所示,显色越深,吸光度值越大];将这364株菌株再通过TLC检测,共得到56株候选菌株。从以上筛选得到的菌株中选取酶标仪检测值高,且TLC检测目的产物斑较大的菌株[如图2(b)所示],可初步确定其具有加氧酶酶活。

图2 酶标板的反应显色和TLC检测的产物斑
2.2 加氧酶基因的克隆与表达
以筛选到的芽孢杆菌中筛选现象最明显的菌株基因组DNA为模板,用设计的简并引物进行PCR,PCR后得到的目的条带经纯化与pMD19-T载体连接,经酶切鉴定,获得重组质粒pMD19-T-ido。基因测序结果显示基因长度723 bp,编码240个氨基酸;IDO氨基酸序列比对结果如图3所示,与其他7个类似蛋白的氨基酸序列一致性达96.65%。目的基因表达产物的序列分析表明,本研究筛选获得的菌株含有一种新型的潜在双加氧酶。
用表达引物通过PCR从重组质粒pMD19-T-ido中调取ido基因,构建重组的表达质粒pET 28a-ido,并将其转化至E. coliBL21(DE3)感受态细胞中。重组菌经IPTG诱导,SDS-PAGE分析可知,重组菌在接近29 kDa处比对照多出一条蛋白条带,表明重组酶IDO在大肠杆菌中获得表达,其相对分子质量约为31 kDa。对IPTG的浓度进行优化可知,当IPTG浓度为0.5mmol/L时,可溶性蛋白表达量较大,在0.5mmol/L IPTG的诱导情况下,诱导温度的优化结果如图4所示,由图4可知,在30℃时的可溶性蛋白表达量最大。因此该重组菌诱导表达的最佳温度定为30℃,IPTG浓度定为0.5mmol/L。

图3 加氧酶氨基酸序列比对结果
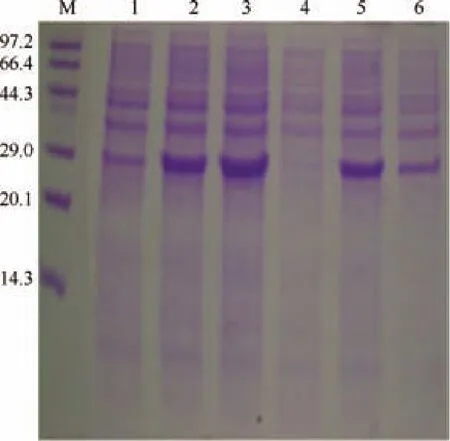
图4 重组蛋白的诱导表达

图5 α-KG浓度对产率的影响
2.3 重组菌转化反应
2.3.1 反应体系组成对转化效率的影响
根据实验结果,发现全细胞转化产率总体优于粗酶液转化体系,因此本实验选取全细胞转化体系进行下一步的优化。反应体系和反应条件的优化结果如下。
由于双加氧酶IDO催化Ile羟基化生成4-HIL的过程与α-KG生成琥珀酸的过程相偶联,所以α-KG是作为该催化反应的辅底物参与上述反应,由图5可知当α-KG的浓度在0~40mmol/L变化时,转化产率变化不大,超过40mmol/L,产率急剧下降至0。根据文献[6],α-KG是该转化反应所必需的,从图5可以发现,当不添加α-KG时,转化反应的产率也在60%以上,这与已有报道酶液反应体系不同,可能是由于细胞内源的α-KG在参与反应,解决了酶液反应体系所不能克服的辅底物α-KG的循环再生、Ile羟基化反应与α-KG转化为琥珀酸反应的偶联等问题,体现了全细胞反应体系的优势。
抗坏血酸并不是双加氧酶IDO转化反应所必需的,但却可以极大地促进反应速率[6],因此由图6可看出,其对反应产率的影响不大,抗坏血酸浓度在0~50mmol/L变化时,产率都维持在60%左右,但总体呈现先上升后维持不变的趋势,因此全细胞转化体系只需在反应前期补充少量抗坏血酸即可满足反应所需,与已报道的酶液反应体系相比,该转化体系在资源消耗方面更经济。
根据文献[23],多数双加氧酶催化反应时要利用铁离子金属中心与底物等物质发生作用,因此亚铁离子是该酶促反应所必需的。由图7可知,随着亚铁离子浓度的增大,产率也逐渐增大,当亚铁离子浓度为0.5mmol/L时,产率达到最大,且之后随着亚铁离子浓度的增大,产率基本保持不变。
作为该转化反应的关键底物,Ile的影响尤为重要。由图8可知,底物浓度对产率的影响呈罩钟形,随着底物浓度的增大,产率先增大后减小,在底物浓度为10mmol/L左右达到最大。当底物浓度大于10mmol/L时,体系表现出明显的底物抑制。
2.3.2 反应条件对转化效率的影响
由图9知该重组菌的全细胞转化体系在pH值中性左右产率变化不大,在pH值为7.5时产率相对其他略微偏高,随着pH值的增大,产率逐渐下降。有文献报道[11],在碱性条件下,构成细胞细胞膜的双脂层可能被部分溶解,扩大了细胞通道,有利于产物可底物的进出细胞,从而使细胞表现出更高的酶活性,这可能是导致pH值为9.5时产率较高的原因。
反应体系温度影响菌体细胞所产酶的催化活性[24],由图10知温度对该转化反应影响不大,产率随着温度的上升总体呈现先上升后下降的趋势,在28℃时,转化反应产率相对较高。
2.3.3 细胞质量分数对转化效率的影响

图7 亚铁离子浓度对产率的影响

图8 异亮氨酸浓度对产率的影响
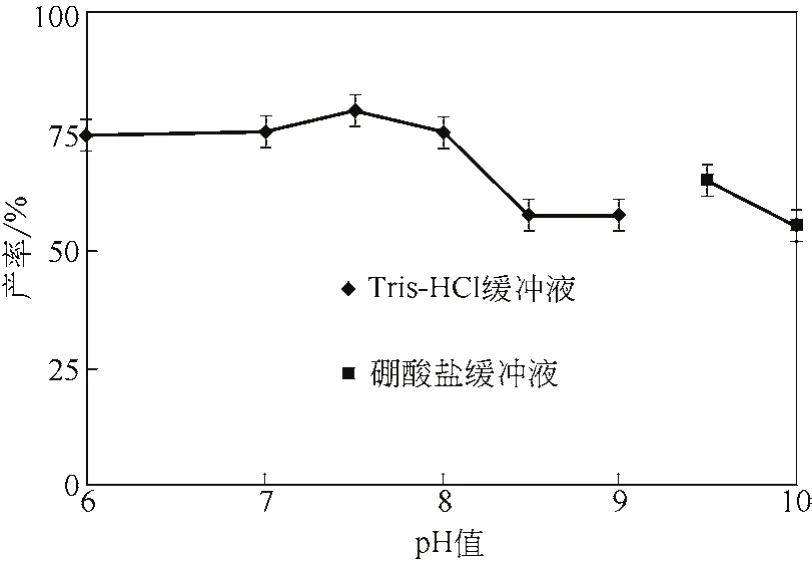
图9 反应体系pH值对产率的影响
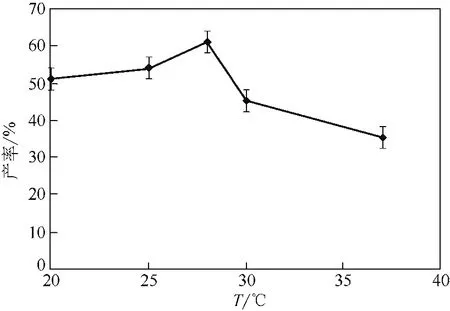
图10 反应体系温度对产率的影响
双加氧酶IDO催化的反应需要氧气参与,体系中细胞的多少影响着氧气的利用速率和效果,进而影响反应的产率。由图11所示,细胞质量分数对产率的影响与常规反应现象不同的是,在细胞质量分数5%时产率已达最高,可达84%,随着细胞质量分数的增大,因反应体系黏度过大,物质传递以及氧气供应都受限,产率急剧下降。

图11 细胞质量分数对产率的影响
2.3.4 过夜温育细胞对转化效率的影响
根据文献[11],在不同温度(低于酶失活温度)下处理过的菌体,其细胞结构可能发生变化,致使部分酶扩散至细胞外,部分消除了物质进出细胞的扩散限制,从而使这种细胞的转化效果更好。从图12可以看出,在底物浓度为20mmol/L时,经过20℃、30℃温育后,体系的转化产率明显高于对照组,且在30℃温育后的菌体的转化产率达85%以上,因此本研究利用该方法在全细胞转化体系的底物浓度为20mmol/L时,将转化率提高至85%以上。
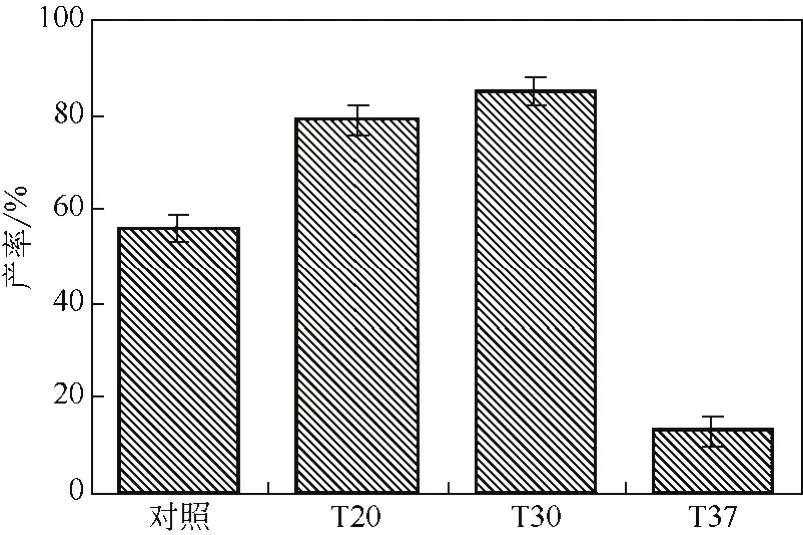
图12 不同温度温育后的菌体的转化产率
3 结 论
本研究以异亮氨酸Ile为底物,从自然界土样中筛选得到的芽孢杆菌出发,通过酶标显色筛选和薄层层析(TLC)筛选得到一株有双加氧酶IDO活性的菌株,可将L-Ile特异性的转化成4-羟基-L-异亮氨酸(4-HIL)。通过PCR获得新型双加氧酶基因ido,并将其克隆表达,获得重组菌,对该重组菌的诱导条件进行优化,确定最佳诱导条件为0.5 mmol/L的IPTG浓度和30℃的诱导温度。重组菌诱导表达后获得的菌体用于全细胞体系的生物转化反应,检测到IDO酶特异性催化L-Ile形成的4-HIL,验证了重组酶的活性。对以上全细胞转化的反应条件和反应体系进行优化,发现细胞浓度、底物L-Ile、FeSO4·7H2O的配比为5%、10mmol/L、0.5mmol/L,在pH 值为7.5、28℃条件下,转化效果最好;且当底物浓度较低时,不加α-KG和抗坏血酸即可满足反应所需,当底物浓度较高时,可适量补充这两种物质。为增大底物量,本研究采取30℃温育过夜的细胞来转化反应,在底物L-Ile 浓度为20mmol/L时,可以达到85%以上的产率。本研究对ido基因的筛选和克隆表达以及对重组菌的转化反应优化、不对称合成4-HIL的应用提供了基础。
[1] Wang Q,Ouazzani J,Sasaki N A,et al. A practical synthesis of (2S,3R,4S)-4-hydroxyisoleucine:A potent insulinotropicα-amino acid from fenugreek[J].Eur. J. Org. Chem.,2002,5:834-839.
[2] Rolland-Fulcrand V,Rolland M,Roumestant M L,et al. Chemoenzymatic synthesis of enantiomerically pure (2S,3R,4S)-4-hydroxyisoleucine,an insulinotropic amino acid isolated from fenugreek seeds[J].Eur. J. Org. Chem.,2004,4:873-877.
[3] Ogawa J,Yamanaka H,Mano J,et al. Synthesis of 4-hydroxyisoleucine by the aldolase–transaminase coupling reaction and basic characterization of the aldolase fromArthrobacter simplexAKU 626[J].Bioscience,Biotechnology,and Biochemistry,2007,71(7):1607-1615.
[4] Smirnov S V,Samsonova N N,Novikova A E,et al. A novel strategy for enzymatic synthesis of 4-hydroxyisoleucine:identification of an enzyme possessing HMKP (4-hydroxy-3-methyl-2-keto-pentanoate) aldolase activity[J].FEMS Microbiol. Lett.,2007,273(1):70-77.
[5] Haefelé C,Bonfils C,Sauvaire Y. Characterization of a dioxygenase fromTrigonella foenum-graecuminvolved in 4-hydroxyisoleucine biosynthesis[J].Phytochemistry,1997,44(4):563-566.
[6] Kodera T,Smirnov S V,Samsonova N N,et al. A novel l-isoleucine hydroxylating enzyme,l-isoleucine dioxygenase from Bacillus thuringiensis,produces (2S,3R,4S)-4-hydroxyisoleucine[J].Biochem. Biophys. Res. Commun.,2009,390(3):506-510.
[7] Hibi M,Kawashima T,Kodera T,et al. Characterization ofBacillus thuringiensisL-isoleucine dioxygenase for production of useful amino acids[J].Appl. Environ. Microbiol.,2011,77(19):6926-6930.
[8] Ogawa J,Kodera T,Smirnov S V,et al. A novel l-isoleucine metabolism inBacillus thuringiensisgenerating (2S,3R,4S)-4-hydroxyisoleucine,a potential insulinotropic and anti-obesity amino acid[J].Appl. Microbiol. Biotechnol.,2011,89 (6):1929-1938.
[9] Smirnov S V,Kodera T,Samsonova N N,et al. Metabolic engineering ofEscherichia colito produce (2S,3R,4S)-4-hydroxyisoleucine[J].Appl. Microbiol. Biotechnol.,2010,88(3):719-726.
[10] Joern J M,Sakamoto T,Arisawa A,et al. A versatile high throughput screen for dioxygenase activity using solid-phase digital imaging[J].Journal of Biomolecular Screening,2001,6(4):219-223.
[11] 赵玉巧,许建和. 不动杆菌静息细胞催化拆分外消旋环戊酮醇乙酸酯反应条件的优化[J]. 催化学报,2003,8(24):613-618.
[12] Matsumura E,Ooi S,Murakami S,et al. Constitutive synthesis,purification,and characterization of catechol 1,2-dioxygenase from the aniline-assimilating bacteriumRhodococcussp. AN-22[J].J. Biosci. Bioeng.,2004,98(2):71-76.
[13] Wang C L,You S L,Wang S L. Purification and characterization of a novel catechol 1,2-dioxygenase fromPseudomonas aeruginosawith benzoic acid as a carbon source[J].Process Biochem.,2006,41 (7):1594-1601.
[14] Yeo C C,Wong M V M,Feng Y,et al. Molecular characterization of an inducible gentisate 1,2-dioxygenase gene,xlnE,fromPseudomonas alcaligenesNCIMB 9867[J].Gene,2003,312:239-248.
[15] Zhou N Y,Fuenmayor S L,Williams P A.naggenes ofRalstonia(formerlyPseudomonas) sp. strain U2 encoding enzymes for gentisate catabolism[J].J. Bacteriol.,2001,183(2):700-708.
[16] Suárez M,Ferrer E,Martín M. Purification and biochemical characterization of gentisate 1,2-dioxygenase fromKlebsiella pneumoniaeM5a1[J].FEMS Microbiol. Lett.,1996,143(1):89-95.
[17] Gunsch C K,Cheng Q,Kinney K A,et al. Identification of a homogentisate-1,2-dioxygenase gene in the fungus Exophiala lecanii-corni:Analysis and implications[J].Appl. Microbiol. Biotechnol.,2005,68(3):405-411.
[18] Gopal B,Madan L L,Betz S F,et al. The crystal structure of a quercetin 2,3-dioxygenase from Bacillus subtilis suggests modulation of enzyme activity by a change in the metal ion at the active site (s)[J].Biochemistry,2005,44(1):193-201.
[19] Smirnov S V,Sokolov P M,Kodera T,et al. A novel family of bacterial dioxygenases that catalyse the hydroxylation of free l-amino acids[J].FEMS Microbiol. Lett.,2012,331(2):97-104.
[20] Fusetti F,Schröter K H,Steiner R A,et al. Crystal structure of the copper-containing quercetin 2,3-dioxygenase fromaspergillus japonicus[J].Structure,2002,10(2):259-268.
[21] Que L,Widom J,Crawford R. 3,4-Dihydroxyphenylacetate 2,3-dioxygenase. A manganese (Ⅱ) dioxygenase fromBacillus brevis[J].Journal of Biological Chemistry,1981,256(21):10941-10944.
[22] Wolgel S,Dege J,Perkins-Olson P,et al. Purification and characterization of protocatechuate 2,3-dioxygenase fromBacillus macerans:A new extradiol catecholic dioxygenase[J].J. Bacteriol.,1993,175(14):4414-4426.
[23] 聂尧,付敏杰,徐岩. 不同微生物来源的加氧酶及其催化反应特征的研究进展[J]. 生物加工过程,2013,11(1):87-93.
[24] 张笮晦,刘雄民,马丽,等. 生物催化肉桂醇制备3-苯丙醇[J]. 化工进展,2010,29(12):2368-2372.
A novel isoleucine dioxygenase and its expression in recombinant Escherichia coli for synthesis of 4-hydroxyisoleucine
FU Minjie1,NIE Yao1,MU Xiaoqing1,XU Yan1,2,XIAO Rong3
(1School of Biotechnology,Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,Jiangsu,China;2State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,
Jiangsu,China;3Center for Advanced Biotechnology and Medicine,Rutgers University,New Jersey 08854,USA)
:Isoleucine dioxygenase (IDO) could hydroxylyze L-isoleucine (L-Ile) to produce 4-hydroxy-L-isoleucine (4-HIL),which increases glucose-induced insulin release and is usually used in pharmaceuticals with antidiabetic and cholesterol-reducing properties. The strain with dioxygenase activity was screened from natureviacombination of reaction coloration assayed by spectrophotometer and thin-layer chromatography (TLC). The gene encoding IDO (ido) was cloned and expressed inEscherichia coliand the constructed recombinant strain exhibited the function of isoleucine hydroxylation. The reaction conditions were optimized and the yield of transformation with the recombinant whole cells was increased to more than 85% by incubating the cells overnight at 30℃. The newly identified IDO and involved recombinant whole cells would be promising to prepare 4-HIL with high efficiency.
isoleucine dioxygenase; isoleucine; hydroxyl isoleucine; biotransformation; recombinant expression
Q 815
A
1000-6613(2014)11-3037-08
10.3969/j.issn.1000-6613.2014.11.034
2014-02-27;修改稿日期:2014-03-24。
国家重点基础研究发展计划(2011CB710800)、国家高技术研究发展计划(2011AA02A209、2011AA02A210)、国家自然科学基金(21376107、21336009)、高等学校学科创新引智计划(111计划)(111-2-06)、高端外国专家项目(GDW20133200113)及江苏高校优势学科建设工程项目。
付敏杰(1988—),女,硕士研究生。E-mail jieminfu@yeah. net联系人:聂尧,教授,博士生导师,研究方向酶技术。E-mail ynie@ jiangnan.edu.cn。徐岩,教授,博士生导师。E-mail yxu@jiangnan.edu.cn。
